ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Введение
Оценка фиброза при хронических заболеваниях печени имеет решающее значение для прогноза и тактики терапии, в том числе для начала противовирусного лечения. Биопсия печени считается «золотым стандартом» для оценки фиброза и классификаций стадий, а также может оценивать некровоспалительную активность. Однако биопсия печени ограничивается ее инвазивностью и возможными серьезными осложнениями в 1% случаев, ошибкой выбора места получения материала, так как образец представляет собой примерно лишь 1/50000 объема печени и наличием меж- и внутреисследовательской вариабельности диагностики при микроскопической оценке. Поэтому неинвазивные методы оценки фиброза печени, в том числе ультразвуковые эластографические методы, стали интенсивной областью исследований [1].
Из-за различий между методами эластографии, описанными в предыдущих разделах, пороговые значения для фиброза зависят от системы и не могут быть приравнены к разным машинам. В настоящее время ТЭ является наиболее широко изученным методом вне радиологической практики, однако опубликован также значительный объем данных о других методах. Результаты, полученные pSWE (главным образом VTQ®) и 2D-SWE (главным образом SSI), показывают аналогичную точность по сравнению с TЭ для оценки жесткости печени, потенциально более расширенной возможностью применения [59, 112].
Становится все более очевидным, что лучшие пороговые значения различных методов эластографии, используемых для оценки наличия и тяжести фиброза печени, зависят от этиологии основного заболевания печени и от распространенности исследуемого состояния в целевой популяции. Хотя для цирроза, в зависимости от этиологии, были предложены различные пороговые значения (например, начиная с модуля Юнга 11 кПа при ХГВ до 22,6 кПа при алкогольной болезни печени), следует иметь в виду, что эти пороговые значения были определены в одной популяции с использованием ROC кривых с целью максимизации чувствительности и специфичности, но не были применены к числу сравнения. Различия между предельными значениями могут быть просто связаны с различиями в распространенности и тяжести цирроза в исследуемых группах населения, известными, как смещение спектра. Поэтому значения эластографии должны интерпретироваться специалистом-гепатологом, который должен знать клинические аспекты заболевания печени и знать особенности эластографии вообще и каждой техники эластографии в частности.
Помимо увеличения данных по жесткости печени, измеренных с помощью различных методов для выявления фиброза печени и цирроза (подробно описано в следующих параграфах), проводятся испытания и новых других возможностей эластографии в сфере заболеваний печени. Они включают оценку жесткости селезенки при портальной гипертензии, оценку жесткости очаговых поражений печени, с целью дифференциальной диагностики доброкачественных и злокачественных узлов. Эти приложения кажутся многообещающими, но остаются в разработке, поэтому пока не могут быть рекомендованы в клинической практике.
Клинические требования
Диапазоны для промежуточных стадий фиброза (F2-F3) достаточно узкие и для модуля Юнга составляют в пределах 2-3 кПа (в полном диапазоне от 2 до 75 кПа с TE), так что небольшие различия в результатах, могут сдвинуть данные пациентов из одной стадии на другую [141]. Однако в ситуации «реальной жизни» внимание должно быть сосредоточено на пациенте и то, что подходит с точки зрения клиники. После появления новых противовирусных препаратов, Европейская ассоциация по изучению печени (EASL) совместно с Латиноамериканской ассоциацией по изучению печени (ALEH) подготовили рекомендации по клиническому применению неинвазивных тестов для оценки тяжести заболевания печени и прогноза [76]. В этих Рекомендациях указано, что двумя клинически значимыми конечными точками у пациентов с вирусным гепатитом является выявление значительного фиброза (F≥2) и выявления цирроза (F = 4), а наиболее важной конечной точкой является выявление цирроза, поскольку он нуждается в лечении (рекомендация А1). У пациентов с НАЖБП и с хроническими заболеваниями печени другой этиологии, выявление цирроза также является наиболее важной клинической конечной точкой (рекомендация А1).
Клиническое принятие решений в эластографии
Эластография разработана, как неинвазивный инструмент для идентификации и установления стадии фиброза печени, и ее следует использовать соответствующим образом. В частности, результат следует интерпретировать вместе с диагностическими анализами, направленными на выявление причины заболевания печени. Это важно, поскольку интерпретация значений эластографии печени зависит от конкретного клинического сценария, распространенности заболевания в исследуемой популяции, сопутствующих заболеваний пациента и этиологии заболевания печени.
Оценка жесткости печени не является частью процесса скрининга и первичной оценки. Основная причина этого заключается в том, что рациональный пошаговый подход к диагностике и постановке диагноза заболевания печени должен следовать тому же алгоритму, который используется для любого другого заболевания, чтобы оптимизировать использование ресурсов, ограничить расходы и свести к минимуму риск ятрогенной травмы. Основой любого диагностического подхода является анамнез, физический осмотр и лабораторные анализы, после чего следует использовать неинвазивные диагностические методы, в идеале от менее дорогих, придерживаясь сбалансированного взгляда на стоимость и точность каждого конкретного клинического вопроса. Использование инвазивных методов, которые всегда предполагают определенный риск для пациентов, должно быть ограничено показанием, когда предыдущие этапы не обеспечивали достаточной информацией. Кроме того, несмотря на то, что эластографические методы все чаще используются и доступны в диагностических центрах, они еще не являются общедоступными и требуют опыта. Поэтому эластография является частью процесса принятия клинических решений.
Перед проведением эластографичной оценки печени рекомендуется сбор анамнеза, клиническое обследование и ультразвуковое обследование брюшной полости в В-режиме. Эта стратегия выявляет наличие асцита, опухолевых образований в печени, обструкцию желчного дерева и признаки нарушения функции сердца. Прямая эластографическая оценка печени сокращает время обследования, снижает стоимость и может быть выполнена квалифицированными медицинскими техниками (для TЭ).
То, что эластография не используется в качестве метода скрининга первой линии при заболеваниях печени, позволяет провести соответствующую диагностическую работу у пациентов без значительного фиброза при эластографии. У этих пациентов может быть заболевание печени, склонное к прогрессированию, несмотря на нормальные показатели эластографии.
Скрининг
Согласно принципам ВОЗ для скрининга заболеваний [142], скрининговый тест должен обеспечивать высокую достоверность, надежность и приемлемость в обследованной популяции в дополнение к положительному балансу между результатом и затратами, а также доступными последующими исследованиями в случае положительного теста. Таким образом, SWE может быть приспособлена для скрининга бессимптомных заболеваний печени в популяциях с низкой распространенностью. Однако, недостаточно данных для оценки ценности SWE для населения в группах высокого риска с внутривенным употреблением наркотиков, сахарным диабетом, ожирением и/или злоупотреблением алкоголя, или у мигрантов из районов с высокой распространенностью ВГС и ВГВ [61, 143-145].
ТЭ, как процедура скрининга в общей популяции> 45 лет, была оценена в двух крупных исследованиях с общим количеством 4700 здоровых людей [61, 143]. Одно исследование показало, что наличие сахарного диабета и ожирения связано с модулем Юнга выше 8 кПа. Однако ни в одном из исследований систематически не изучались причины повышенной жесткости печени у участников с положительным результатом.
Первоначальная оценка хронического заболевания печени
(Предпосылки для SWE)
Начальная диагностика пациента с нарушениями в биохимических и/или функциональных тестах печени включает опрос о текущих жалобах, изучение прошлой медицинской истории для выявления потенциальных факторов риска для заболеваний печени и проведение физикального обследования с целью выявления этиологических причин и признаков хронического заболевания печени. Эластография не должна выполняться без осведомленности о текущих жалобах, анамнеза болезни и основных лабораторных данных.
Обычное ультразвуковое исследование в В-режиме
УЗИ может быть частью первоначальной оценки [146], особенно если оборудование находится в клинике. Обычное ультразвуковое исследование в В-режиме может использоваться не только для выявления классических признаков установленного цирроза, но также для определения наличия билиарной дилатации, что указывает на внепеченочный холестаз, признаки сердечной недостаточности или венозной печеночной патологии, которые являются условиями, ограничивающими точность эластографии. Также может быть проведен скрининг в B-режиме для локальных поражений печени, определения размера селезенки, венозных коллатералей, асцита и других признаков портальной гипертензии. Асцит исключает использования TЭ эластографии. Знание общепринятых результатов ультразвукового исследования в В-режиме обязательно для проведения компрессионного или SWE эластографического обследования, или, как минимум, влияет на интерпретацию результатов эластографии. Допплеровское ультразвуковое исследование является основным инструментом для оптимизации ультразвукового исследования в В-режиме и исключения сосудистой патологии печени, что является эффективным для определения осложнений хронического заболевания печени, например, портальной гипертензии.
В заключение, у пациентов с патологией печени с неясной этиологией, эластография не должна интерпретироваться без полной ультразвуковой оценки верхней части живота (B-режим и допплерография).
ХРОНИЧЕСКИЙ ГЕПАТИТ C (ХГC)
Стадии фиброза
Транзиентная эластография
У пациентов с ХГС TЭ может дифференцировать отсутствие или умеренный фиброз от значительного фиброза и цирроза, но при этом точность недостаточна, для дифференциальной диагностики отдельных стадий фиброза (F1 – F4) [147 – 149]. Модуль Юнга, превышающий 6,8-7,6 кПа, указывает на высокую вероятность значительного фиброза (F ≥ 2) при биопсии. Однако, оптимальные пороговые значения могут значительно варьироваться в зависимости от распространенности фиброза, и могут составлять от 5,2 кПа до 9,5 кПа, как указано в клинических практических руководствах EASL [76]. Соответственно, оптимальные пороговые значения для прогнозирования цирроза (F = 4), находятся в пределах от 11 до 15 кПа [76]. Поэтому при адаптации предельных значений для клинического использования, необходимо учитывать локальную распространенность фиброза и диагностическую цель (чувствительный скрининг или безопасная стратегия исключения). Следует подчеркнуть, что ТЭ дает лучшие диагностические показатели в контексте диагностики цирроза, и это работает лучше при исключении, чем при определении цирроза.
У пациентов с ХГС с сопутствующей ВИЧ инфекцией TЭ может использоваться с аналогичной диагностической точностью, по сравнению с ВГС-инфекцией, только для выявления фиброза и цирроза [150]. TЭ также может быть эффективной у пациентов после трансплантации печени для выявления стадии повторного фиброза и цирроза [151].
Использование TЭ для диагностики цирроза и оценки тяжести фиброза при ХГС было одобрено в рекомендациях по лечению вирусного гепатита EASL и ALEH, в идеале, в сочетании с альтернативным и не связанным неинвазивным подходом, таким как лабораторные тесты/маркеры сыворотки фиброза печени [152] . В случае неэффективности ТЭ диагностики или неубедительности результатов неинвазивного лабораторного теста, по-прежнему рекомендуется биопсия в случае, если стадирование фиброза играет решающее значение для принятия клинического решения. Однако может быть рассмотрена предыдущая попытка применения альтернативного метода SWE.
| РЕКОМЕНДАЦИЯ 16
TЭ может использоваться в качестве первой линии для оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом C. Методика эффективна относительно исключения цирроза печени (LoE 1b, GoR A) [25, 150, 152]. Широкий консенсус (17/0/1, 94%) |
Точечная сдвиговолновая эластография (pSWE)
Как и в случае TЭ, количественная оценка VTQ® SWS широко изучалась у пациентов с ХГС. Предельные значения от 1,21 м/с до 1,34 м/с прогнозируют значительный фиброз (F ≥ 2) (AUROC 0,85-0,89), тогда как отрезки VTQ® между 1,55 м/с и 2 м/с (AUROC 0,89-0,93) прогнозируют цирроз [104, 153]. Диагностические характеристики VTQ® в сравнении с TЭ [154] с высокой точностью для прогнозирования значительного (F ≥ 2, AUROC 0,87) и тяжелого фиброза (F ≥ 3, AUROC 0,91), а также цирроза (AUROC 0,93) [ 155]. Однако расхождение (> одной стадии фиброза) между VTQ® и гистологией отмечено в > 30%, в исследовании, включавшем 106 пациентов, инфицированных ВГС. Несоответствие было связано с женским полом и высоким межквартильным диапазоном (IQR / M ≥ 30%) модуля Юнга [107]. Поэтому результаты pSWE требуют осторожной интерпретации. Доказательства метода ElastPQ® ограничены [70, 156]. Результаты экспериментального исследования [70] для постановки фиброза аналогичные результатам, полученным для VTQ®, но необходимы дополнительные подтверждающие данные. Биомаркеры фиброза могут помочь в диагностике неоднозначных случаев [157].
| РЕКОМЕНДАЦИЯ 17
pSWE, как продемонстрировано с помощью VTQ®, может быть использована в качестве первой линии оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом C. Методика эффективна относительно исключения цирроза печени (LoE 2a, GoR B) [155]. Широкий консенсус (17/0/1, 94%) |
2D сдвиговолновая эластография (2D-SWE)
2D-SWE с использованием SSI была опубликована в нескольких исследованиях у пациентов с ХГС [139, 158]. Диагностическая точность была высокой для выявления значительного и прогрессирующего фиброза и цирроза (AUC> 0,90). В этих исследованиях диагностическая эффективность для 2D-SWE была лучше, чем для TЭ [139, 159] и маркеров фиброза сыворотки (индекс FIB-4, индекс APRI и Forns) [159]. В одном исследовании, включавшем 102 пациента с хронической сердечной недостаточностью, в 2D-SWE была отличная диагностическая точность для выявления тяжелого фиброза и цирроза (AUROC> 0,90 для обоих) [91].
| РЕКОМЕНДАЦИЯ 18
Методика 2D-SWE, как продемонстрировано с помощью SSI, может быть использована в качестве первой линии для оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом C. Методика эффективна относительно исключения цирроза (LoE 1b, GoR A) [139, 158, 159] . Широкий консенсус (17/0/1, 94%) |
Компрессионная эластография
Среди производителей SE для оценки фиброза при заболеваниях печени и вирусных гепатитах была изучена только для Hitachi. Были предложены различные баллы для полуколичественной интерпретации SE в печени [1]. С одной стороны, этот метод дал многообещающие результаты для прогнозирования фиброза печени у азиатских пациентов, с другой стороны, его эффективность была ниже, чем TЭ у европейских пациентов [121, 125]. Новые данные по этой методике отсутствуют.
Прогнозирование печеночных осложнений
Рост доказательной базы поддерживает использование TЭ для стратификации риска и прогнозирования клинических конечных точек. Жесткость печени прогнозирует 5-летнюю смертность с лучшей точностью, чем гистологическая стадия фиброза (METAVIR) для моноинфикованих ВГС пациентов (TЭ> 9,5 кПа) [160], и пациентов с ВИЧ коинфекцией (TЭ> 9,0 кПа) [161] . Кроме того, повышенный модуль Юнга указывает на повышенный риск развития ГЦК (TЭ> 10 кПа) [162], печеночную декомпенсацию и кровотечение из варикозных вен пищевода [163]. Специально для пациентов с установленным диагнозом цирроза, TЭ может использоваться для группировки пациентов в различные классы риска [162]. Комбинация жесткости печени (модуль Юнга> 14 кПа) с количеством тромбоцитов (<141×103/мкл) и ответом на противовирусную терапию, может увеличить прогностическое значение ТЭ для развития ГЦК [164]. У пациентов с компенсированным циррозом печени, жесткость печени помогает идентифицировать пациентов с портальной гипертензией (см. Раздел рекомендации по портальной гипертензии). Данные о прогнозе конечной точки от фирм, которые используют pSWE и 2D-SWE отсутствуют, и, соответственно, отсутствуют рекомендации, основанные на достаточной доказательной базе. Две группы оценивали прогностическое значение ТЭ у пациентов с трансплантацией печени и рецидивом инфекции ВГС [165, 166]. Модуль Юнга> 8,7 кПа через 12 месяцев после трансплантации печени был связан со значительным снижением пятилетней выживаемости трансплантата и кумулятивной выживаемости пациентов [165].
Роль эластографии в определении плана лечения ВГС
Роль SWE в идентификации пациентов, которым необходимо лечение
В условиях отсутствия широкого доступа к препаратам прямого противовирусного действия (ПППД, DAA – direct-acting antiviral agents) из-за их высокой стоимости, в разных странах были реализованы стратегии приоритетности пациентов для назначения терапии. TЭ используется как исследование первой линии для определения приоритетности пациентов с ВГС для ПППД (например, значения модуля Юнга ≥ 7,1 кПа считаются эквивалентными фиброзу ≥F2, а значения ≥ 9,5 кПа считаются эквивалентными фиброзу ≥F3). В странах, использующих стратегии на основе интерферонов, TЭ может помочь идентифицировать пациентов с циррозом, у которых более низкая вероятность достижения устойчивого вирусологического ответа (УВО: ВГС-РНК не проявляется через 2-4 недели после завершения антивирусной терапии).
Роль SWE во время лечения (мониторинг)
Ограниченные данные, полученные во время терапии на основе интерферона, показывают, что повышение жесткости печени, измеренное с помощью TЭ во время лечения, указывает на снижение возможности достижения устойчивого вирусологического ответа [167, 168]. Данные у пациентов, получающих противовирусную терапию без интерферонов, свидетельствуют о том, что жесткость печени быстро снижается во время лечения, даже у пациентов с развитым фиброзом и циррозом. Это снижение, по-видимому, отражает снижение воспаления печени, восстановление функции печени и снижение портального давления, подобно эффекту ликвидации ВГС [169, 170].
Роль SWE после лечения (контроль в ходе наблюдения)
Данные по эффективности мониторинга жесткости печени при проведении противовирусной терапии – мизерные. В наиболее опубликованном проспективном исследовании (n = 91), значительное снижение жесткости печени наблюдалось во время терапии пег-интерфероном и рибавирином; снижение жесткости печени продолжалось после лечения только у пациентов, достигших УВО [171]. В эпоху ПППД важно отметить, что после успешной ликвидации ВГС, использование пороговых значений к лечению может ухудшить точность TЭ [172, 173], и это может привести к ошибочным выводам, если статус УВО не учитывается [170]. В нескольких исследованиях было оценено использование VTQ® для мониторинга противовирусной терапии на основе интерферонов у пациентов с ВГС: уменьшение или увеличение SWE отражает ответ или, соответственно, отсутствие ответа на лечение [174-176]. Для противовирусной терапии без интерферонов данные отсутствуют.
Мониторинг пациентов с циррозом после УВО станет новым стандартом в эпоху ПППД. Несмотря на соблазн использовать SWE в этой ситуации для наблюдения за динамикой жесткости печени с течением времени, на данном этапе нет рекомендаций относительно пороговых значений и временного интервала для идентификации регрессии цирроза.
| РЕКОМЕНДАЦИЯ 19
SWE не рекомендуется для контроля динамики фиброза при анти-ВГС лечении (LoE 3, GOR D) [172, 173]. Сильный консенсус (18/0/0, 100%) |
| РЕКОМЕНДАЦИЯ 20
Изменения LSM после успешного анти-ВГС лечения не должны влиять на стратегию ведения пациента (например, динамическое наблюдение за развитием ГЦК у пациентов из группы риска) (LoE 3, GOR D) [76]. Широкий консенсус (16/0/1, 94%) |
Хронический гепатит B (ХГВ)
Введение
Опубликовано более 50 исследований по эластографии при ХГВ. Большинство из них используют TЭ, но также оценивают эластографические методы pSWE и 2D-SWE.
Стадии фиброза
Важнейшая цель неинвазивных диагностических методов – диагностика компенсированного цирроза, который бы получил эффект от лечения, независимо от уровня трансаминаз [177].
Транзиентная эластография
Транзиентная эластография является наиболее проверенным эластографическим методом для диагностики ХГВ и имеет аналогичную точность в этом клиническом сценарии, по сравнению с ХГС [76]. Три метаанализа подтвердили хорошую эффективность TЭ при диагностике ХГВ [178-180]. Несмотря на то, что LSM демонстрирует существенное наложение данных между соседними стадиями фиброза (особенно на выраженных стадиях фиброза), LSM может эффективно идентифицировать пациентов с ≥F2 и F4. Недавние публикации подтвердили предыдущие утверждения о том, что AUROC для ≥ F2 изменяется от 0,80 до 0,90 [181, 182] с предельными значениями модуля Юнга между 6,6 кПа и 8,8 кПа [182, 183]. Что касается идентификации цирроза (F4), последние данные подтверждают предыдущее утверждение, при этом AUROC составляет от 0,81 до 0,97 [182], а пороговые значения находятся между 9,4 и 13,4 кПа [184, 185]. Недавний метаанализ показал, что значение > 11,7 кПа должно вызвать подозрение на наличие цирроза [178]. Было высказано предположение, что пороговые значения LSM должны быть адаптированы к уровням трансаминаз [185], поскольку уровни трансаминаз, как правило, влияют на LSM при ХГВ, а обострение гепатита часто наблюдается при ХГВ. Однако недавние исследования показали, что АЛТ-адаптированные пороговые значения не влияют на диагностическую эффективность ТЭ [186] и, что единственной переменной, связанной с переоценкой стадии F4 при ХГВ, является умеренная/тяжелая некровоспалительная активность без прямой корреляции с уровнем трансаминаз [187 ]. Интересно, что модуль Юнга <5 кПа у пациентов с нормальным АЛТ и низким уровнем ДНК сыворотки ВГВ (<2000 МЕ / мл) характеризует неактивных носителей ВГВ [188, 189]. TЭ можно использовать для исключения значительного фиброза и цирроза у неактивных носителей ВГВ, что является лучшим показанием для ТЭ при ВГВ.
| РЕКОМЕНДАЦИЯ 21
TЭ эффективна у пациентов с ХГВ для выявления цирроза печени. Необходима сопутствующая оценка трансаминаз, чтобы исключить обострение процесса (превышение более чем в 5 раз верхней границы нормы). (LoE 1b, GoR A) [178-180]. Широкий консенсус (17/1/0, 94%) |
| РЕКОМЕНДАЦИЯ 22
TЭ эффективна у неактивных носителей ВГВ для исключения фиброза (LoE 2, GOR B) [188, 189]. Сильный консенсус (18/0/0, 100%) |
Сдвиговолновая эластография (pSWE)
VTQ® имеет преимущество в более низкой частоте неудачных исследований и, при этом, имеет аналогичную TЭ диагностическую эффективность. У методики хорошая способность к дифференциальной диагностике стадии фиброза при ХГВ, с AUROC для ≥ F2 и F4 0,76 – 0,91 [184, 190] и 0,72 – 0,97 [155, 184], соответственно. Эти результаты были подтверждены в мета-анализе, включавшем пациентов с несколькими этиологическими заболеваниями печени. Анализ данных пациентов с ХГВ показал AUROC для ≥ F2 0,88, а лучшим предельным значением было 1,35 м/с, а AUROC для F4 было 0,93, а лучшим предельным значением – 1,87 м/с [191, 192 ]. Информация о других методах pSWE ограничена. Техника ElastPQ® была использована для стадирования пациентов с ХГВ в четырех исследованиях, с хорошими показателями для стадирования фиброза печени. Нужна дополнительная валидизация данных [106, 192 – 194].
2D сдвиговолновая эластография (2D-SWE)
Недавно техника 2D-SWE (SSI) была протестирована у пациентов с ХГВ и показала более низкую частоту неудачных исследований, чем ТЭ, и, по меньшей мере, аналогичную эффективность для стадирования фиброза [195]. AUROC для ≥ F2 изменяется от 0.85 до 0.91 [58, 196], с предельным значением модуля Юнга между 7.1 и 8.0 кПа [195, 196], в то время как AUROC для F4 меняется от 0.92 до 0.98 [195, 197], с оптимальным предельным значением между 10,1 и 11,7 кПа [58, 195]. Лучшим показанием для 2D-SWE в ВГВ является исключение диагноза значительного фиброза и цирроза у неактивных носителей.
| РЕКОМЕНДАЦИЯ 23
Методика pSWE, как показано с помощью VTQ®, эффективна у пациентов с ХГВ для выявления цирроза (LoE 2a, GoR B) [191]. Сильный консенсус (18/0/0, 100%) |
| РЕКОМЕНДАЦИЯ 24
Методика 2D-SWE, как продемонстрировано с помощью SSI, эффективна у пациентов с ХГВ для выявления цирроза (LoE 3a, GoR C) [196, 197]. Широкий консенсус (17/0/1, 94%) |
Мониторинг (оценка) ответа на лечение
При лечении нуклеозид/нуклеотидными аналогами, жесткость печени, измеренная методом TЭ, значительно уменьшается, независимо от базовых значений АЛТ [198, 199]. Единственными факторами, связанными со снижением LSM, являются более высокие исходные уровни LSM и ДНК ВГВ [198]. Диагностическая точность и пороговые значения жесткости печени при использовании TЭ могут отличаться у нелеченых и леченых пациентов с хроническим гепатитом B и C. Этот аспект должен быть учтен при интерпретации результатов эластографии. Более того, даже если жесткость печени снижается при антивирусном лечении, неизвестно, отражает ли это регрессию заболевания, при этом изменения LSM также не должны влиять на тактику лечения.
| РЕКОМЕНДАЦИЯ 25
Изменения LSM при лечении ВГВ не должны влиять на терапевтическую стратегию (например, динамическое наблюдение за возникновением ГЦК у пациентов с высоким риском) (LoE 2b, GOR B) [198, 199]. Сильный консенсус (16/0/0, 100%) |
Прогностическая значимость
Базовая линия LSM по TЭ имеет умеренную прогностическую значимость с AUROC между 0.70 и 0.73 для патологии печени [200, 201], что может быть улучшено до уровня 0,83, путем добавления диаметра селезенки и количества тромбоцитов, как модель прогнозирования под названием LSPS (=LSM×диаметр селезенки/количество тромбоцитов) [202]. TЭ является хорошим прогностическим маркером развития ГЦК, которая может протекать без цирроза. Модуль Юнга> 8 кPa – значение, указывающее на необходимость начать скрининг на наличие ГЦК, даже если был достигнут полный вирусологический ответ [203, 204]. Риск ГЦК еще выше, если модуль Юнга TE> 12-13 кПа, что также предполагает повышенный риск декомпенсации [181, 203-205].
Неалкогольная жировая болезнь печени (НАЖБП)
У пациентов с НАЖБП неинвазивные маркеры должны быть нацелены на следующее: а) идентифицировать риск НАЖБП/НАСГ среди лиц с метаболическим синдромом; в) выявлять лиц с худшим прогнозом; с) отслеживать прогресс заболевания; d) прогнозировать ответ на лечение.
Стадии фиброза
Транзиентная эластография
Особой проблемой у пациентов с НАЖБП является частота неудачных эластографий. В различных исследованиях сообщается об увеличении числа неудачных эластографий из-за увеличения индекса массы тела (ИМТ> 30 кг/м2) или окружности талии, что может препятствовать передаче толчковых импульсов и трекинга ультразвука, препятствуя правильной оценке жесткости печени. Вторая проблема у пациентов с НАЖБП заключается в наличии двух датчиков (M и XL- датчиков), причем последний предназначен для использования в группах с избыточным весом. Сравнивая диагностические характеристики двух датчиков, у пациентов с ожирением датчик XL предоставляет более надежные результаты, чем M-датчик. Основными ограничивающими факторами для XL-датчика являются расстояние от кожи к печени> 3,4 см и крайняя степень ожирения (ИМТ> 40 кг/м2). Третья проблема заключается в том, что F3-F4 фиброз является важнейшим прогностическим фактором результатов при патологии печени и смертности у пациентов с НАЖБП.
TЭ имеет лучшую эффективность для диагностики цирроза, чем для значительного фиброза [206, 207]. TЭ имеет более высокую частоту ложноположительных, чем ложноотрицательных результатов, и более высокое отрицательное прогностическое значение (ОПЗ), чем положительное прогностическое значение (ППЗ, PPV). Таким образом, способность диагностировать промежуточный фиброз или цирроз недостаточна для принятия клинических решений [208, 209]. Систематическое обследование TЭ у пациентов с НАЖБП включало 9 исследований и 1047 пациентов [210]. TЭ была замечательной для диагностики фиброза F3 (чувствительность 85%, специфичность 82%) и цирроза (92% чувствительность, 92% специфичность), но имела умеренную точность для фиброза F2 (чувствительность 79%, специфичность 75%).
С М-датчиком пациенты со стеатозом> 66% при биопсии печени имели более высокие значения LSM, что приводило к более высоким ложноположительным результатам LSM [52]. Таким образом, у пациентов с ожирением с высокой степенью стеатоза, TЭ (с использованием M-датчика) может быть менее точными при диагностике тяжелого фиброза при НАЖБП, что требует дополнительной оценки, чтобы избежать переоценки фиброза. Все же необходимы дополнительные исследования влияния стеатоза на LSM, измеренные с помощью XL-датчика. XL-датчик дает более низкие значения жесткости, чем M-датчик. Поэтому, следует использовать различные пороговые значения [85]. При использовании М-датчика при пороговом значении модуля упругости Юнга 7,9 кПа, чувствительность, специфичность, PPV и NPV для F3 или большей стадии составляют 91%, 75%, 52% и 97% соответственно [55].
У пациентов с НАЖБП лучшим пороговым значением для F3 или большей стадии является 7,2 кПа. При этом пороговом значении, NPV для исключения F3 или большей стадии составляет 89% (95% ДИ 84-95%). Пороговые значения 5,7 кПа и 9,3 кПа имеют 90%-ную чувствительность и специфичность, для исключения и подтверждения стадии F3, соответственно [55].
| РЕКОМЕНДАЦИЯ 26
TЭ может быть использована для исключения цирроза у пациентов с НАЖБП (LoE 2a, GoR B) [76, 210]. Широкий консенсус (13/0/3, 81%) |
Точечная сдвиговолновая эластография (pSWE)
Недавно был опубликован систематический обзор 7 исследований 723 пациентов, подвергшихся SWS измерениям с помощью метода VTQ®, для оценки диагностической эффективности pSWE у пациентов с НАЖБП [211]. Суммарная чувствительность для выявления значительного фиброза составила 80,2%, что не является подходящей конечной точкой.
2D сдвиговолновая эластография (2D-SWE)
Существует только два исследования, которые оценивают эффективность 2D-SWE (SSI) [57, 212]. Результаты слишком ограничены, чтобы давать рекомендации.
Сравнение различных эластографических методов для НАЖБП
В одном исследовании недавно было проведено сравнение TЭ (с использованием M-датчика), pSWE (VTQ®) и 2D-SWE (SSI) у 291 пациента с НАЖБП, в двух разных больницах [57]. Все методы показали значение AUROCs ≥ 0,84 для тяжелого фиброза и цирроза и имели аналогичную эффективность для диагностики этой конечной точки. Диагностическая эффективность 2D-SWE была выше, чем в VTQ® для диагностики значительного фиброза.
Наблюдение за пациентами
Мониторинг прогрессирования фиброза также необходим при наблюдении за этими пациентами. Пациенты, у которых при 6-месячном наблюдении наблюдалась потеря веса на 5%, наблюдалось снижение LSM по данным TЭ, независимо от изменений уровней аминотрансферазы [208]. Для pSWE и 2D-SWE нет данных.
Прогнозирование осложнений патологии печени
Недавнее исследование поддерживает использование TЭ для стратификации риска и прогнозирования клинических конечных точек [213]. Для pSWE и 2D-SWE нет данных по этому аспекту, и, соответственно, рекомендаций, основанных на доказательствах.
Алкогольная болезнь печени (АБП)
Стадии фиброза
Транзиентная эластография у пациентов с предыдущим или текущим хроническим злоупотреблением алкоголем, может дифференцировать отсутствующий и умеренный фиброз (F0 – 1) от тяжелого фиброза и цирроза, но, как и с другой этиологией, не может достоверно дифференцировать отсутствующий и умеренный фиброз от значительного фиброза. [214] Кроме того, в восьми опубликованных исследованиях TЭ одной этиологии для постановки фиброза печени, не было единого консенсуса относительно оптимальных пороговых значений у молодых пациентов для значительного фиброза (≥F2), тяжелого фиброза (≥F3) или цирроза (= F4) [ 49, 56, 215-220]. Оптимальные пороговые значения варьируют от 7,8 [216] до 9,6 [56] кПа для значительного фиброза, от 8,0 [49] до 17,0 [218] кПа при тяжелом фиброзе и от 12,5 [49] к 22,7 [215] кПа для цирроза. Значительная несогласованность между предельными значениями в отдельных исследованиях, вероятно, является следствием неравномерного распределения стадий фиброза, с преобладанием пациентов с циррозом, местом отбора пациентов, также неизвестно, были исключены пациенты с алкогольным гепатитом или декомпенсированными заболеваниями.
TЭ больше подходит для исключения, чем для выявления цирроза. При модуле Юнга 12,5 кПа TЭ может исключить цирроз с отрицательным соотношением правдоподобия 0,07, если распространенность заболевания составляет 50% или ниже [214].
| РЕКОМЕНДАЦИЯ 27
TЭ может быть использована для исключения цирроза у пациентов с алкогольной болезнью печени при отсутствии острого алкогольного гепатита (LoE 2b, GoR B) [56, 214, 219, 220]. Сильный консенсус (15/0/0, 100%) |
Прогнозирование алкогольного цирроза печени
Существует небольшое количество доказательств, позволяющих предположить роль ультразвуковой эластографии для определения прогноза и мониторинга пациентов с алкогольным заболеванием печени [221], а для ТЭ – прогнозирование варикозного расширения вен пищевода [222] и градиента давления в печеночных венах (ГДПВ) у пациентов с алкогольным циррозом [221].
Сроки измерения жесткости печени в зависимости от алкогольной абстиненции
У пациентов, подвергающихся алкогольной детоксикации от 0,5 до 4 недель путем удержания вызывает клинически значимое снижение значений LSM при TЭ [49-51, 223]. Однако, снижение может быть связано с нормализацией трансаминаз, билирубина, щелочной фосфатазы и/или гамма-глутамилтрансферазы. Поэтому неясно, вызывает повышение уровня жесткости печени только алкоголь, или вызванный алкоголем гепатит и повреждения холангиоцитов. [220]. Одно исследование предполагает, что TЭ является точным для определения стадии у пациентов, продолжающих злоупотреблять алкоголем, но с нормальной гамма-глутамилтрансферазой [56], в то время как другое исследование предполагает, что площадь под кривой (AUC) для диагностики цирроза у алкоголиков уменьшается, когда АСТ выше 100-150 Ед / л [220].
Скрининг населения или групп высокого риска в первичном звене
Ультразвуковая эластография для систематического скрининга алкогольной болезни печени групп высокого риска в первичном медицинском звене была выполнена в одном исследовании. Терапия была предложена пациентам с соотношением АСТ/АЛТ ≥ 0,8 [224]. Однако, это исследование не включало проведение биопсии у пациентов с повышенным ТЭ. В диагностическом исследовании, TЭ имела отличную диагностическую точность для значительного фиброза и цирроза в подгруппе из 71 пациента, набранной из первичных центров реабилитации алкоголиков [56].
При распространенности цирроза 2-4% в фоновой популяции лиц, принадлежащих к группе риска [225], положительное прогностическое значение ТЭ следует считать низким, независимо от пороговых значений.
Точечная сдвиговолновая эластография (pSWE) и 2D-SWE
Существует только одно исследование, которое подтверждает использование 2D-SWE (SSI) для оценки алкогольного фиброза печени [56]. Есть три небольших исследования по использованию pSWE [226 – 228], два из которых сообщают о диагностической точности. Результаты согласуются с точностью диагностики, что позволяет предположить, что VTQ® может использоваться для исключения тяжелого фиброза и цирроза. Однако результаты, относящиеся к пороговым значениям, противоречивы. Поэтому нет достаточных доказательств для того, чтобы давать рекомендации по использованию VTQ® для дифференциальной диагностики отсутствия и легкого фиброза (F0 – F1) от значительного или тяжелого фиброза и цирроза. Таким образом, пока недостаточно доказательств для оценки роли pSWE или 2D-SWE при АБП.
Холестатическая болезнь печени и аутоиммунный гепатит (АИГ)
Стратификация риска является одной из основных проблем пациентов с хроническими холестатическими заболеваниями, для проведения индивидуального клинического подхода и отбора кандидатов для клинических испытаний новых лекарств. Исследований жесткости печени, как показателя фиброза печени и прогнозирования, с упором на холестатическое заболевание печени (первичный билиарный холангит, первичный склерозирующий холангит) и АИГ, на данный момент недостаточно. Большинство доступных данных сосредоточено на TЭ [229 – 231].
Транзиентная эластография
Транзиентная эластография в настоящее время считается одним из лучших методов диагностики фиброза при первичном билиарном холангите. Высокий восходящий уровень или увеличение значений LSM со временем указывают на плохой прогноз у этой группы населения [191, 229]. Жесткость печени изучалась в 73 пациентов при первичном склерозирующем холангите, которые регулярно проходили клиническое и эластографическое наблюдение [232]. Данные LSM могли дифференцировать тяжелый и легкий фиброз с высокой избирательной точностью для цирроза (AUROC 0,88). Между двумя операторами была высокая воспроизводимость данных. Более высокий восходящий уровень LSM и увеличение LSM с течением времени были связаны с неблагоприятным исходом, такими как смерть, трансплантация печени, асцит, печеночная энцефалопатия, желудочно-кишечные кровотечения или ГЦК [232]. Дилатация внутрипеченочной желчной системы, вызванная доминантной стриктурой, должна быть исключена при первичном склерозирующем холангите перед интерпретацией LSM. Холестаз повышает жесткость печени независимо от фиброза печени.
Данные о детской популяции с атрезией желчных путей свидетельствуют о том, что эластография печени (и селезенки) может быть ценным инструментом для прогнозирования результатов к операции, а также может быть использована после операции Касаи, для мониторинга заболеваний печени и портальной гипертензии [233].
Из-за ограниченных доказательства, невозможно дать рекомендации.
Точечная сдвиговолновая эластография (pSWE)
VTQ® была изначально выполнена у 9 пациентов с АИГ и первичным билиарным и склерозирующим холангитом, имеющих более высокие скорости сдвига волны, чем здоровые добровольцы [234]. В целом два исследования касались VTQ® при АИГ и первичном билиарном холангите. У 15 пациентов с леченым АИГ, VTQ® может дифференцироваться между отсутствием фиброза и значительным фиброзом [235]. SWS, оцененная при VTQ®, показала хорошую диагностическую точность для выявления цирроза (AUROC 0.91) у 61 пациента с первичным билиарным холангитом [236].
2D сдвиговолновая эластография (2D-SWE)
Данные о 2D-SWE для пациентов с АИГ и первичным билиарным и склерозирующим холангитом, недоступны. Оценка жесткости печени помогла дифференцировать милиарную атрезию и неонатальный гепатит в одном исследовании [237]. Из-за малого количества данных рекомендации не даются.
Портальная гипертензия
Транзиентная эластография
У пациентов с компенсированным хроническим заболеванием печени/циррозом LSM коррелирует с градиентом давления в печеночных венах (ГДПВ). Несмотря на то, что корреляция между ними не позволяет оценить точное значение ГДПВ (диапазон: 0,59-0,70), способность показателей жесткости печени дифференцировать клинически значимую портальную гипертензию (КЗПГ, определяется, как ГДПВ ≥ 10 мм рт.ст. – пороговое значение возникновения осложнений) очень высока, а суммарное значение AUROC, в недавнем метаанализе, составило 0,93 [238]. Следует подчеркнуть, что большинство пациентов, включенных в исследование ГДПВ, имели вирусный или алкогольный цирроз, а данные, которые касаются других этиологий, ограничены. При вирусном циррозе значения модуля Юнга> 20-25 кПа являются высокоспецифическими для КЗПГ, а значения> 21 кПа прогнозируют начало первой клинической декомпенсации с точностью, подобной точности ГДПВ> 10 мм рт.ст. [239].
| РЕКОМЕНДАЦИЯ 28
LSM с помощью TЭ эффективно для выявления пациентов с высокой вероятностью наличия клинически значимой портальной гипертензии (ГДПВ ≥ 10 мм рт.ст.) (LoE 2b, GoR B) [238, 239]. Сильный консенсус (15/0/0, 100%) |
Точность LSM в прогнозировании наличия и размера гастроэзофагеальных вариксов была предметом нескольких исследований. Несмотря на то, что в настоящее время этот показатель является лучшим индивидуальным неинвазивным предиктором в этой области, с суммарным AUROC – 0,84 для пищеводных вариксов, и – 0,78 для больших пищеводных вариксов (в недавнем метаанализе) [238], пороговые значения широко варьируют среди исследований, а точность недостаточна для замены эндоскопии. Точность LSM для диагностики КЗПГ и варикозной болезни вен пищевода улучшается, если она сочетается с количеством тромбоцитов и размером селезенки [240, 241]. Недавние данные показывают, что если используется комбинация значения модуля Юнга <20 кПа и количества тромбоцитов > 150 г/л, варикозная болезнь вен пищевода, которая требовала лечения, может быть исключена с высокой точностью (менее 5% пропущенных пациентов) [242, 243 ], и, таким образом, эндоскопия может быть безопасно заменена [244].
Точечная сдвиговолновая эластография (pSWE)
Точечная SWE (VTQ®) использовалась в трех исследованиях, направленных на диагностику КЗПГ [245 – 247], и показала отличную эффективность и очень хорошую диагностическую точность (AUROC 0.82 – 0.90). Методика VTQ® была использована в нескольких исследованиях, направленных на выявление и установление тяжести варикозной болезни вен пищевода. SWS была выше у пациентов с пищеводными вариксами любого размера, и еще выше у пациентов с выраженным варикозным расширением [245, 246]. Однако надежных пороговых значений на данный момент нет. Из-за ограниченных доказательств не может быть дано четких рекомендаций относительно пороговых значений.
2D сдвиговолновая эластография (2D-SWE)
2D-SWE (SSI) была протестирована для диагностики КЗПГ в 4 исследованиях и еще одной небольшой серии [27 248-251]. Точность метода была достоверной во всех опубликованных исследованиях (AUROC 0,80 – 0,92).
В двух исследованиях было проведено сравнение между LSM и TE и 2D-SWE [27, 248]. TЭ имела меньшую частоту возможности применения, но оба метода показали подобную точность для диагностики КЗПГ.
LSM по данным 2D-SWE выше у пациентов с пищеводными вариксами любого размера и увеличивается у пациентов с большими варикозными узлами. Однако надежных пороговых значений на данный момент нет. Невозможно дать четкие рекомендации относительно пороговых значений для 2D-SWE, для этого необходима дополнительная доказательная база.
| РЕКОМЕНДАЦИЯ 29
Показатели жесткости печени с использованием TЭ в сочетании с подсчетом тромбоцитов эффективны для исключения варикозной болезни вен пищевода, что требует лечения (LoE 2b, GoR B) [244]. Хотя предварительные результаты дают надежду, однако нет достаточных данных, чтобы рекомендовать pSWE и 2D-SWE в этой ситуации. Широкий консенсус (13/0/1, 93%) |
Экономическая составляющая
Системы социального здравоохранения и неинвазивная оценка фиброза печени
Данные об экономической эффективности эластографии печени ограничены методикой ТЭ и в основном полученные из британских и канадских систем здравоохранения, что зависит от местных экономических условий здравоохранения. Хотя TЭ обычно считается неинвазивной альтернативой для определения стадии фиброза печени, которая помогает избежать биопсии печени [252], это не самый эффективный подход к использованию ресурсов в общеклинической практике [253]. TЭ считается экономически эффективной для ежегодного скрининга цирроза у пациентов, инфицированных ВГС [254], с наиболее экономически эффективной тактикой лечения для пациентов, инфицированных ВГС, не зависящих от категории фиброза («лечение всех») [253]. Однако в странах, которые не могут позволить себе тактику «лечение всех», ТЭ является общепринятым методом определения пациентов, которые заслуживают показания к лечению, исходя из большей выразительности фиброза, что делает его конкурентоспособным с точки зрения экономической эффективности по сравнению с биопсией, для выявления больших групп пациентов. Неточное неинвазивное стадирование фиброза может ограничить экономическую ценность эластографии [255]. Взвешенное отношение к диагностическим ограничениям и экономическим затратам эластографии в пользу лабораторных показателей фиброза, широко доступных и дешевых систем балльной оценки (например, индекса соотношения АСТ/тромбоциты), является рекомендуемым методом в регионах с ограниченными ресурсами здравоохранения [256]. Принимая во внимание растущую распространенность неалкогольного жирового заболевания печени (НАЗБП) в промышленно развитых странах, TЭ может представлять собой экономически эффективный подход для скрининга пациентов с риском прогрессирования этого заболевания и его осложнений [257, 258]. Однако официальное исследование, оценивает тяжкие последствия, такие как выживаемость, показатели госпитализации и т. д., в последнее время не проводилось, и вряд ли будет выполнено, учитывая необходимость в большом количестве пациентов.
Текущая финансовая компенсация в европейских странах
Финансовая компенсация часто ограничивается обычным ультразвуком (В-режим), включающим оценку жесткости печени на основе сдвиговой волны. Например, для TЭ (Fibroscan®) в Германии, в рамках обязательного медицинского страхования нет финансовой компенсации. В частной практике обычно взимается плата в размере 50-150 евро за исследования Fibroscan®. Во многих других европейских странах не существует какого-либо конкретного алгоритма финансовой компенсации. Там, где оплачивается ультразвуковая эластография (например, в некоторых регионах Италии), она принимается по коду ультрасонографии печени. Однако, один и тот же метод исследования не может быть проведен дважды в один и тот же день. Таким образом, традиционная ультрасонография и ультразвуковая эластография печени не могут быть финансово одновременно компенсированы при одном и том же назначении. Это ограничивает экономическую эффективность этой методики. В Румынии TЭ возмещается в системе ежедневной госпитализации с возможностью дальнейшей компенсации за pSWE и 2D-SWE. В частной практике стоимость TЭ составляет от 50 до 120 евро.
Перспективы: что делать дальше?
Одной из будущих возможностей эластографии печени является сравнение точности различных технологий (TЭ, pSWE и 2D-SWE) в большой когорте пациентов с распределением этиологии заболеваний печени. Вероятно, как показали предыдущие сравнительные исследования, у нас будут результаты, которые покажут преимущество новых технологий по сравнению с традиционными (pSWE или 2D-SWE, против TЭ). Необходимо установить надежные пороговые значения для каждой системы и различных заболеваний. Комбинация эластографических методов с использованием ультразвука и биологических тестов может улучшить точность диагностики пациентов.
ЛИТЕРАТУРА
1. Bamber J, Cosgrove D, Dietrich CF et al. EFSUMB guidelines and recommendations
on the clinical use of ultrasound elastography. Part 1: Basic principles and technology. Ultraschall in Med 2013; 34: 169–184
2. Shiina T, Nightingale KR, Palmeri ML et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 1: basic principles and terminology. Ultrasound Med Biol 2015; 41: 1126–1147
3. Sarvazyan AP, Rudenko OV, Nyborg WL. Biomedical applications of radiation force of ultrasound: historical roots and physical basis. Ultrasound Med Biol 2010; 36: 1379–1394
4. Urban MW, Chen S, Greenleaf J. Harmonic motion detection in a vibrating scattering medium. IEEE Trans Ultrason Ferroelectr Freq Control 2008; 55: 1956–1974
5. Urban MW, Chen S, Greenleaf JF. Error in estimates of tissue material properties from shear wave dispersion ultrasound vibrometry. IEEE Trans Ultrason Ferroelectr Freq Control 2009; 56: 748–758
6. Montagnon E, Hadj-Henni A, Schmitt C et al. Rheological assessment of a polymeric spherical structure using a three-dimensional shear wave scattering model in dynamic spectroscopy elastography. IEEE Trans Ultrason Ferroelectr Freq Control 2014; 61: 277–287
7. Grenier D, Milot L, Peng X et al. A magnetic resonance elastography (MRE) approach for liver investigation. Conf Proc IEEE Eng Med Biol Soc 2007; 2007: 2607–2610
8. Urban MW, Qiang B, Song P et al. Investigation of the effects of myocardial anisotropy for shear wave elastography using impulsive force and harmonic vibration. Phys Med Biol 2016; 61: 365–382
9. Klatt D, Yasar TK, Royston TJ et al. Sample interval modulation for the simultaneous acquisition of displacement vector data in magnetic resonance elastography: theory and application. Phys Med Biol 2013; 58: 8663–8675
10. Sarvazyan AP, Rudenko OV, Swanson SD et al. Shear wave elasticity imaging: a new ultrasonic technology of medical diagnostics. Ultrasound Med Biol 1998; 24: 1419–1435
11. Song P, Zhao H, Manduca A et al. Comb-push ultrasound shear elastography (CUSE): a novel method for two-dimensional shear elasticity imaging of soft tissues. IEEE Trans Med Imaging 2012; 31:
12. Almeida TW, Sampaio DR, Bruno AC et al. Comparison between shear wave dispersion magneto motive ultrasound and transient elastography for measuring tissue-mimicking phantom viscoelasticity. IEEE Trans Ultrason Ferroelectr Freq Control 2015; 62: 2138–2145
13. Madsen EL, Sathoff HJ, Zagzebski JA. Ultrasonic shear wave properties of soft tissues and tissuelike materials. J Acoust Soc Am 1983; 74: 1346–1355
14. EFSUMB EaPSC. Minimum Training recommendations for the practice of medical ultrasound. Ultraschall In Der Medizin 2006; 27: 79–105
15. Fabrellas N, Alemany M, Urquizu M et al. Using transient elastography to detect chronic liver diseases in a primary care nurse consultancy. Nurs Res 2013; 62: 450–454
16. Boursier J, Konate A, Guilluy M et al. Learning curve and interobserver reproducibility evaluation of liver stiffness measurement by transient elastography. Eur J Gastroenterol Hepatol 2008; 20: 693–701
17. Armstrong MJ, Corbett C, Hodson J et al. Operator training requirements and diagnostic accuracy of Fibroscan in routine clinical practice. Postgrad Med J 2013; 89: 685–692
18. Tatar IG, Kurt A, Yilmaz KB et al. The learning curve of real time elastosonography: a preliminary study conducted for the assessment of malignancy risk in thyroid nodules. Med Ultrason 2013; 15: 278–284
19. Boursier J, Isselin G, Fouchard-Hubert I et al. Acoustic radiation force impulse: a new ultrasonographic technology for the widespread noninvasive diagnosis of liver fibrosis. Eur J Gastroenterol Hepatol 2010; 22: 1074–1084
20. Gradinaru-Tascau O, Sporea I, Bota S et al. Does experience play a role in the ability to perform liver stiffness measurements by means of supersonic shear imaging (SSI)? Med Ultrason 2013; 15: 180–183
21. Castera L, Foucher J, Bernard PH et al. Pitfalls of liver stiffness measurement: a 5-year prospective study of 13369 examinations. Hepatology 2010; 51: 828–835
22. Pang JX, Pradhan F, Zimmer S et al. The feasibility and reliability of transient elastography using Fibroscan®: a practice audit of 2335 examinations. Can J Gastroenterol Hepatol 2014; 28: 143–149
23. Ferraioli G, Tinelli C, Zicchetti M et al. Reproducibility of real-time shear wave elastography in the evaluation of liver elasticity. Eur J Radiol 2012; 81: 3102–3106
24. Sporea I, Sirli RL, Deleanu A et al. Acoustic radiation force impulse elastography as compared to transient elastography and liver biopsy in patients with chronic hepatopathies. Ultraschall in Med 2011; 32: S46– S52
25. Barr RG, Ferraioli G, Palmeri ML et al. Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement. Radiology 2015; 276: 845–861
26. Wang CZ, Zheng J, Huang ZP et al. Influence of measurement depth on the stiffness assessment of healthy liver with real-time shear wave elastography. Ultrasound Med Biol 2014; 40: 461–469
27. Procopet B, Berzigotti A, Abraldes JG et al. Real-time shear-wave elastography: applicability, reliability and accuracy for clinically significant portal hypertension. J Hepatol 2015; 62: 1068–1075
28. Horster S, Mandel P, Zachoval R et al. Comparing acoustic radiation force impulse imaging to transient elastography to assess liver stiffness in healthy volunteers with and without valsalva manoeuvre. Clin Hemorheol Microcirc 2010; 46: 159–168
29. Karlas T, Pfrepper C, Wiegand J et al. Acoustic radiation force impulse imaging (ARFI) for non-invasive detection of liver fibrosis: examination standards and evaluation of interlobe differences in healthy subjects and chronic liver disease. Scand J Gastroenterol 2011; 46: 1458–1467
30. Samir AE, Dhyani M, Vij A et al. Shear-wave elastography for the estimation of liver fibrosis in chronic liver disease: determining accuracy and ideal site for measurement. Radiology 2015; 274: 888–896
31. Woo H, Lee JY, Yoon JH et al. Comparison of the Reliability of Acoustic Radiation Force Impulse Imaging and Supersonic Shear Imaging in Measurement of Liver Stiffness. Radiology 2015; 277: 881–886
32. Ferraioli G, Filice C, Castera L et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 3: liver. Ultrasound Med Biol 2015; 41: 1161–1179
33. Liao LY, Kuo KL, Chiang HS et al. Acoustic radiation force impulse elastography of the liver in healthy patients: test location, reference range and influence of gender and body mass index. Ultrasound Med Biol 2015; 41: 698–704
34. Goertz RS, Egger C, Neurath MF et al. Impact of food intake, ultrasound transducer, breathing maneuvers and body position on acoustic radiation force impulse (ARFI) elastometry of the liver. Ultraschall in Med 2012; 33: 380–385
35. Goertz RS, Zopf Y, Jugl V et al. Measurement of liver elasticity with acoustic radiation force impulse (ARFI) technology: an alternative noninvasive method for staging liver fibrosis in viral hepatitis. Ultraschall in Med 2010; 31: 151–155
36. Mederacke I, Wursthorn K, Kirschner J et al. Food intake increases liver stiffness in patients with chronic or resolved hepatitis C virus infection. Liver Int 2009; 29: 1500–1506
37. Arena U, Lupsor Platon M, Stasi C et al. Liver stiffness is influenced by a standardized meal in patients with chronic hepatitis C virus at different stages of fibrotic evolution. Hepatology 2013; 58: 65–72
38. Berzigotti A, De Gottardi A, Vukotic R et al. Effect of meal ingestion on liver stiffness in patients with cirrhosis and portal hypertension. PLoS One 2013; 8: e58742
39. Lemoine M, Shimakawa Y, Njie R et al. Food intake increases liver stiffness measurements and hampers reliable values in patients with chronic hepatitis B and healthy controls: the PROLIFICA experience in The Gambia. Aliment Pharmacol Ther 2014; 39: 188–196
40. Gersak MM, Sorantin E,Windhaber J et al. The influence of acute physical effort on liver stiffness estimation using Virtual Touch Quantification (VTQ). Preliminary results. Med Ultrason 2016; 18: 151–156
41. Coco B, Oliveri F, Maina AM et al. Transient elastography: a new surrogate marker of liver fibrosis influenced by major changes of transaminases. J Viral Hepat 2007; 14: 360–369
42. Sagir A, Erhardt A, Schmitt M et al. Transient elastography is unreliable for detection of cirrhosis in patients with acute liver damage. Hepatology 2008; 47: 592–595
43. Arena U, Vizzutti F, Corti G et al. Acute viral hepatitis increases liver stiffness values measured by transient elastography. Hepatology 2008; 47: 380–384
44. Vigano M, Massironi S, Lampertico P et al. Transient elastography assessment of the liver stiffness dynamics during acute hepatitis B. Eur J Gastroenterol Hepatol 2010; 22: 180–184
45. Millonig G, Reimann FM, Friedrich S et al. Extrahepatic cholestasis increases liver stiffness (FibroScan) irrespective of fibrosis. Hepatology 2008; 48: 1718–1723
46. Millonig G, Friedrich S, Adolf S et al. Liver stiffness is directly influenced by central venous pressure. J Hepatol 2010; 52: 206–210
47. Colli A, Pozzoni P, Berzuini A et al. Decompensated chronic heart failure: increased liver stiffness measured by means of transient elastography. Radiology 2010; 257: 872–878
48. Karlas TF, Pfrepper C, Rosendahl J et al. Acoustic radiation force impulse (ARFI) elastography in acute liver failure: necrosis mimics cirrhosis. Z Gastroenterol 2011; 49: 443–448
49. Mueller S, Millonig G, Sarovska L et al. Increased liver stiffness in alcoholic liver disease: differentiating fibrosis from steatohepatitis. World J Gastroenterol 2010; 16: 966–972
50. Trabut JB, Thepot V, Nalpas B et al. Rapid decline of liver stiffness following alcohol withdrawal in heavy drinkers. Alcohol Clin Exp Res 2012; 36: 1407–1411
51. Bardou-Jacquet E, Legros L, Soro D et al. Effect of alcohol consumption on liver stiffness measured by transient elastography. World J Gastroenterol 2013; 19: 516–522
52. Petta S, Maida M, Macaluso FS et al. The severity of steatosis influences liver stiffness measurement in patients with nonalcoholic fatty liver disease.Hepatology 2015; 62: 1101–1110
53. Macaluso FS, Maida M, Camma C et al. Steatosis affects the performance of liver stiffness measurement for fibrosis assessment in patients with genotype 1 chronic hepatitis C. J Hepatol 2014; 61: 523–529
54. Yoneda M, Yoneda M, Mawatari H et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with nonalcoholic fatty liver disease (NAFLD). Dig Liver Dis 2008; 40: 371–378
55. Wong VW, Vergniol J, Wong GL et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology 2010; 51: 454–462
56. Thiele M, Detlefsen S, Sevelsted Moller L et al. Transient and 2-Dimensional Shear-Wave Elastography Provide Comparable Assessment of Alcoholic Liver Fibrosis and Cirrhosis. Gastroenterology 2016; 150: 123–133
57. Cassinotto C, Boursier J, De Ledinghen V et al. Liver stiffness in nonalcoholic fatty liver disease: A comparison of Supersonic Shear Imaging, FibroScan and ARFI with liver biopsy. Hepatology 2016; 63: 1817–1827
58. Zeng J, Liu GJ, Huang ZP et al. Diagnostic accuracy of two-dimensional shear wave elastography for the non-invasive staging of hepatic fibrosis in chronic hepatitis B: a cohort study with internal validation. Eur Radiol 2014; 24: 2572–2581
59. Cassinotto C, Lapuyade B, Mouries A et al. Noninvasive assessment of liver fibrosis with impulse elastography: comparison of Supersonic Shear Imaging with ARFI and Fibroscan. J Hepatol 2014; 61: 550–557
60. Colombo S, Belloli L, Zaccanelli M et al. Normal liver stiffness and its determinantsin healthy blood donors. Dig Liver Dis 2011; 43: 231–236
61. Roulot D, Costes JL, Buyck JF et al. Transient elastography as a screening tool for liver fibrosis and cirrhosis in a community-based population aged over 45 years. Gut 2011; 60: 977–984
62. Corpechot C, El Naggar A, Poupon R. Gender and liver: is the liver stiffness weaker in weaker sex? Hepatology 2006; 44: 513 –514
63. Sirli R, Sporea I, Tudora A et al. Transient elastographic evaluation of subjects without known hepatic pathology: does age change the liver stiffness? J Gastrointestin Liver Dis 2009; 18: 57–60
64. Popescu A, Bota S, Sporea I et al. The influence of food intake on liver stiffness values assessed by acoustic radiation force impulse elastography- preliminary results. Ultrasound Med Biol 2013; 39: 579–584
65. Son CY, Kim SU, Han WK et al. Normal liver elasticity values using acoustic radiation force impulse imaging: a prospective study in healthy living liver and kidney donors. J Gastroenterol Hepatol 2012; 27: 130 – 136
66. Guzmán-Aroca F, Reus M, Berná-Serna JD et al. Reproducibility of shear wave velocity measurements by acoustic radiation force impulse imaging of the liver: a study in healthy volunteers. J Ultrasound Med 2011; 30: 975–979
67. Toshima T, Shirabe K, Takeishi K et al. New method for assessing liver fibrosis based on acoustic radiation force impulse: a special reference to the difference between right and left liver. J Gastroenterol 2011; 46: 705–711
68. Matos H, Trindade A, Noruegas MJ. Acoustic radiation force impulse imaging in paediatric patients: normal liver values. J Pediatr Gastroenterol Nutr 2014; 59: 684–688
69. Hanquinet S, Courvoisier D, Kanavaki A et al. Acoustic radiation force impulse imaging-normal values of liver stiffness in healthy children. Pediatr Radiol 2013; 43: 539–544
70. Ferraioli G, Tinelli C, Lissandrin R et al. Point shear wave elastography method for assessing liver stiffness. World J Gastroenterol 2014; 20: 4787–4796
71. Sporea I, Bota S, Grădinaru-Taşcău O et al. Comparative study between two point Shear Wave Elastographic techniques: Acoustic Radiation Force Impulse (ARFI) elastography and ElastPQ. Med Ultrason 2014; 16: 309–314
72. Ling W, Lu Q, Quan J et al. Assessment of impact factors on shear wave based liver stiffness measurement. Eur J Radiol 2013; 82: 335–341
73. Suh CH, Kim SY, Kim KW et al. Determination of normal hepatic elasticity by using real-time shear-wave elastography. Radiology 2014; 271: 895–900
74. Huang Z, Zheng J, Zeng J et al. Normal liver stiffness in healthy adults assessed by real-time shear wave elastography and factors that influence this method. Ultrasound Med Biol 2014; 40: 2549–2555
75. Dong Y, Sirli R, Ferraioli G et al. Shear Wave Elastography of the liver, review on normal values. Z Gastroenterol 2017; 55: 153–166
76. European Association for Study of L, Asociacion Latinoamericana para el Estudio del H. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63: 237–264
77. Engelmann G, Gebhardt C, Wenning D et al. Feasibility study and control values of transient elastography in healthy children. Eur J Pediatr 2012; 171: 353–360
78. Kettaneh A, Marcellin P, Douvin C et al. Features associated with success rate and performance of FibroScan measurements for the diagnosis of cirrhosis in ВГС patients: a prospective study of 935 patients. J Hepatol 2007; 46: 628–634
79. Lucidarme D, Foucher J, Le Bail B et al. Factors of accuracy of transient elastography (fibroscan) for the diagnosis of liver fibrosis in chronic hepatitis C. Hepatology 2009; 49: 1083–1089
80. Myers RP, Crotty P, Pomier-Layrargues G et al. Prevalence, risk factors and causes of discordance in fibrosis staging by transient elastography and liver biopsy. Liver Int 2010; 30: 1471–1480
81. Boursier J, Zarski JP, de Ledinghen V et al. Determination of reliability criteria for liver stiffness evaluation by transient elastography. Hepatology 2013; 57: 1182–1191
82. de Ledinghen V,Wong VW, Vergniol J et al. Diagnosis of liver fibrosis and cirrhosis using liver stiffness measurement: comparison between M and XL probe of FibroScan(R). J Hepatol 2012; 56: 833–839
83. de Ledinghen V, Vergniol J, Foucher J et al. Feasibility of liver transient elastography with FibroScan using a new probe for obese patients. Liver Int 2010; 30: 1043–1048
84. Durango E, Dietrich C, Seitz HK et al. Direct comparison of the FibroScan XL and M probes for assessment of liver fibrosis in obese and nonobese patients. Hepat Med 2013; 5: 43–52
85. Wong VW, Vergniol J, Wong GL et al. Liver stiffness measurement using XL probe in patients with nonalcoholic fatty liver disease. Am J Gastroenterol 2012; 107: 1862–1871
86. Kemp W, Roberts S. Feasibility and performance of the FibroScan XL probe. Hepatology 2012; 55: 1308–1309 author reply 1309–1310
87. Myers RP, Pomier-Layrargues G, Kirsch R et al. Discordance in fibrosis staging between liver biopsy and transient elastography using the FibroScan XL probe. J Hepatol 2012; 56: 564–570
88. Myers RP, Pomier-Layrargues G, Kirsch R et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology 2012; 55: 199–208
89. Sirli R, Sporea I, Deleanu A et al. Comparison between the M and XL probes for liver fibrosis assessment by transient elastography. Med Ultrason 2014; 16: 119–122
90. Wong GL, Vergniol J, Lo P et al. Non-invasive assessment of liver fibrosis with transient elastography (FibroScan(R)): applying the cut-offs of M probe to XL probe. Ann Hepatol 2013; 12: 570–580
91. Yoneda M, Thomas E, Sclair SN et al. Supersonic shear imaging and transient elastography with the XL probe accurately detect fibrosis in overweight or obese patients with chronic liver disease. Clin Gastroenterol Hepatol 2015; 13: 1502–1509 e1505
92. Carrion JA, Puigvehi M, Coll S et al. Applicability and accuracy improvement of transient elastography using the M and XL probes by experienced operators. J Viral Hepat 2015; 22: 297–306
93. Eddowes P, Sasso M, Fournier C et al. Steatosis and liver stiffness measurements using transient elastography. Hepatology 2016; 64: 700
94. Fraquelli M, Rigamonti C, Casazza G et al. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut 2007; 56: 968–973
95. Boursier J, Konate A, Gorea G et al. Reproducibility of liver stiffness measurement by ultrasonographic elastometry. Clin Gastroenterol Hepatol 2008; 6: 1263–1269
96. Afdhal NH, Bacon BR, Patel K et al. Accuracy of fibroscan, compared with histology, in analysis of liver fibrosis in patients with hepatitis B or C: a United States multicenter study. Clin Gastroenterol Hepatol 2015; 13: 772–779 e771-e773
97. Bota S, Sporea I, Sirli R et al. Factors associated with the impossibility to obtain reliable liver stiffness measurements by means of Acoustic Radiation Force Impulse (ARFI) elastography–analysis of a cohort of 1031 subjects. Eur J Radiol 2014; 83: 268–272
98. Goertz RS, Amann K, Heide R et al. An abdominal and thyroid status with Acoustic Radiation Force Impulse Elastometry–a feasibility study: Acoustic Radiation Force Impulse Elastometry of human organs. Eur J Radiol 2011; 80: e226–e230
99. Rizzo L, Calvaruso V, Cacopardo B et al. Comparison of transient elastography and acoustic radiation force impulse for non-invasive staging of liver fibrosis in patients with chronic hepatitis C. Am J Gastroenterol 2011; 106: 2112–2120
100. Takahashi H, Ono N, Eguchi Y et al. Evaluation of acoustic radiation force impulse elastography for fibrosis staging of chronic liver disease: a pilot study. Liver Int 2010; 30: 538–545
101. Piscaglia F, Salvatore V, Di Donato R et al. Accuracy of VirtualTouch Acoustic Radiation Force Impulse (ARFI) imaging for the diagnosis of cirrhosis during liver ultrasonography. Ultraschall in Med 2011; 32: 167–175
102. Goertz RS, Sturm J, Pfeifer L et al. S. ARFI cut-off values and significance of standard deviation for liver fibrosis staging in patients with chronic liver disease. Ann Hepato 2013; 12: 935–941
103. D’Onofrio M, Gallotti A, Mucelli RP. Tissue quantification with acoustic radiation force impulse imaging: Measurement repeatability and normal values in the healthy liver. Am J Roentgenol 2010; 195: 132–136
104. Friedrich-Rust M, Wunder K, Kriener S et al. Liver fibrosis in viral hepatitis: noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography. Radiology 2009; 252: 595–604
105. Bota S, Sporea I, Sirli R et al. Intra- and interoperator reproducibility of acoustic radiation force impulse (ARFI) elastography–preliminary results. Ultrasound Med Biol 2012; 38: 1103–1108
106. Ma JJ, Ding H, Mao F et al. Assessment of liver fibrosis with elastography point quantification technique in chronic hepatitis B virus patients: a comparison with liver pathological results. J Gastroenterol Hepatol 2014; 29: 814–819
107. Bota S, Sporea I, Sirli R et al. Factors which influence the accuracy of acoustic radiation force impulse (ARFI) elastography for the diagnosis of liver fibrosis in patients with chronic hepatitis C. Ultrasound Med Biol 2013; 30: 407–412
108. Bota S, Sporea I, Sirli R et al. Factors that influence the correlation of acoustic radiation force impulse (ARFI), elastography with liver fibrosis. Med Ultrason 2011; 13: 135–140
109. Ferraioli G, Maiocchi L, Lissandrin R et al. Accuracy of the ElastPQ Technique for the Assessment of Liver Fibrosis in Patients with Chronic Hepatitis C: a “Real Life” Single Center Study. J Gastrointestin Liver Dis 2016; 25: 331–335
110. Dietrich CF, Dong Y. Shear wave elastography with a new reliability indicator. J Ultrason 2016; 16: 281–287
111. Poynard T, Munteanu M, Luckina E et al. Liver fibrosis evaluation using real-time shear wave elastography: applicability and diagnostic performance using methods without a gold standard. J Hepatol 2013; 58: 928–935
112. Cassinotto C, Charrie A, Mouries A et al. Liver and spleen elastography using supersonic shear imaging for the non-invasive diagnosis of cirrhosis severity and oesophageal varices. Dig Liver Dis 2015; 47: 695– 701
113. Cassinotto C, de Lédinghen V. Reply to: “New imaging assisted methods for liver fibrosis quantification: Is it really favorable to classical transient elastography?”. J Hepatol 2015; 63: 767
114. Thiele M, Madsen BS, Procopet B et al. Reliability criteria for liver stiffness measurements with real-time 2D shear wave elastography in different clinical scenarios of chronic liver disease. Ultraschall in Med 2016. DOI: 10.1055/s-0042-108431
115. Sporea I, Gradinaru-Tascau O, Bota S et al. How many measurements are needed for liver stiffness assessment by 2D-Shear Wave Elastography (2D-SWE) and which value should be used: the mean or median? Med Ultrason 2013; 15: 268–272
116. Sporea I, Bota S, Jurchis A et al. Acoustic radiation force impulse and supersonic shear imaging versus transient elastography for liver fibrosis assessment. Ultrasound Med Biol 2013; 39: 1933–1941
117. Yoon JH, Lee JM, Han JK et al. Shear wave elastography for liver stiffness measurement in clinical sonographic examinations: evaluation of intraobserver reproducibility, technical failure, and unreliable stiffness measurements. J Ultrasound Med 2014; 33: 437–447
118. Hudson JM, Milot L, Parry C et al. Inter- and intra-operator reliability and repeatability of shear wave elastography in the liver: a study in healthy volunteers. Ultrasound in Med & Biol 2013; 39: 950–955
119. Staugaard B, Christensen PB, Mossner B et al. Feasibility of transient elastography versus real-time two-dimensional shear wave elastography in difficult-to-scan patients. Scand J Gastroenterol 2016; 51: 1354–1359
120. Morikawa H, Fukuda K, Kobayashi S et al. Real-time tissue elastography as a tool for the noninvasive assessment of liver stiffness in patients with chronic hepatitis C. J Gastroenterol 2011; 46: 350–358
121. Friedrich-Rust M, Schwarz A, Ong M et al. Real-time tissue elastography versus FibroScan for noninvasive assessment of liver fibrosis in chronic liver disease. Ultraschall in Med 2009; 30: 478–484
122. Saftoiu A, Gheonea DI, Ciurea T. Hue histogram analysis of real-time elastography images for noninvasive assessment of liver fibrosis. Am J Roentgenol 2007; 189: W232–W233
123. Kanamoto M, Shimada M, Ikegami T et al. Real time elastography for noninvasive diagnosis of liver fibrosis. J Hepatobiliary Pancreat Surg 2009; 16: 463–467
124. Ferraioli G, Lissandrin R, Filice C. Real-time tissue elastography in the assessment of liver stiffness. Hepatology 2013; 58: 834
125. Ferraioli G, Tinelli C, Malfitano A et al. Performance of real-time strain elastography, transient elastography, and aspartate-to-platelet ratio index in the assessment of fibrosis in chronic hepatitis C. Am J Roentgenol 2012; 199: 19–25
126. Tatsumi C, Kudo M, Ueshima K et al. Noninvasive evaluation of hepatic fibrosis using serum fibrotic markers, transient elastography (FibroScan) and real-time tissue elastography. Intervirology 2008; 51 (Suppl. 1): 27–33
127. Fujimoto K, Kato M, Kudo M et al. Novel image analysis method using ultrasound elastography for noninvasive evaluation of hepatic fibrosis in patients with chronic hepatitis C. Oncology 2013; 84 (Suppl. 1): 3– 12
128. Koizumi Y, Hirooka M, Kisaka Y et al. Liver fibrosis in patients with chronic hepatitis C: noninvasive diagnosis by means of real-time tissue elastography–establishment of the method for measurement. Radiology 2011; 258: 610–617
129. Hall TJ, Milkowski A, Garra B et al. RSNA/QIBA: shear wave speed as a biomarker for liver fibrosis staging. In: Ultrasonics Symposium(IUS) I.E. International. 2013: 397–400
130. Palmeri M, Nightingale K, Fielding S et al. RSNA QIBA ultrasound shear wave speed Phase II phantom study in viscoelastic media. Proceedings of the 2015 IEEE Ultrasonics Symposium, 2015 International. 2013: 397–400
131. Chang S, Kim MJ, Kim J et al. Variability of shear wave velocity using different frequencies in acoustic radiation force impulse (ARFI) elastography: a phantom and normal liver study. Ultraschall in Med 2013; 34: 260–265
132. Potthoff A, Attia D, Pischke S et al. Influence of different frequencies and insertion depths on the diagnostic accuracy of liver elastography by acoustic radiation force impulse imaging (ARFI). Eur J Radiol 2013; 82: 1207–1212
133. Ferraioli G, Lissandrin R, Zicchetti M et al. Ultrasound point shear wave elastography assessment of liver and spleen stiffness: effect of training on repeatability of measurements. Eur Radiol 2014; 24: 1283–1289
134. Fraquelli M, Baccarin A, Casazza G et al. Liver stiffness measurement reliability and main determinants of point shear-wave elastography in patients with chronic liver disease. Aliment Pharmacol Ther 2016; 44: 356–365
135. Cui XW, Friedrich-Rust M, De Molo C et al. Liver elastography, comments on EFSUMB elastography guidelines 2013. World J Gastroenterol 2013; 19: 6329–6347
136. Boursier J, Bertrais S, Oberti F et al. Comparison of accuracy of fibrosis degree classifications by liver biopsy and non invasive tests in chronic hepatitis C. BMC Gastroenterol 2011; 30: 132
137. Perazzo H, Fernandes FF, Gomes A et al. Interobserver variability in transient elastography analysis of patients with chronic hepatitis C. Liver Int 2015; 35: 1533–1539
138. Karlas T, Dietrich A, Peter V et al. Evaluation of Transient Elastography, Acoustic Radiation Force Impulse Imaging (ARFI), and Enhanced Liver Function (ELF) Score for Detection of Fibrosis in Morbidly Obese Patients. PLoS One 2015; 10: e0141649
139. Ferraioli G, Tinelli C, Dal Bello B et al. Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study. Hepatology 2012; 56: 2125–2133
140. Bota S, Herkner H, Sporea I et al. Meta-analysis: ARFI elastography versus transient elastography for the evaluation of liver fibrosis. Liver Int 2013; 33: 1138–1147
141. Piscaglia F, Salvatore V, Mulazzani L et al. Ultrasound Shear Wave Elastography for Liver Disease. A Critical Appraisal of the Many Actors on the Stage. Ultraschall in Med 2016; 37: 1–5
142. Wilson JM, Jungner YG. Principles and practice of mass screening for disease. Bol Oficina Sanit Panam 1968; 65: 281–393
143. Koehler EM, Plompen EP, Schouten JN et al. Presence of diabetes mellitus and steatosis is associated with liver stiffness in a general population: The Rotterdam study. Hepatology 2016; 63: 138–147
144. Marshall AD, Micallef M, Erratt A et al. Liver disease knowledge and acceptability of non-invasive liver fibrosis assessment among people who inject drugs in the drug and alcohol setting: The LiveRLife Study. Int J Drug Policy 2015; 26: 984–991
145. Foucher J, Reiller B, Jullien V et al. FibroScan used in street-based outreach for drug users is useful for hepatitis C virus screening and management: a prospective study. J Viral Hepat 2009; 16: 121–131
146. Seitz K, Piscaglia F. Ultrasound: the only “one stop shop” for modern management of liver disease. Ultraschall in Med 2013; 34: 500–503
147. Friedrich-Rust M, Ong MF, Martens S et al. Performance of transient elastography for the staging of liver fibrosis: a meta-analysis. Gastroenterology 2008; 134: 960–974
148. Chang PE, Goh GB, Ngu JH et al. Clinical applications, limitations and future role of transient elastography in the management of liver disease. World J Gastrointest Pharmacol Ther 2016; 7: 91–106
149. Tsochatzis EA, Gurusamy KS, Ntaoula S et al. Elastography for the diagnosis of severity of fibrosis in chronic liver disease: a meta-analysis of diagnostic accuracy. J Hepatol 2011; 54: 650–659
150. Njei B, McCarty TR, Luk J et al. Use of Transient Elastography in Patients with HIV-ВГС Co-infection: A Systematic Review and Meta-analysis. J Gastroenterol Hepatol 2016; 31: 1684–1693
151. Barrault C, Roudot-Thoraval F, Tran Van Nhieu J et al. Non-invasive assessment of liver graft fibrosis by transient elastography after liver transplantation. Clin Res Hepatol Gastroenterol 2013; 37: 347 –352
152. European Association for Study of L. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2014; 60: 392– 420
153. Sporea I, Bota S, Peck-Radosavljevic M et al. Acoustic Radiation Force Impulse elastography for fibrosis evaluation in patients with chronic hepatitis C: an international multicenter study. Eur J Radiol 2012; 81: 4112–4118
154. Friedrich-Rust M, Lupsor M, de Knegt R et al. Point Shear Wave Elastography by Acoustic Radiation Force Impulse Quantification in Comparison to Transient Elastography for the Noninvasive Assessment of Liver Fibrosis in Chronic Hepatitis C: A Prospective International Multicenter Study. Ultraschall in Med 2015; 36: 239–247
155. Friedrich-Rust M, Nierhoff J, Lupsor M et al. Performance of Acoustic Radiation Force Impulse imaging for the staging of liver fibrosis: a pooled meta-analysis. J Viral Hepat 2012; 19: e212–e219
156. Conti F, Serra C, Vukotic R et al. Accuracy of elastography point quantification and steatosis influence on assessing liver fibrosis in patients with chronic hepatitis C. Liver Int 2017; 37: 187–195
157. Joo SK, Kim JH, Oh S et al. Prospective Comparison of Noninvasive Fibrosis Assessment to Predict Advanced Fibrosis or Cirrhosis in Asian Patients With Hepatitis C. J Clin Gastroenterol 2015; 49: 697–704
158. Bavu E, Gennisson JL, Couade M et al. Noninvasive in vivo liver fibrosis evaluation using supersonic shear imaging: a clinical study on 113 hepatitis C virus patients. Ultrasound Med Biol 2011; 37: 1361–1373
159. Tada T, Kumada T, Toyoda H et al. Utility of real-time shear wave elastography for assessing liver fibrosis in patients with chronic hepatitis C infection without cirrhosis: Comparison of liver fibrosis indices. Hepatol Res 2015; 45: 122–129
160. Vergniol J, Foucher J, Terrebonne E et al. Noninvasive tests for fibrosis and liver stiffness predict 5-year outcomes of patients with chronic hepatitis C. Gastroenterology 2011; 140: 1970–1979
161. Macias J, Camacho A, Von Wichmann MA et al. Liver stiffness measurement versus liver biopsy to predict survival and decompensations of cirrhosis among HIV/hepatitis C virus-coinfected patients. AIDS 2013; 27: 2541–2549
162. Masuzaki R, Tateishi R, Yoshida H et al. Prospective risk assessment for hepatocellular carcinoma development in patients with chronic hepatitis C by transient elastography. Hepatology 2009; 49: 1954–1961
163. Poynard T, Vergniol J, Ngo Y et al. Staging chronic hepatitis C in seven categories using fibrosis biomarker (FibroTest) and transient elastography (FibroScan(R)). J Hepatol 2014; 60: 706–714
164. Narita Y, Genda T, Tsuzura H et al. Prediction of liver stiffness hepatocellular carcinoma in chronic hepatitis C patients on interferon-based anti-viral therapy. J Gastroenterol Hepatol 2014; 29: 137–143
165. Crespo G, Lens S, Gambato M et al. Liver stiffness 1 year after transplantation predicts clinical outcomes in patients with recurrent hepatitis C. Am J Transplant 2014; 14: 375–383
166. Carrion JA, Navasa M, Bosch J et al. Transient elastography for diagnosis of advanced fibrosis and portal hypertension in patients with hepatitis C recurrence after liver transplantation. Liver Transpl 2006; 12: 1791– 1798
167. Stasi C, Piluso A, Arena U et al. Evaluation of the prognostic value of liver stiffness in patients with hepatitis C virus treated with triple or dual antiviral therapy: A prospective pilot study. World J Gastroenterol 2015; 21: 3013–3019
168. Yada N, Sakurai T, Minami T et al. Ultrasound elastography correlates treatment response by antiviral therapy in patients with chronic hepatitis C. Oncology 2014; 87 (Suppl. 1): 118–123
169. Mandorfer M, Kozbial K, Freissmuth C et al. Interferon-free regimens for chronic hepatitis C overcome the effects of portal hypertension on virological responses. Aliment Pharmacol Ther 2015; 42: 707–718
170. Deterding K, Schlevogt B, Port K et al. Letter: can persisting liver stiffness indicate increased risk of hepatocellular cell carcinoma after successful anti-ВГС therapy? – authors’ reply. Aliment Pharmacol Ther 2016; 43: 546–547
171. Hezode C, Castera L, Roudot-Thoraval F et al. Liver stiffness diminishes with antiviral response in chronic hepatitis C. Aliment Pharmacol Ther 2011; 34: 656–663
172. Lee HW, Chon YE, Kim SU et al. Predicting Liver-Related Events Using Transient Elastography in Chronic Hepatitis C Patients with Sustained Virological Response. Gut Liver 2016; 10: 429–436
173. D’Ambrosio R, Aghemo A, Fraquelli M et al. The diagnostic accuracy of Fibroscan for cirrhosis is influenced by liver morphometry in ВГС patients with a sustained virological response. J Hepatol 2013; 59: 251– 256
174. Osakabe K, Ichino N, Nishikawa T et al. Changes of shear-wave velocity by interferon-based therapy in chronic hepatitis C. World J Gastroenterol 2015; 21: 10215–10223
175. Goertz RS, Sturm J, Zopf S et al. Outcome analysis of liver stiffness by ARFI (acoustic radiation force impulse) elastometry in patients with chronic viral hepatitis B and C. Clin Radiol 2014; 69: 275–279
176. Yamada R, Hiramatsu N, Oze T et al. Significance of liver stiffness measurement by acoustic radiation force impulse (ARFI) among hepatitis C patients. J Med Virol 2014; 86: 241–247
177. Liver EAFTSOT. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol 2012; 57: 167–185
178. Chon YE, Choi EH, Song KJ et al. Performance of transient elastography for the staging of liver fibrosis in patients with chronic hepatitis B: a meta-analysis. PLoS One 2012; 7: e44930
179. Xu X, Su Y, Song R et al. Performance of transient elastography assessing fibrosis of single hepatitis B virus infection: a systematic review and meta-analysis of a diagnostic test. Hepatol Int 2015; 9: 558–566
180. Li Y, Huang YS, Wang ZZ et al. Systematic review with meta-analysis: the diagnostic accuracy of transient elastography for the staging of liver fibrosis in patients with chronic hepatitis B. Aliment Pharmacol Ther 2016; 43: 458–469
181. Seo YS, Kim MN, Kim SU et al. Risk Assessment of Hepatocellular Carcinoma Using Transient Elastography Vs. Liver Biopsy in Chronic Hepatitis B Patients Receiving Antiviral Therapy. Medicine (Baltimore) 2016; 95: e2985
182. Meng F, Zheng Y, Zhang Q et al. Noninvasive evaluation of liver fibrosis using real-time tissue elastography and transient elastography (FibroScan). J Ultrasound Med 2015; 34: 403–410
183. Liu Y, Dong CF, Yang G et al. Optimal linear combination of ARFI, transient elastography and APRI for the assessment of fibrosis in chronic hepatitis B. Liver Int 2015; 35: 816–825
184. Dong DR, Hao MN, Li C et al. Acoustic radiation force impulse elastography, FibroScan(R), Forns’ index and their combination in the assessment of liver fibrosis in patients with chronic hepatitis B, and the impact of inflammatory activity and steatosis on these diagnostic methods. Mol Med Rep 2015; 11: 4174–4182
185. Chan HL, Wong GL, Choi PC et al. Alanine aminotransferase-based algorithms of liver stiffness measurement by transient elastography (Fibroscan) for liver fibrosis in chronic hepatitis B. J Viral Hepat 2009; 16: 36–44
186. Cardoso AC, Carvalho-Filho RJ, Stern C et al. Direct comparison of diagnostic performance of transient elastography in patients with chronic hepatitis B and chronic hepatitis C. Liver Int 2012; 32: 612 –621
187. Fraquelli M, Rigamonti C, Casazza G et al. Etiology-related determinants of liver stiffness values in chronic viral hepatitis B or C. J Hepatol 2011; 54: 621–628
188. Invernizzi F, Vigano M, Grossi G et al. The prognosis and management of inactive ВГВ carriers. Liver Int 2016; 36 (Suppl. 1): 100–104
189. Castera L, Bernard PH, Le Bail B et al. Transient elastography and biomarkers for liver fibrosis assessment and follow-up of inactive hepatitis B carriers. Aliment Pharmacol Ther 2011; 33: 455–465
190. Dong CF, Xiao J, Shan LB et al. Combined acoustic radiation force impulse, aminotransferase to platelet ratio index and Forns index assessment for hepatic fibrosis grading in hepatitis B. World J Hepatol 2016; 8: 616–624
191. Nierhoff J, Chavez Ortiz AA, Herrmann E et al. The efficiency of acoustic radiation force impulse imaging for the staging of liver fibrosis: a meta-analysis. Eur Radiol 2013; 23: 3040–3053
192. Ding H, Ma JJ, Wang WP et al. Assessment of liver fibrosis: the relationship between point shear wave elastography and quantitative histological analysis. J Gastroenterol Hepatol 2015; 30: 553–558
193. Lu Q, Lu C, Li J et al. Stiffness values and serum biomarkers in liver fibrosis staging: study in large surgical specimens in patients with chronic Hepatitis B. Radiology 2016; 280: 290–299
194. Yegin EG, Yegin K, Karatay E et al. Quantitative assessment of liver fibrosis by digital image analysis: Relationship to Ishak staging and elasticity by shear-wave elastography. J Dig Dis 2015; 16: 217–227
195. Leung VY, Shen J, Wong VW et al. Quantitative elastography of liver fibrosis and spleen stiffness in chronic hepatitis B carriers: comparison of shear-wave elastography and transient elastography with liver biopsy correlation. Radiology 2013; 269: 910–918
196. Feng JC, Li J, Wu XW et al. Diagnostic Accuracy of SuperSonic Shear Imaging for Staging of Liver Fibrosis: A Meta-analysis. J Ultrasound Med 2016; 35: 329–339
197. Li C, Zhang C, Li J et al. Diagnostic Accuracy of Real-Time Shear Wave Elastography for Staging of Liver Fibrosis: A Meta-Analysis. Med Sci Monit 2016; 22: 1349–1359
198. Kim MN, Kim SU, Kim BK et al. Long-term changes of liver stiffness values assessed using transient elastography in patients with chronic hepatitis B receiving entecavir. Liver Int 2014; 34: 1216–1223
199. Yo IK, Kwon OS, Park JW et al. The factors associated with longitudinal changes in liver stiffness in patients with chronic hepatitis B. Clin Mol Hepatol 2015; 21: 32–40
200. Park MS, KimSU, Kim BK et al. Prognostic value of the combined use of transient elastography and fibrotest in patients with chronic hepatitis B. Liver Int 2015; 35: 455–462
201. Kim MN, Kim SU, Park JY et al. Risk assessment of liver-related events using transient elastography in patients with chronic hepatitis B receiving entecavir. J Clin Gastroenterol 2014; 48: 272–278
202. Shin SH, Kim SU, Park JY et al. Liver stiffness-based model for prediction of hepatocellular carcinoma in chronic hepatitis B virus infection: comparison with histological fibrosis. Liver Int 2015; 35: 1054–1062
203. Wong GL, Chan HL, Wong CK et al. Liver stiffness-based optimization of hepatocellular carcinoma risk score in patients with chronic hepatitis B. J Hepatol 2014; 60: 339–345
204. Lee HW, Yoo EJ, KimBK et al. Prediction of development of liver-related events by transient elastography in hepatitis B patients with complete virological response on antiviral therapy. Am J Gastroenterol 2014; 109: 1241–1249
205. Kim MN, Kim SU, Kim BK et al. Increased risk of hepatocellular carcinoma in chronic hepatitis B patients with transient elastography-defined subclinical cirrhosis. Hepatology 2015; 61: 1851–1859
206. Petta S, Vanni E, Bugianesi E et al. The combination of liver stiffness measurement and NAFLD fibrosis score improves the noninvasive diagnostic accuracy for severe liver fibrosis in patients with nonalcoholic fatty liver disease. Liver Int 2015; 35: 1566–1573
207. Naveau S, Lamouri K, Pourcher G et al. The diagnostic accuracy of transient elastography for the diagnosis of liver fibrosis in bariatric surgery candidates with suspected NAFLD. Obes Surg 2014; 24: 1693–1701
208. Tapper EB, Challies T, Nasser I et al. The Performance of Vibration Controlled Transient Elastography in a US Cohort of Patients With Nonalcoholic Fatty Liver Disease. Am J Gastroenterol 2016; 111: 677 – 684
209. Kumar R, Rastogi A, Sharma MK et al. Liver stiffness measurements in patients with different stages of nonalcoholic fatty liver disease: diagnostic performance and clinicopathological correlation. Dig Dis Sci 2013; 58: 265–274
210. Kwok R, Tse YK, Wong GL et al. Systematic review with meta-analysis: non-invasive assessment of non-alcoholic fatty liver disease–the role of transient elastography and plasma cytokeratin-18 fragments. Aliment Pharmacol Ther 2014; 39: 254–269
211. Liu H, Fu J, Hong R et al. Acoustic Radiation Force Impulse Elastography for the Non-Invasive Evaluation of Hepatic Fibrosis in Non-Alcoholic Fatty Liver Disease Patients: A Systematic Review & Meta-Analysis. PLoS One 2015; 10: e0127782
212. Zheng J, Guo H, Zeng J et al. Two-dimensional shear-wave elastography and conventional US: the optimal evaluation of liver fibrosis and cirrhosis. Radiology 2015; 275: 290–300
213. Boursier J, Vergniol J, Guillet A et al. Diagnostic accuracy and prognostic significance of blood fibrosis tests and liver stiffness measurement by Fibroscan in non-alcoholic fatty liver disease. J Hepatol 2016; 65: 570–578
214. Pavlov CS, Casazza G, Nikolova D et al. Transient elastography for diagnosis of stages of hepatic fibrosis and cirrhosis in people with alcoholic liver disease. Cochrane Database Syst Rev 2015; 1: CD010542
215. Nahon P, Kettaneh A, Tengher-Barna I et al. Assessment of liver fibrosis using transient elastography in patients with alcoholic liver disease. J Hepatol 2008; 49: 1062–1068
216. Nguyen-Khac E, Chatelain D, Tramier B et al. Assessment of asymptomatic liver fibrosis in alcoholic patients using fibroscan: prospective comparison with seven non-invasive laboratory tests. Aliment Pharmacol Ther 2008; 28: 1188–1198
217. Kim SG, Kim YS, Jung SW et al. The usefulness of transient elastography to diagnose cirrhosis in patients with alcoholic liver disease. Korean J Hepatol 2009; 15: 42–51
218. Janssens F, de Suray N, Piessevaux H et al. Can transient elastography replace liver histology for determination of advanced fibrosis in alcoholic patients: a real-life study. J Clin Gastroenterol 2010; 44: 575–582
219. Fernandez M, Trepo E, Degre D et al. Transient Elastography using Fibroscan is the most reliable noninvasive method for the diagnosis of advanced fibrosis and cirrhosis in alcoholic liver disease. Eur J Gastroenterol Hepatol 2015; 27: 1074–1079
220. Mueller S, Englert S, Seitz HK et al. Inflammation-adapted liver stiffness values for improved fibrosis staging in patients with hepatitis C virus and alcoholic liver disease. Liver International 2015; 35: 2514– 2521
221. Cho EJ, Kim MY, Lee JH et al. Diagnostic and Prognostic Values of Noninvasive Predictors of Portal Hypertension in Patients with Alcoholic Cirrhosis. PLoS One 2015; 10: e0133935
222. Sporea I, Ratiu I, Bota S et al. Are different cut-off values of liver stiffness assessed by transient elastography according to the etiology of liver cirrhosis for predicting significant esophageal varices? Med Ultrason 2013; 15: 111–115
223. Gelsi E, Dainese R, Truchi R et al. Effect of detoxification on liver stiffness assessed by Fibroscan(R) in alcoholic patients. Alcohol Clin Exp Res 2011; 35: 566–570
224. Harman DJ, Ryder SD, James MW et al. Direct targeting of risk factors significantly increases the detection of liver cirrhosis in primary care: a cross-sectional diagnostic study utilising transient elastography. BMJ Open 2015; 5: e007516
225. Bellentani S, Saccoccio G, Costa G et al. Drinking habits as cofactors of risk for alcohol induced liver damage. Gut 1997; 41: 845–850
226. Kiani A, Brun V, Laine F et al. Acoustic radiation force impulse imaging for assessing liver fibrosis in alcoholic liver disease. World J Gastroenterol 2016; 22: 4926–4935
227. Zhang D, Li P, Chen M et al. Non-invasive assessment of liver fibrosis in patients with alcoholic liver disease using acoustic radiation force impulse elastography. Abdom Imaging 2015; 40: 723–729
228. Liu F, Wei L, Tang X et al. Clinical value of virtual touch tissue quantification and PGA index in evaluation of alcoholic liver fibrosis. Zhong Nan Da Xue Xue Bao Yi Xue Ban 2015; 40: 1246–1252
229. Corpechot C, Carrat F, Poujol-Robert A et al. Noninvasive elastographybased assessment of liver fibrosis progression and prognosis in primary biliary cirrhosis. Hepatology 2012; 56: 198–208
230. Corpechot C, El Naggar A, Poujol-Robert A et al. Assessment of biliary fibrosis by transient elastography in patients with PBC and PSC. Hepatology 2006; 43: 1118–1124
231. Wang QX, Shen L, Qiu DK et al. Validation of transient elastography (Fibroscan) in assessment of hepatic fibrosis in autoimmune hepatitis. Zhonghua Gan Zang Bing Za Zhi 2011; 19: 782–784
232. Corpechot C, Gaouar F, El Naggar A et al. Baseline values and changes in liver stiffness measured by transient elastography are associated with severity of fibrosis and outcomes of patients with primary sclerosing cholangitis. Gastroenterology 2014; 146: 970–979 quiz e915- e976
233. Colecchia A, Di Biase AR, Scaioli E et al. Non-invasive methods can predict oesophageal varices in patients with biliary atresia after a Kasai procedure. Dig Liver Dis 2011; 43: 659–663
234. Righi S, Fiorini E, De Molo C et al. ARFI elastography in patients with chronic autoimmune liver diseases: A preliminary study. J Ultrasound 2012; 15: 226–231
235. Efe C, Gungoren MS, Ozaslan E et al. Acoustic Radiation Force Impulse (ARFI) for Fibrosis Staging in Patients with Autoimmune Hepatitis. Hepatogastroenterology 2015; 62: 670–672
236. Zhang DK, Chen M, Liu Y et al. Acoustic radiation force impulse elastography for non-invasive assessment of disease stage in patients with primary biliary cirrhosis: A preliminary study. Clin Radiol 2014; 69: 836–840
237. Wang X, Qian L, Jia L et al. Utility of Shear Wave Elastography for Differentiating Biliary Atresia From Infantile Hepatitis Syndrome. J Ultrasound Med 2016; 35: 1475–1479
238. Shi KQ, Fan YC, Pan ZZ et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int 2013; 33: 62–71
239. Robic MA, Procopet B, Metivier S et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol 2011; 55: 1017– 1024
240. Berzigotti A, Seijo S, Arena U et al. Elastography, spleen size, and platelet count identify portal hypertension in patients with compensated cirrhosis. Gastroenterology 2013; 144: 102–111
241. Takuma Y, Nouso K, Morimoto Y et al. Measurement of spleen stiffness by acoustic radiation force impulse imaging identifies cirrhotic patients with esophageal varices. Gastroenterology 2013; 144: 92– 101 e102
242. Augustin S, Millan L, Gonzalez A et al. Detection of early portal hypertension with routine data and liver stiffness in patients with asymptomatic liver disease: a prospective study. J Hepatol 2014; 60: 561–569
243. Ding NS, Nguyen T, Iser DM et al. Liver stiffness plus platelet count can be used to exclude high-risk oesophageal varices. Liver Int 2016; 36: 240–245
244. de Franchis R, Baveno VIF. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63: 743 –752
245. Attia D, Schoenemeier B, Rodt T et al. Evaluation of Liver and Spleen Stiffness with Acoustic Radiation Force Impulse Quantification Elastography for Diagnosing Clinically Significant Portal Hypertension. Ultraschall in Med 2015; 36: 603–610
246. Salzl P, Reiberger T, Ferlitsch M et al. Evaluation of portal hypertension and varices by acoustic radiation force impulse imaging of the liver compared to transient elastography and AST to platelet ratio index. Ultraschall in Med 2014; 35: 528–533
247. Takuma Y, Nouso K, Morimoto Y et al. Portal Hypertension in Patients with Liver Cirrhosis: Diagnostic Accuracy of Spleen Stiffness. Radiology 2016; 279: 609–619
248. Elkrief L, Rautou PE, Ronot M et al. Prospective Comparison of Spleen and Liver Stiffness by Using Shear-Wave and Transient Elastography for Detection of Portal Hypertension in Cirrhosis. Radiology 2015; 275: 589–598
249. Kim TY, Jeong WK, Sohn JH et al. Evaluation of portal hypertension by real-time shear wave elastography in cirrhotic patients. Liver Int 2015; 35: 2416–2424
250. Jansen C, Bogs C, Verlinden W et al. Algorithm to rule out clinically significant portal hypertension combining Shear-wave elastography of liver and spleen: a prospective multicentre study. Gut 2016; 65: 1057–1058. DOI: 10.1136/gutjnl-2016-311536
251. Choi SY, Jeong WK, Kim Y et al. Shear-Wave Elastography: A Noninvasive Tool for Monitoring Changing Hepatic Venous Pressure Gradients in Patients with Cirrhosis. Radiology 2014; 273: 917–926
252. Sebastiani G, Ghali P, Wong P et al. Physicians’ practices for diagnosing liver fibrosis in chronic liver diseases: a nationwide, Canadian survey. Can J Gastroenterol Hepatol 2014; 28: 23–30
253. Crossan C, Tsochatzis EA, Longworth L et al. Cost-effectiveness of noninvasive methods for assessment and monitoring of liver fibrosis and cirrhosis in patients with chronic liver disease: systematic review and economic evaluation. Health Technol Assess 2015; 19: 1–409 v-vi
254. Canavan C, Eisenburg J, Meng L et al. Ultrasound elastography for fibrosis surveillance is cost effective in patients with chronic hepatitis C virus in the UK. Dig Dis Sci 2013; 58: 2691–2704
255. Thavorn K, Coyle D. Transient Elastography and Controlled Attenuation Parameter for Diagnosing Liver Fibrosis and Steatosis in Ontario: An Economic Analysis. Ont Health Technol Assess Ser 2015; 15: 1–58
256. Stasi C, Milani S. Non-invasive assessment of liver fibrosis: Between aprediction/prevention of outcomes and cost-effectiveness. World J Gastroenterol 2016; 22: 1711–1720
257. Tapper EB, Sengupta N, Hunink MG et al. Cost-Effective Evaluation of Nonalcoholic Fatty Liver Disease With NAFLD Fibrosis Score and Vibration Controlled Transient Elastography. Am J Gastroenterol 2015; 110: 1298–1304
258. Zhang E, Wartelle-Bladou C, Lepanto L et al. Cost-utility analysis of nonalcoholic steatohepatitis screening. Eur Radiol 2015; 25: 3282– 3294.




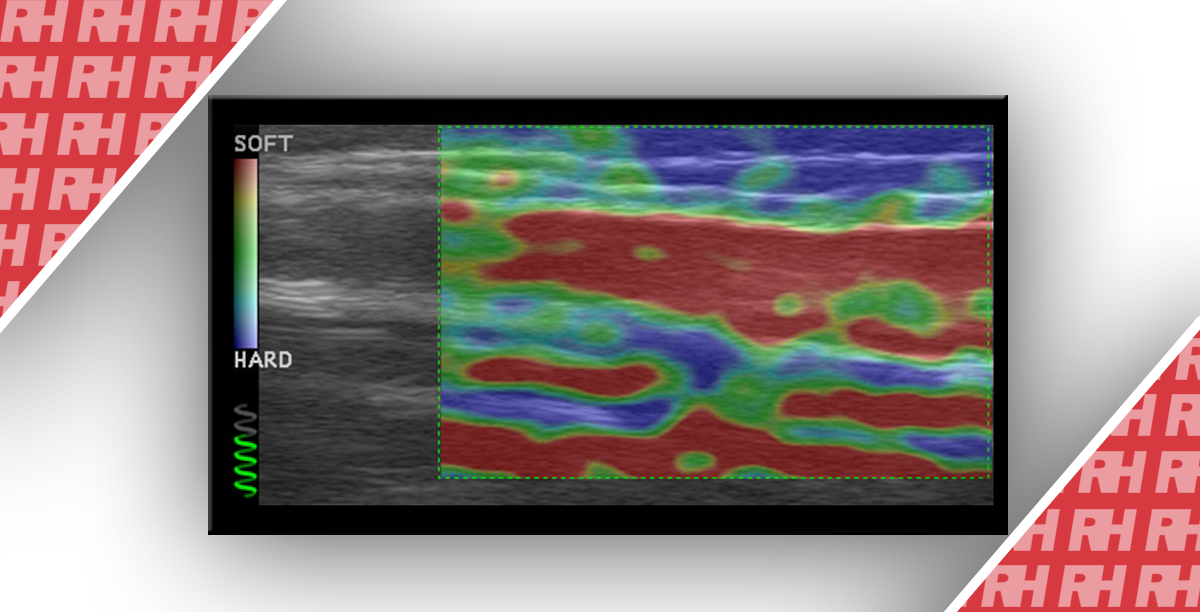
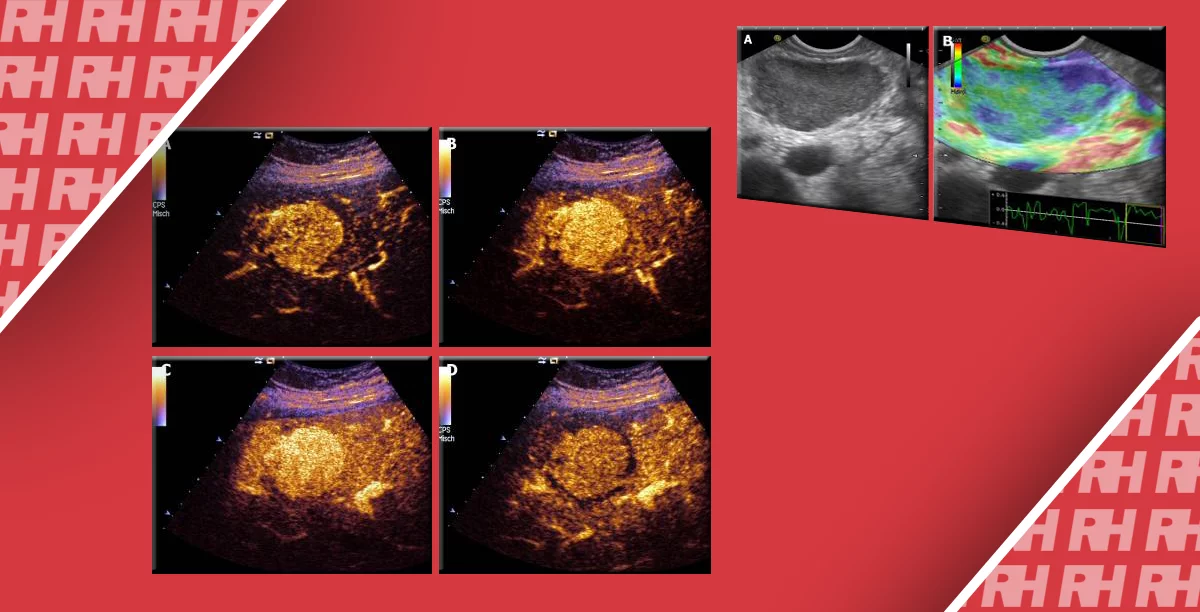
14.10.2019
Петр Порошенко