РЕЗЮМЕ
Мета
Продемонстровано ефективність гістероскопії в діагностиці уражень ендометрія, що свідчить про високу точність діагностики злоякісних уражень ендометрія. Хоча повідомлялося про характерні ознаки атипового та злоякісного ендометрію, вони не є чіткими та іноді складними. Метою цього дослідження було визначити невелику кількість характерних ознак для виявлення аномалій ендометрія за допомогою простої системи суджень і проаналізувати діагностичні характеристики та їхню точність у діагностиці злоякісних утворень ендометрія.
Методи
Ми провели ретроспективний аналіз відеоматеріалів гістероскопії 250 пацієнток, з яких на основі патогістологічного дослідження відібрали для аналізу 152 випадки з доброякісними змінами, 16 – з атиповим ендометрієм і 18 – з карциномою in situ або раком ендометрія. Оцінювалися такі характеристики ендометрію, як протрузія, десквамація, розширені судини, атипові судини та ураження білого/жовтого кольору.
Результати
Багатофакторний аналіз показав, що десквамація (p = 0,001, відношення шансів [ВШ] 5,28), атипові судини (p < 0,001, ВШ 8,50) та білі/жовті ураження (p = 0,011, ВШ 1,37) є значущими предикторами злоякісності ендометрію. Залежно від статусу внеску, бали 4, 6 і 1 були встановлені відповідно до пропорцій відношення шансів. Коли для визначення злоякісності ендометрія використовувалися бали ≥5 (принаймні, як десквамація, так і білі/жовті ураження або тільки атипові судини), чутливість і специфічність становили 100% і 92%, відповідно. При виявленні раку, атипових і доброякісних випадків чутливість і специфічність становили 88% і 90% відповідно.
Висновок
Наші характеристики гістероскопічних знахідок показали вищу прогностичну здатність у виявленні злоякісних пухлин ендометрія. Однак для точного діагностування злоякісних пухлин ендометрія за допомогою гістероскопії необхідне подальше обстеження більшої кількості випадків.
ВСТУП
Останнім часом захворюваність на рак ендометрія (РЕ) зросла в декількох країнах, включаючи Японію. У 2018 році в Японії було зареєстровано 17 089 випадків РЕ, і РЕ був найпоширенішою гінекологічною злоякісною пухлиною, випереджаючи рак шийки матки (n = 10 978) та яєчників (n = 13 049).1 Кілька досліджень продемонстрували перевагу гістероскопії в діагностиці злоякісних новоутворень ендометрія, в тому числі високу точність діагностики РЕ. Позитивні результати гістероскопії з високою вірогідністю вказують на наявність РЕ.2 Хоча повідомлялося про характерні ознаки атипового та злоякісного ендометрія, вони не є остаточними. Раніше повідомлялося про системи оцінювання злоякісних гістероскопічних знахідок, які базуються на багатьох характерних компонентах, таких як атипові судини, нерівномірне потовщення ендометрію, розширені залозисті отвори, розпад новоутворення ендометрію, множинні або нерівномірні структури поліпа, ріст мозкоподібних і деревоподібних структур, а також аномальний колір ендометрію. Ці прояви включають доброякісні ураження, деякі з яких є незрозумілими.3, 4 Ці системи оцінювання є детальними і відображають багато аспектів змін ендометрія, але вони дещо складні для оцінювання або звикання до процедури. Візуальний діагноз РЕ базується на грубому спотворенні порожнини ендометрія внаслідок вузлового, поліпозного, папілярного або змішаного характеру неопластичного росту. Вогнищевий некроз, мікрокальцифікати, пухка консистенція та атипові судини є іншими характеристиками РЕ, які можна легко виявити при гістероскопічному огляді.5 Ми проводили гістероскопію для виявлення аномалій ендометрія, включаючи як доброякісні, так і злоякісні утворення, зосереджуючи увагу на таких характеристиках ендометрія: протрузія, десквамація, розширені судини, атипові судини та біле/жовте забарвлення ураження. Серед цих п’яти характеристик ми прагнули виявити будь-яку одну або комбінацію характеристик, які можуть сприяти виявленню злоякісних новоутворень ендометрія та підвищенню точності діагнозу.
МЕТОДИ
Пацієнти
Ретроспективний аналіз включав пацієнток, які пройшли гістероскопію в клініці Токійського університету в період з вересня 2017 року по грудень 2018 року за їхньою згодою. Серед 250 пацієнток, яким була проведена гістероскопія, ми відібрали для аналізу на основі результатів патогістологічного дослідження 152 пацієнтки з доброякісними пухлинами, 16 – з атиповим ендометрієм і 18 – з карциномою in situ або РЕ. Це дослідження було схвалено етичним комітетом (№ 3084-(3), лікарня Токійського університету).
Гістероскопія
Гістероскопічні обстеження проводились за медичним страхуванням пацієнткам, які потребували медичної допомоги з різних причин. Всі дослідження проводилися в амбулаторних умовах без анестезії. Для діагностичної гістероскопії використовували апарат VISERA HYF тип V (OLYMPUS, Токіо, Японія) з гнучким об’єктивом 3,8 мм. Тиск перфузії фізіологічного розчину становив 225 мм рт. ст. (30 кПа), за винятком випадків, коли до або під час гістероскопії підозрювали атипові або злоякісні захворювання. У таких випадках тиск знижували до 75 мм рт.ст. (10 кПа).
Для оцінки злоякісності ми зосередилися на наступних п’яти ознаках ендометрія матки, як показано на Зображенні 1: протрузія, десквамація, розширені судини, атипові судини та білі/жовті ураження. Протрузії часто присутні у вигляді поліпів і підслизових міом; однак вони також можуть бути присутніми при атипових і злоякісних захворюваннях, таких як атипова поліпоїдна аденоміома і РЕ.6, 7 Десквамація – це коли невелика біла маса, яка вважається некротизованою тканиною, що відшаровується від ендометрію, плаває в порожнині матки і виглядає як снігова буря. Раніше повідомлялося, що це явище є характерною ознакою, яка спостерігається, наприклад, у пацієнток з аномальними матковими кровотечами і нерегулярним ендометрієм або при підозрі на злоякісне новоутворення.8, 9 Розширені судини – це судини, які простягаються до верхівки протрузії. Атипові судини – це судини, що мають звивистість, розширення, невідповідний діаметр і розриви, які часто згадуються як ознаки злоякісності ендометрія.4, 6, 10 Білі/жовті ураження вказують на вогнищевий некроз або мікрокальцифікати на поверхні ендометрія.5 Досвідчений консультант, не бачачи результатів патології, ретроспективно оцінював ці п’ять ознак як позитивні чи негативні, використовуючи відеозаписи гістероскопії. Патологічні результати ендометрію перевірялися або сліпою біопсією, або хірургічним втручанням. Рак ендометрія ідентифікували за результатами гістеректомії. Що стосується атипових випадків ендометрія, то вони були підтверджені гістеректомією або декількома біопсіями, щоб виключити недооцінку раку.
ЗОБРАЖЕННЯ 1
П’ять основних патологічних знахідок, що спостерігаються при гістероскопії. Стрілки та кружечки на панелях вказують на типові частини. (а) Протрузія; (b) десквамація; (c) розширена судина, тобто судина, розширена до верхівки будь-якої протрузії; (d) атипова судина, включаючи звивистість і розширення (ліва стрілка) та розрив (права стрілка); (e) біле/жовте ураження.
Статистичний аналіз
Тест Краскела-Уолліса та багатовимірний логістичний регресійний аналіз проводили за допомогою JMP Pro, версія 15, SAS Institute Japan. Відмінності вважалися статистично значущими при p < 0,05.
РЕЗУЛЬТАТИ
Характеристики пацієнтів
Серед 250 пацієнток, яким була проведена гістероскопія, 64 були неясними для патогістологічного дослідження і були виключені з аналізу. З 16 пацієнток у групі з атиповим ендометрієм 15 мали атипову гіперплазію ендометрію, а 1 – атипову поліпоїдну аденоміому. З 18 пацієнток зі злоякісними пухлинами у 10 була поєднана атипова гіперплазія ендометрія з карциномою in situ, а у 8 – РЕ 1 ступеня.
Аналіз показників тканини ендометрію
Результати багатовимірного аналізу, представлені в Таблиці 1, показують, що з п’яти гістероскопічних ознак десквамація (p = 0,001), атипові судини (p < 0,001) і білі/жовті ураження (p = 0,011) були незалежними предикторами злоякісності. Відношення шансів (ВШ) цих трьох факторів становило 5,28, 8,50 та 1,37 відповідно. Ми присвоїли їм бали, виходячи з їх пропорцій відношень шансів: 1 бал для білих/жовтих уражень (ВШ = 1,37), 4 бали для десквамації (з ВШ десквамації до білих/жовтих уражень: 5,28/1,37 = 3,85) і 6 балів для атипових судин (8,50/1,37 = 6,20).
ТАБЛИЦЯ 1. Багатовимірний аналіз п’яти характерних знахідок щодо злоякісності ендометрія.
| Характерні ознаки | p-Значення | Коефіцієнт регресії (95% ДІ) | Відношення шансів | Відношення правдоподібностей | Оцінка |
| Протрузія | 0.0835 | −0.67 (−1.56–0.06) | |||
| Десквамація | 0.0014 | 0.94 (0.37–1.52) | 5.28 | 10.75 | 4 |
| Розширена судина | 0.2694 | 0.44 (−0.35–1.25) | |||
| Нетипова судина | <0.0001 | 2.32 (1.59–3.21) | 8.50 | 44.68 | 6 |
| Біле/жовте ураження | 0.0110 | 0.86 (0.18–1.54) | 1.37 | 5.68 | 1 |
- Примітка: Ознаки з p < 0,05 були визначені як такі, що пов’язані зі злоякісними новоутвореннями. Розраховано внесок у діагностику злоякісних новоутворень.
- Абревіатури: ДІ, довірчий інтервал.
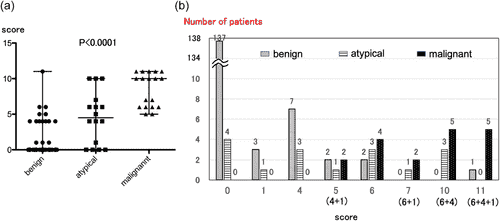
Бали 186 пацієнтів та їхні патологічні знахідки показані на Зображенні 2. Медіана балів для доброякісних, атипових і злоякісних пухлин становила 0, 4,5 і 10, відповідно, і суттєво відрізнялася між групами (p < 0,001; Зображення 2a). Кількість випадків з кожним балом у групах доброякісних, атипових та злоякісних пухлин показано на Зображенні 2b. Гістероскопія злоякісних пухлин рідко показувала оцінку 0, тоді як патологічно доброякісні випадки рідко мали високу оцінку.
ЗОБРАЖЕННЯ 2
Розподіл балів відповідно до патологічної злоякісності. (а) Бали та результати патології. Бали суттєво відрізнялися між трьома групами (непараметричний односторонній дисперсійний аналіз; p < 0,001). (b) Кількість випадків у кожному балі (від 0 до 11) у доброякісній, атиповій та злоякісній групах.
Чутливість і специфічність системи балів в диференціації злоякісних новоутворень від доброякісного та атипового ендометрія за допомогою гістероскопії та різні порогові значення представлені в Таблиці 2. При встановленні діагнозу злоякісної пухлини ендометрія, якщо оцінка становила ≥5 балів, чутливість і специфічність у виявленні злоякісної пухлини ендометрія становили 100% і 92% відповідно. Крім того, позитивна та негативна прогностична цінність становила 58% та 100% відповідно. Гістероскопічні результати досягали оцінки ≥5 балів, якщо були виявлені атипові судини або десквамація та білі/жовті ураження.
ТАБЛИЦЯ 2. Граничні значення для діагностики раку ендометрія матки за розробленою системою балів.
| Порогова оцінка гістероскопії ≥ | Злоякісний (n = 18) | Доброякісний (n = 152) + атиповий (n = 16), всього n = 168 | Чутливість (%) | Специфічність (%) |
| 1 | 18 | 27 | 100 | 84 |
| 4 | 18 | 23 | 100 | 86 |
| 5 | 18 | 13 | 100 | 92 |
| 6 | 16 | 10 | 89 | 94 |
| 7 | 12 | 5 | 67 | 97 |
| 10 | 10 | 4 | 56 | 98 |
| 11 | 5 | 1 | 28 | 99 |
- Примітка: Оцінка гістероскопії розраховувалася шляхом підсумовування оцінок десквамації (4 бали, якщо вона позитивна), атипових судин (6 балів) і білих/жовтих уражень (1 бал).
Як показано в Таблиці 3, при виявленні будь-якої з трьох характерних ознак (атипові судини, десквамація та білі/жовті ураження) атипове ураження або злоякісна пухлина виявлялися з чутливістю 88% і специфічністю 90%, з позитивною прогностичною цінністю 67% і негативною прогностичною цінністю 97%.
ТАБЛИЦЯ 3. Граничні значення для діагностики атипії та раку ендометрія матки за розробленою системою балів.
| Порогова оцінка гістероскопії ≥ | Злоякісний (n = 18) + атиповий (n = 16), всього n = 34 | Доброякісний (n = 152) | Чутливість (%) | Специфічність (%) |
| 1 | 30 | 15 | 88 | 90 |
| 4 | 29 | 12 | 85 | 92 |
| 5 | 26 | 5 | 76 | 97 |
| 6 | 23 | 3 | 68 | 98 |
| 7 | 16 | 1 | 47 | 99 |
| 10 | 13 | 1 | 38 | 99 |
| 11 | 5 | 1 | 15 | 99 |
- Примітка: Оцінка гістероскопії розраховувалася шляхом підсумовування оцінок десквамації (4 бали, якщо вона позитивна), атипових судин (6 балів) і білих/жовтих уражень (1 бал).
У багатьох дослідженнях повідомлялося про небажані явища під час офісної гістероскопії.11, 12 Однак ми не спостерігали таких небажаних явищ, як вазовагальний синдром,11 кровотеча, що потребувала додаткового лікування, або перфорація матки.12
ОБГОВОРЕННЯ ТА ВИСНОВОК
Повідомлялося, що офісна гістероскопія є корисною для діагностики РЕ та взяття зразків тканини ендометрія.13 До значних ускладнень діагностичної гістероскопії при злоякісних ураженнях відноситься ризик дисемінації. Деякі звіти, включаючи метааналіз дев’яти досліджень, показали, що підозріла або позитивна цитологія очеревини під час операції асоціюється з гістероскопією в анамнезі 14–17; однак у кількох звітах зроблено висновок, що позитивна цитологія після гістероскопії не впливає на клінічну стадію або прогноз пацієнток з РЕ I типу. У пацієнток з РЕ ІІ типу, який є більш агресивним, передопераційне обстеження повинно обмежуватися біопсією або вишкрібанням.16, 18–20
Гістероскопія може виявити злоякісні ознаки, такі як нерівні або виразкові поверхні з ділянками некрозу через недостатнє кровопостачання. Виразки, виявлені лише при злоякісному ураженні, вважаються кінцевою точкою нерівних поверхонь.21 Хоча виразка не є неминучою ознакою злоякісних пухлин ендометрія, особливо на ранніх стадіях, таких як атиповий ендометрій, десквамація може слугувати ознакою виразки на початковій стадії. Під час гістероскопії можна спостерігати кілька характеристик ендометрія. Оцінка та діагностика ускладнюються зі збільшенням кількості характеристик, що використовуються в гістероскопічній системі оцінювання, тоді як специфічність і позитивна прогностична цінність знижуються. Harika та співавт. представили систему оцінки гістероскопії з восьми компонентів для діагностики злоякісних новоутворень ендометрія. Вони повідомили про чутливість, специфічність, позитивну та негативну прогностичну цінність 100%, 67,8%, 22,2% та 100%, відповідно, для діагностики РЕ при оцінці ≥9.3, 4 Ми обрали мінімальний набір компонентів, необхідних для діагностики злоякісності ендометрія, зосередившись на тих, які безпосередньо пов’язані зі злоякісністю з високою точністю. З іншого боку, при виявленні атипового або доброякісного раку можливий випадок з принаймні однією з трьох характеристик. Однак чутливість і специфічність були менш точними, ніж при виявленні лише раку. Це вказувало на те, що наші три ознаки будуть недостатніми при виявленні атипового ендометрію.
Позитивні та негативні прогностичні значення в цьому дослідженні не розглядалися. Ми приймаємо багато пацієнток з підозрою на злоякісні новоутворення ендометрія, направлених з інших клінік, тому частота злоякісних новоутворень ендометрія серед наших пацієнток була б вищою, ніж у загальній популяції, яка проходила гістероскопічне обстеження. Крім того, були виключені зразки з нечіткими патологічними результатами. Тому наші позитивні та негативні прогностичні значення були б вищими або нижчими, ніж очікувані результати після гістероскопічних обстежень у загальних клініках.
Офісна гістероскопія вважається безпечною процедурою з незначним ризиком вазовагальної реакції. Agostini та співавт. повідомили, що ризик вазовагальної реакції становить менше 1% на основі обстеження понад 2000 пацієнток. Цей показник при використанні жорсткого гістероскопа був вищим, ніж при використанні гнучкого (p = 0,009), і при використанні CO2, ніж при використанні фізіологічного розчину (p = 0,014), незалежно від показань до гістероскопії або паритетного і менопаузального статусу пацієнтки.11 Частота ускладнень під час оперативної гістероскопії, включаючи вазовагальну реакцію, була оцінена на рівні 1,6%.22, 23
Обмеженнями цього дослідження є те, що кількість випадків злоякісних новоутворень ендометрія та атипії ендометрія була невеликою, а також те, що для виявлення злоякісних ознак все одно потрібна певна діагностична підготовка для проведення гістероскопії, хоча вони не є такими складними. Крім того, результати дослідження не можна узагальнювати, оскільки популяція не є репрезентативною, поширеність захворювань була вищою, ніж у повсякденній клінічній практиці, а відеоогляд гістероскопії проводив лише один експерт.
Нещодавно технології на основі штучного інтелекту були впроваджені в сферу медичної візуалізації. Діагностика злоякісних новоутворень ендометрія з використанням комбінації штучного інтелекту та гістероскопії є технологією наступного покоління.24, 25 Корисність технології була продемонстрована в дослідженні, яке показало, що точність, чутливість і специфічність діагностики становлять приблизно 90%.25 Точний відбір зразків підозрілих утворень є незамінним для патологічної діагностики. Незабаром біопсії підозрілих утворень, виявлених за допомогою штучного інтелекту на основі офісної гістероскопії, стануть доступними і широко використовуваними.
ПОСИЛАННЯ НА ДЖЕРЕЛА
- Cancer Statistics. Japan: cancer information service, National Cancer Center (National Cancer Registry, Ministry of Health, Labour and Welfare); 2022.
- Clark TJ, Voit D, Gupta JK, Hyde C, Song F, Khan KS. Accuracy of hysteroscopy in the diagnosis of endometrial cancer and hyperplasia: a systematic quantitative review. JAMA. 2002;288: 1610–21. https://doi.org/10.1001/jama.288.13.1610
- Ianieri MM, Staniscia T, Pontrelli G, di Spiezio Sardo A, Manzi FS, Recchi M, et al. A new hysteroscopic risk scoring system for diagnosing endometrial hyperplasia and adenocarcinoma. J Minim Invasive Gynecol. 2016;23:712–8. https://doi.org/10.1016/ j.jmig.2016.02.017
- Harika B, Subbaiah M, Maurya DK. Diagnostic accuracy of hysteroscopic scoring system in predicting endometrial malignancy and atypical endometrial hyperplasia. J Midlife Health. 2021;12: 206–10. https://doi.org/10.4103/jmh.jmh_246_20
- Vitale SG, Riemma G, Carugno J, Chiofalo B, Vilos GA, Cianci S, et al. Hysteroscopy in the management of endometrial hyperplasia and cancer in reproductive aged women: new developments and current perspectives. Transl Cancer Res. 2020;9:7767– 77. https://doi.org/10.21037/tcr-20-2092
- Javed L, Ashraf N, Sabqat M, Zareen A. Atypical polypoid adenomyoma (APAM). J Coll Physicians Surg Pak. 2021;30:719–21. https://doi.org/10.29271/jcpsp.2021.06.719
- Yamagami W, Susumu N, Ninomiya T, Nakadaira N, Iwasa N, Kuwahata M, et al. Hysteroscopic transcervical resection is useful to diagnose myometrial invasion in atypical polypoid adenomyoma coexisting with atypical endometrial hyperplasia or endometrial cancer with suspicious myometrial invasion. J Obstet Gynaecol Res. 2015;41:768–75. https://doi.org/10.1111/jog.12645
- Cicinelli E, Comi N, Scorcia P, et al. Hysteroscopy for diagnosis and treatment of endometrial adenocarcinoma precursors. A review of literature. Eur J Gynaecol Oncol. 1993;14(5):425–36.
- Valle R. Hysteroscopy, contact hysteroscopy, and microhysteroscopy. Glob Libr Women’s Med. 2009. https://doi.org/10.3843/ GLOWM.10087
- Ngo YG, Fu HC, Chu LC, Tseng CW, Chen CY, Lee CY, et al. Specific hysteroscopic findings can efficiently distinguish the differences between malignant and benign endometrial polyps. Taiwan J Obstet Gynecol. 2020;59:85–90. https://doi.org/10.1016/j.tjog.2019. 11.013
- Agostini A, Bretelle F, Ronda I, Roger V, Cravello L, Blanc B. Risk of vasovagal syndrome during outpatient hysteroscopy. J Am Assoc Gynecol Laparosc. 2004;11:245–7. https://doi.org/10.1016/ s1074-3804(05)60207-1
- Cholkeri-Singh A, Sasaki KJ. Hysteroscopy safety. Curr Opin Obstet Gynecol. 2016;28:250–4. https://doi.org/10.1097/GCO. 0000000000000289
- Sone K, Eguchi S, Asada K, Inoue F, Miyamoto Y, Tanikawa M, et al. Usefulness of biopsy by office hysteroscopy for endometrial cancer: a case report. Mol Clin Oncol. 2020;13:141–5. https://doi. org/10.3892/mco.2020.2053
- Obermair A, Geramou M, Gucer F, Denison U, Graf AH, Kapshammer E, et al. Does hysteroscopy facilitate tumor cell dissemination? Incidence of peritoneal cytology from patients with early stage endometrial carcinoma following dilatation and curettage (D & C) versus hysteroscopy and D & C. Cancer. 2000;88: 139–43. https://doi.org/10.1002/(SICI)1097-0142(20000101)88: 1<139::AID-CNCR19>3.0.CO;2-U
- Dovnik A, Crnobrnja B, Zegura B, Takac I, Pakiz M. Incidence of positive peritoneal cytology in patients with endometrial carcinoma after hysteroscopy vs. dilatation and curettage. Radiol Oncol. 2017;51:88–93. https://doi.org/10.1515/raon-2016-0035
- Chen J, Clark LH, Kong WM, Yan Z, Han C, Zhao H, et al. Does hysteroscopy worsen prognosis in women with type II endometrial carcinoma? PLoS One. 2017;12:e0174226. https://doi.org/ 10.1371/journal.pone.0174226
- Polyzos NP, Mauri D, Tsioras S, Messini CI, Valachis A, Messinis IE. Intraperitoneal dissemination of endometrial cancer cells after hysteroscopy: a systematic review and meta-analysis. Int J Gynecol Cancer. 2010;20:261–7. https://doi.org/10.1111/igc. 0b013e3181ca2290
- Soucie JE, Chu PA, Ross S, Snodgrass T, Wood SL. The risk of diagnostic hysteroscopy in women with endometrial cancer. Am J Obstet Gynecol. 2012;207:71.e1–71.e5. https://doi.org/10. 1016/j.ajog.2012.04.026
- Cicinelli E, Tinelli R, Colafiglio G, Fortunato F, Fusco A, Mastrolia S, et al. Risk of long-term pelvic recurrences after fluid minihysteroscopy in women with endometrial carcinoma: a controlled randomized study. Menopause. 2010;17:511–5. https://doi. org/10.1097/gme.0b013e3181c8534d
- Kyrgiou M, Chatterjee J, Lyus R, Amin T, Ghaem-Maghami S. The role of cytology and other prognostic factors in endometrial cancer. J Obstet Gynaecol. 2013;33:729–34. https://doi.org/10. 3109/01443615.2013.813916
- Zola FE, Nogueira AA, de Andrade JM, Candido dos Reis FJ. Hysteroscopic appearance of malignant and benign endometrial lesions: a case-control study. Arch Gynecol Obstet. 2007;275:49– 52. https://doi.org/10.1007/s00404-006-0221-4
- Agostini A, Cravello L, Bretelle F, Shojai R, Roger V, Blanc B. Risk of uterine perforation during hysteroscopic surgery. J Am Assoc Gynecol Laparosc. 2002;9:264–7. https://doi.org/10.1016/ s1074-3804(05)60401-x
- Pasini A, Belloni C. Intraoperative complications of 697 consecutive operative hysteroscopies. Minerva Ginecol. 2001;53:13–20.
- Zhang Y, Wang Z, Zhang J, Wang CC, Wang YS, Chen H, et al. Deep learning model for classifying endometrial lesions. J Transl Med. 2021;19:10. https://doi.org/10.1186/s12967-020-02660-x
- Takahashi Y, Sone K, Noda K, Yoshida K, Toyohara Y, Kato K, et al. Automated system for diagnosing endometrial cancer by adopting deep-learning technology in hysteroscopy. PLoS One. 2021;16:e0248526. https://doi.org/10.1371/journal.pone.0248526