У пациентов со значительными пороками сердечных клапанов вмешательство, связанное с восстановлением или заменой клапана, может быть неизбежным. Хотя восстановление клапана выполняется часто, особенно при митральной и трикуспидальной регургитации, замена клапана остается распространенным вмешательством, особенно у взрослых. Для оценки функции протеза часто требуются диагностические методы. Эхокардиография является методом первой линии для неинвазивной оценки функции протезированного клапана. Трансторакальный подход дополняется двумерной и трехмерной чреспищеводной эхокардиографией для дальнейшего уточнения морфологии и функции клапана, когда это необходимо. Совсем недавно достижения в области компьютерной томографии и магнитно-резонансной томографии сердца усилили их роль в оценке клапанных пороков сердца. В этом документе представлен обзор используемых эхокардиографических методов, а также рекомендации и общие рекомендации по оценке функции протезированного клапана на основе данных научной литературы и консенсуса группы экспертов. В этом руководстве обсуждается роль современных методов визуализации с помощью чреспищеводной эхокардиографии, компьютерной томографии сердца и магнитно-резонансной томографии сердца в оценке структуры, функции и регургитации протезного клапана. Она заменяет руководство Американского общества эхокардиографии 2009 года по протезированным клапанам и дополняет руководство 2019 года по оценке клапанной регургитации после чрескожного ремонта или замены клапана. (J Am Soc Echocardiogr 2024;37:2-63).
Аббревиатуры:
2D = двумерный
3D = трехмерный
4D = Четырехмерный
АР = Аортальная регургитация
ASE = Американское общество эхокардиографии
ВВС = Врожденный порок сердца
СМР = Сердечный магнитный резонанс
КТ = Компьютерная томография
БХ = Непрерывная волна
ДИШ = Допплеровский индекс скорости
ЭПО = Эффективная площадь отверстия
ЭПР = Эффективная площадь регургитации
FDA = Управление по контролю за продуктами и лекарствами США
ВСЭ = Внутрисердечная эхокардиография
ЛЖ = Левый желудочек
ВТЛЖ = выходной тракт левого желудочка
МР = Митральная регургитация
ЛА = Легочная артерия
ПЭТ = Позитронно-эмиссионная томография
ППД = Полупериод давления
ПКС = Протезированный клапан сердца
НПП = Несоответствие между протезом и пациентом
ЛР = Легочная регургитация
ПВУ = Паравальвулярная утечка
ЗЛК = Замена легочного клапана
ИХ = Импульсно-волновой
ПП = Правое предсердие
ПЖ = Правый желудочек
RVOT = выходной тракт правого желудочка
SAVR = Хирургическая замена аортального клапана
ЗУП = сбалансированная устойчивая прецессия
СДК = Структурная дисфункция клапана
ТИАК = Транскатетерная имплантация аортального клапана
ТЭЭ = Трансэзофагеальная эхокардиография = Трансторакальная эхокардиография
ТТЭ = Трансторакальная эхокардиография
ТР = Трикуспидальная регургитация
ТК = Трехстворчатый клапан
ЗТК = Замена трикуспидального клапана
ВК = Вена контракта
Квк = Клапан в клапан
ИСВ = Интеграл скорости-времени
ИСВ ПрМК = интеграл скорости-времени протезированного митрального клапана
Ключевые слова: Эхокардиография, допплеровская эхокардиография, искусственные клапаны, сердечные клапаны, магнитно-резонансная томография, компьютерная томография
Часто требуется замена. Несмотря на прогресс в восстановлении клапанов, замена клапанов остается распространенной, особенно у взрослых. Первое руководство Американского общества эхокардиографии (ASE) по оценке протезированных клапанов сердца (ПКС) было опубликовано в 2009 году.1 Впоследствии появилось руководство Европейской ассоциации сердечно-сосудистой визуализации по протезированным клапанам в 2016 году2 и руководство ASE в 2019 году по оценке клапанной регургитации после чрескожного ремонта или замены клапана.3 Хотя многие принципы и рекомендации, изложенные в руководстве ASE 2009 года, все еще остаются актуальными и действительными, в нем не хватает нескольких важных нововведений: функции чрескожных клапанов, использования трехмерной (3D) эхокардиографии и роли компьютерной томографии (КТ) и магнитно-резонансной томографии сердца (МРТ) в оценке ПМК. С развитием структурных вмешательств на сердце и визуализации клапанных пороков сердца необходимо всестороннее обновление руководства. Этот документ заменяет руководство ASE 2009 года и дополняет руководство 2019 года по клапанной регургитации после чрескожного восстановления или замены клапана.1,3
I. ОБЩИЕ СООБРАЖЕНИЯ ОТНОСИТЕЛЬНО ПРОТЕЗИРОВАНИЯ КЛАПАНОВ
A. Типы искусственных клапанов
Существует широкий выбор типов и размеров протезированных клапанов сердца (ПКС), выбор которых зависит от места имплантации, основной клапанной патологии, техники установки и индивидуальных особенностей пациента. Хотя перкутантные клапаны являются биопротезами, хирургически имплантированные протезированные клапаны могут быть как биопротезными, так и механическими, причем последние ассоциируются с большей долговечностью4 , но требуют хронической антикоагуляции. Совместное принятие решений по выбору клапана и техники имплантации должно учитывать анатомию пациента, риск процедуры, ожидаемую продолжительность жизни пациента, ожидаемую долговечность ПКС, а также предпочтения и образ жизни пациента.5
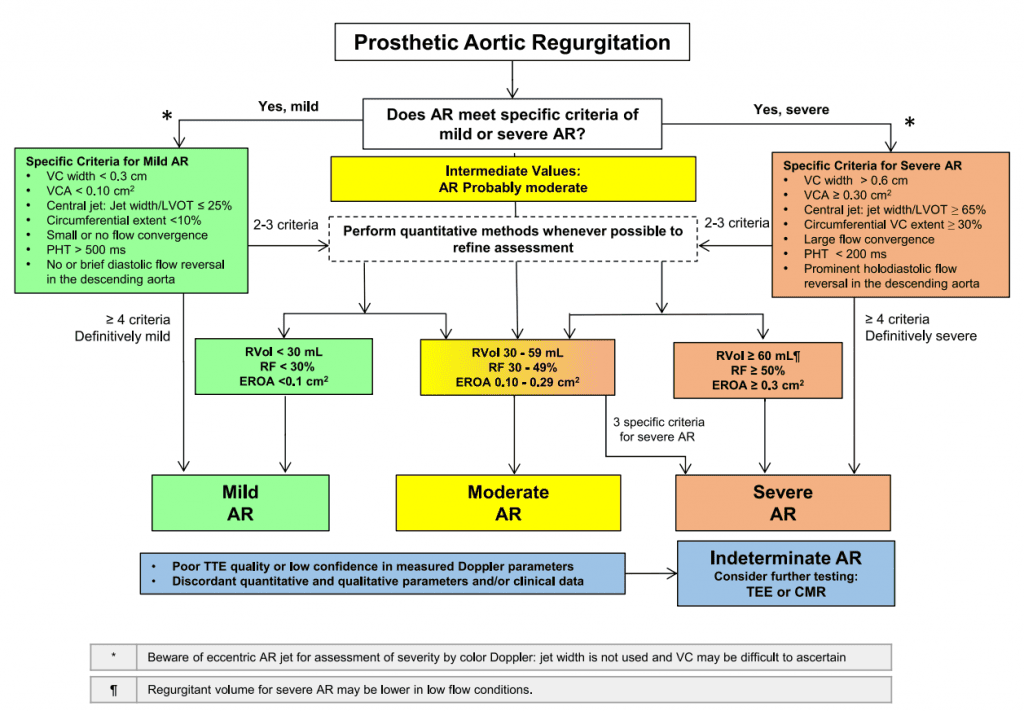
Распространенность имплантации механических клапанов уменьшилась за последние 10 лет по нескольким причинам, в том числе из-за предпочтений пациентов. Транскатетерный ремонт и замена клапанов изменили демографические и клинические характеристики пациентов, которым проводят хирургическую замену клапанов.6,7 Потребность в одновременных процедурах, таких как модификация корня аорты и восходящей аорты, а также модификация выходного тракта левого желудочка (ВТЛЖ) или выходного тракта правого желудочка (ВТПЖ), также может повлиять на выбор ПКС. Самым распространенным типом механического клапана является двустворчатый перекидной клапан (например, St. Jude Medical, Carbomedics, On-X), который обеспечивает наилучшую гемодинамику среди имеющихся на сегодняшний день механических клапанов.8 Одиночные перекидные дисковые клапаны с низкой тромбогенностью (например, Medtronic-Hall) в современной практике применяются нечасто. Наконец, клапан Старра-Эдвардса с шариком в сепараторе больше не имплантируется; однако, ввиду его долговечности, некоторые из этих клапанов продолжают удовлетворительно функционировать и могут встречаться в клинической практике.
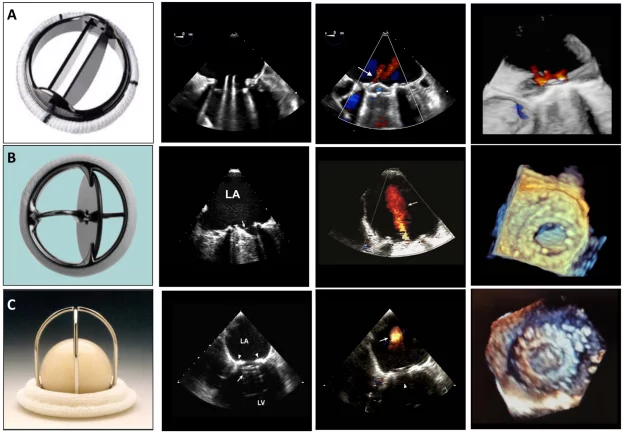
Рисунок 1 Механические клапаны: (А) двустворчатый, (В) одностворчатый и (С) трехстворчатый и их 2D и 3D чреспищеводные эхокардиографические показатели, полученные в митральной позиции в диастолу и систолу (вторая и третья панели слева). Стрелки в диастолу указывают на открытый окклюдерный механизм клапана, а в систолу – на характерную физиологическую регургитацию, наблюдаемую с каждым клапаном. Изображения трехмерной чреспищеводной эхокардиографии (четвертая панель) из чреспищеводного окна показаны с вида левого предсердия. LA – левое предсердие; LV – левый желудочек.
Примеры механических протезов клапанов изображены на рисунке 1, а примеры стентированных и чрескожных биопротезных клапанов – на рисунке 2.
Хирургические биопротезы клапанов могут быть ксенотрансплантатами, состоящими из перикардиальной ткани свиньи или крупного рогатого скота, гомотрансплантатами от трупных доноров или аутотрансплантатами (как, например, в процедуре Росса). Чаще всего используются стентированные ксенотрансплантаты; перикардиальные листки устанавливаются на внутренней или внешней стороне стентового каркаса. Внешние створки и безстентовые биопротезы имеют преимущество в виде большей площади створок и меньшего трансклапанного градиента, но недавние исследования показывают высокий уровень ранней структурной дисфункции клапана (СДК), особенно у молодых пациентов.9 В случае СДК транскатетерные процедуры “клапан в клапане” (КвК) предлагают пациентам альтернативу хирургической реоперации.10 Хотя риск развития коронарной обструкции с внешне установленными створками, а также безстентовыми клапанами после процедуры КвК выше, чем с внутренне установленными биопротезными клапанами, процедуры чрескожного разрыва створок могут уменьшить этот риск. Различные биопротезные клапаны часто можно идентифицировать по рентгенологическому и компьютерно-томографическому виду конфигурации стентовых стволов и сшивного кольца.
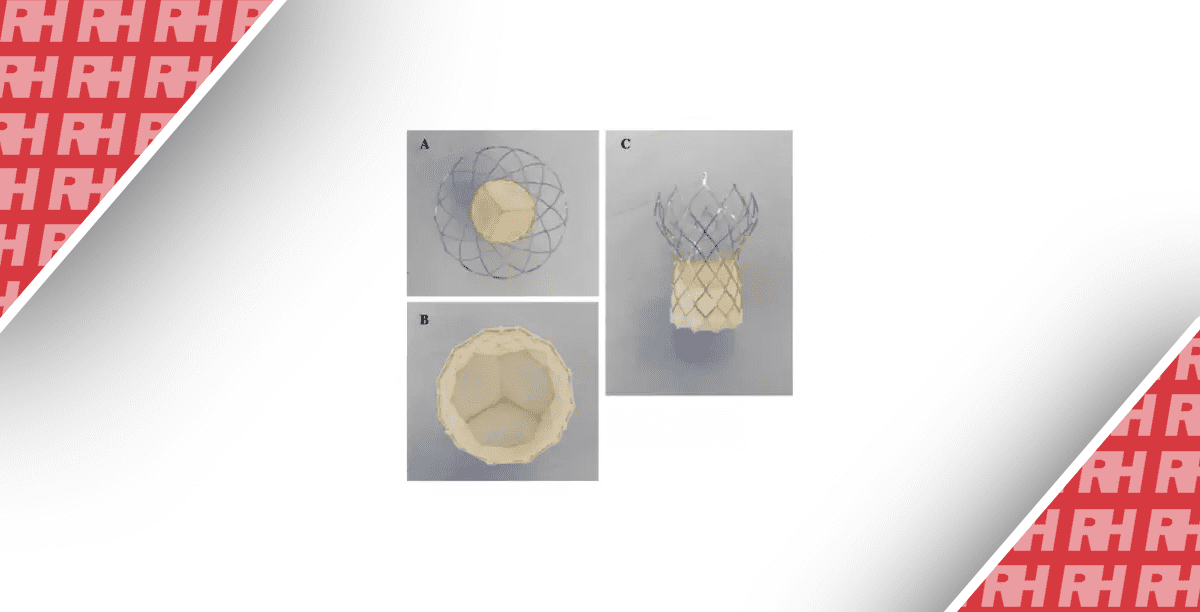
Технология транскатетерной имплантации сердечных клапанов продолжает развиваться с расширением показаний к применению.5 Протезы для транскатетерной имплантации аортального клапана (ТИАК), используемые в коммерческих целях, включают внутрианулярные устройства, расширяющиеся баллоном (например, клапаны SAPIEN; Edwards Lifesciences), супраанулярные саморасширяющиеся клапаны (например, клапаны Evolut; Medtronic), и внутрианулярные клапаны (клапаны Navitor; Abbott Structural Heart). Другие протезы ТИАК находятся на стадии испытаний или раннего использования у людей. С другой стороны, несколько митральных и трикуспидальных транскатетерных клапанов в настоящее время находятся на стадии клинических исследований. Они имеют широкий спектр конструкций и механизмов крепления, включая радиальную силу, захват створок, кольцевое зацепление и апикальное привязывание. Кроме того, возможна транскатетерная имплантация митрального клапана КвК с баллонным расширяемым протезом ТИАК, которая имеет одобрение Управления по контролю за продуктами и лекарствами США (FDA). Клапан SAPIEN также одобрен для имплантации в легочной позиции. Наконец, саморасширяющийся клапан Harmony (Medtronic) недавно получил звание прорывного устройства от FDA и также доступен для лечения детей и взрослых пациентов с тяжелой легочной регургитацией (ЛР).
С точки зрения визуализации, тип, положение и размер протезированного клапана влияют на его гемодинамический профиль и частоту осложнений. Нормальные трансклапанные скорости и градиенты зависят от потока, но могут меняться в зависимости от конкретного размера и типа клапана.11,12 Тип клапана также влияет на количество артефактов, обнаруживаемых при эхокардиографии, КТ и СМР, что может повлиять на оценку функции ПМК. Нормальные эхокардиографические параметры функции клапана для различных типов и размеров протезов в аортальной, митральной, легочной и трикуспидальной позициях.
B. Дисфункция ПКС
Дисфункцию протезированного клапана можно разделить на следующие категории: СДК, неструктурная дисфункция клапана, эндокардит и тромб.13 Независимо от этиологии, гемодинамические последствия дисфункции должны быть количественно оценены. Следующие определения получены от Академического исследовательского консорциума по изучению клапанов 3 13:
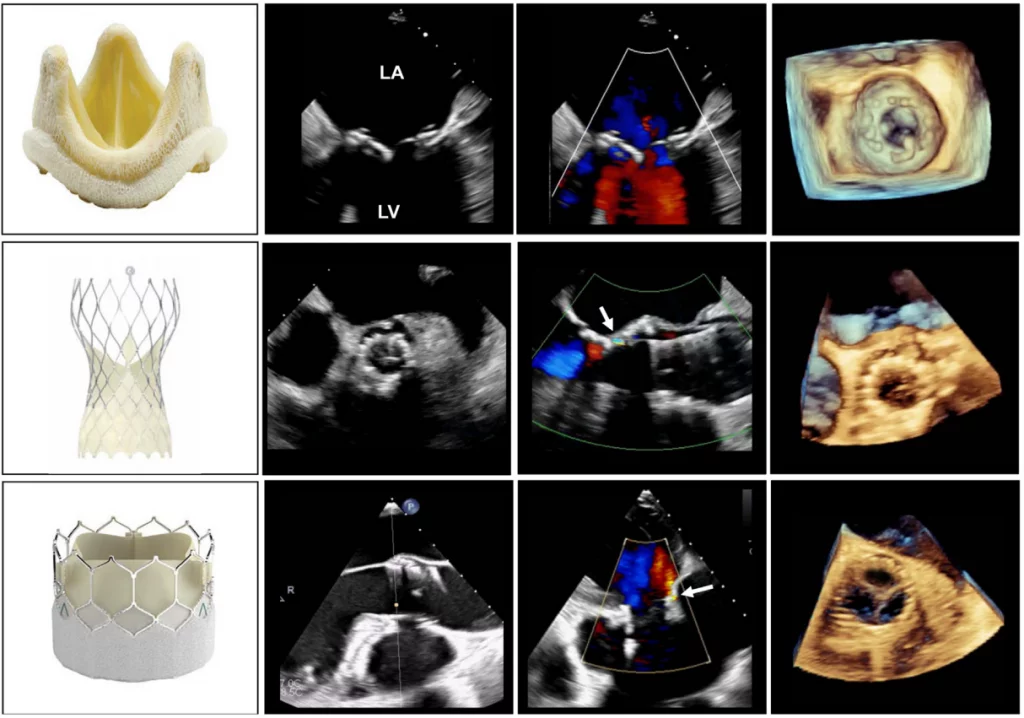
Рисунок 2 Биологические клапаны: стентированный (верхний ряд) и чрескожный клапаны с их эхокардиографическими характеристиками и 3D-трансезофагеальные эхокардиографические изображения. Саморасширяющийся чрескожный клапан находится в среднем ряду, а клапан, расширяемый баллоном, – в нижнем ряду. Стрелками на средних панелях обозначена легкая паравальвулярная регургитация. LA – левое предсердие; LV – левый желудочек.
- СДК: внутренние постоянные изменения протезированного клапана. Примеры включают износ, разрыв створки, фиброз или кальцификацию створки, а также перелом или деформацию стента или стержня. Структурная поломка чаще встречается в биопротезах, чем в механических протезах. Кальцификация клапана является самой распространенной причиной дегенерации биопротеза, которая наблюдается у 50% свиных клапанов в возрасте 5 лет и у 75% в возрасте 8 лет.14 Частота отказов в возрасте от 10 до 15 лет составляет от 10% до 20% для гомотрансплантатов и 30% для гетеротрансплантатов.15 Створки и стенты являются основными местами, где происходит кальцификация и разрыв створки или разрыв стента.
- Неструктурная дисфункция клапана: любая аномалия протеза, не связанная с самим клапаном, но которая приводит к его дисфункции.
- Несоответствие между протезом и пациентом (НПП) возникает, когда нормально функционирующий протез является малым относительно размера пациента, что вызывает высокий градиент и функциональный стеноз. Результаты связаны с тяжестью НПП.
- Паравальвулярная утечка (ПВУ) может возникать в хирургических клапанах из-за дегисценции сшивного кольца, а в транскатетерных клапанах – из-за неправильного расположения каркаса стента с нативной тканью. Дегисценция является серьезным осложнением, которое в 4,9% случаев аортальных ПКС требует повторной операции или катетерного вмешательства, по сравнению с 2,0% митральных ПКС. Факторами риска дегидратации являются бактериальный эндокардит, хирургическая техника, аневризма восходящего отдела аорты, дегенеративная регургитация и выраженная кальцификация нативного клапана. Транскатетерная ПВУ связана со многими факторами, включая неправильный размер устройства, объемную кальцификацию створки или кольца, недостаточное развертывание транскатетерного клапана или неправильную глубину имплантации.13
- Другие неструктурные причины дисфункции: Другие причины дисфункции включают защемление створки или дисфункцию из-за паннуса, неподходящее положение или размер, дилатацию камер сердца после имплантации (например, дилатация корня аорты, дилатация митрального кольца или левого предсердия) и эмболизацию клапана. Паннус – это фиброзная ткань, которая разрастается в перианулярной области и может вызвать дисфункцию ПКС.16 Паннус имеет распространенность от 0,2% до 4,5% и встречается одинаково в механических и биопротезных клапанах, с втрое более высоким риском в митральной позиции.17 Паннус может сосуществовать с тромбообразованием в МКК.
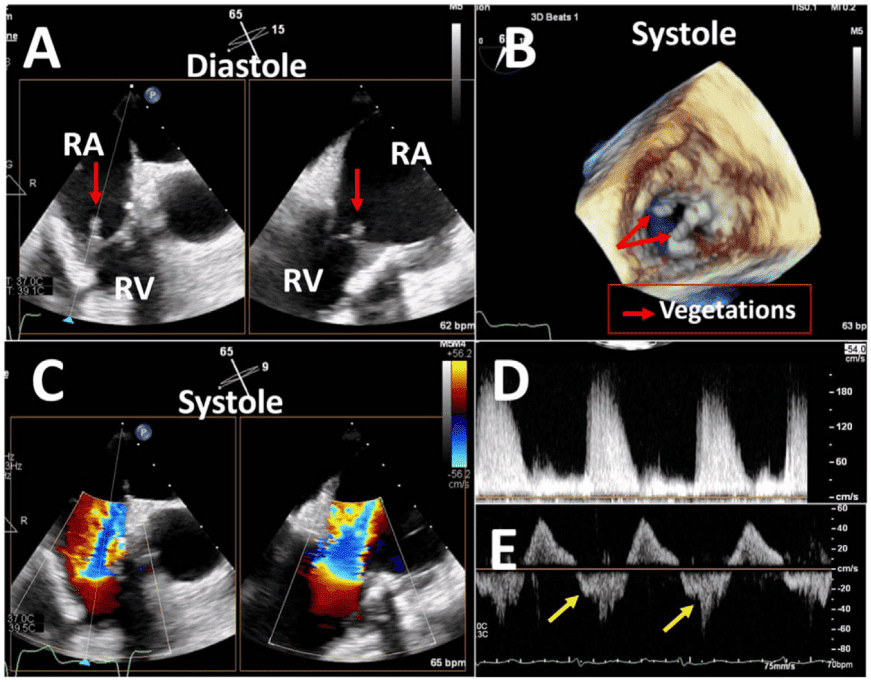
iii. Эндокардит имеет распространенность от 1% до 6% и может возникнуть в любое время после операции. В механических клапанах инфекция почти всегда распространяется от сшивающего кольца и приводит к таким осложнениям, как ПВУ, абсцесс и распространение на соседние структуры. Инфекции биопротезных клапанов возникают на створках и могут распространяться на шовное кольцо или паравальвулярную область. Паравальвулярный абсцесс чаще встречается в ПКС (56%-100%), чем в нативных клапанах (10%-40%), особенно в аортальной позиции.18,19 Псевдоаневризмы часто наблюдаются в аортальной позиции и составляют от 7% до 25% случаев эндокардита протезированного клапана.18-20 Инфицированная псевдоаневризма в связи с ПКС означает дренирование паравальвулярного абсцесса в соседнюю камеру сердца. Между двумя соседними полостями может возникнуть аномальное сообщение, например, фистула, из-за перфорации, вызванной инфекцией, которая выходит за пределы клапана.18,19 Наконец, эндокардит после ТИАК становится все более важным фактором в соответствующей клинической ситуации, учитывая увеличение количества имплантированных протезов ТИАК.21
- Тромб наблюдается у 0,3%-8% протезов.2 Механические клапаны являются более тромбогенными, чем биопротезы, хотя риск тромбообразования для механического клапана при соответствующей антикоагуляционной терапии подобен риску тромбообразования для биопротеза. Правосторонние клапаны более уязвимы к тромбозу, чем левосторонние, причем трикуспидальный клапан (ТК) поражается в 12-20 раз чаще, чем левосторонние клапаны.22 Тромб на эхокардиографии выглядит как образование на клапане с мягкой эхоплотностью, что может быть связано с внутрисердечным тромбом16; в биопротезированных клапанах он может выглядеть как утолщение клапана.23 На КТ тромб на биопротезированных клапанах может выглядеть как гипоатенуированное утолщение створок, характеризующееся утолщенными и гипоатенуированными створками ПКС и сниженной подвижностью клапана (гипоатенуация, влияющая на движение). По сообщениям, распространенность этого явления составляет от 3,6% до 40%.24
| Клиническая информация | Параметры |
| Дата замены клапана | Открывание и закрывание створок или окклюдера |
| Клиническая информация | Параметры |
| Тип и размер протезированного клапана | Наличие утолщения листков, кальцификатов или аномальной эхо-плотности на различных компонентах протеза или рядом с протезом |
| Рост/вес/площадь поверхности тела | Целостность и стабильность кольца для сшивания клапана или стента |
| Симптомы и связанные с ними клинические данные | Положение сшивного кольца или каркаса стента |
| Артериальное давление и частота сердечных сокращений | |
| Эхокардиография | Контур сигнала скорости струи |
| Пиковая скорость и градиент | |
| Средний градиент давления | |
| ИСВ струи | |
| ДИС | |
| Время разгона, время разгона/выброса для AV | |
| ППД в МК и ТК | |
| ЭПО* | |
| Наличие, локализация и тяжесть регургитации†. | |
| Допплер-эхокардиография клапана | Другие эхокардиографические данные |
| Размер, функция и гипертрофия LV и RV | |
| Размер и функция левого предсердия и RA | |
| Сопутствующее заболевание клапанов | |
| Оценка давления ЛА | |
| Паттерн венозного притока | |
| Предварительные послеоперационные исследования, при наличии | |
| Сравнение вышеупомянутых параметров является особенно полезным при подозрении на дисфункцию протезированного клапана |
C. Оценка протезированных клапанов
- Клиническая информация: Показания к исследованию, симптомы пациента, размер и тип замены клапана, а также дата операции должны быть включены в отчет, если они доступны. Это позволит сравнить результаты исследования с ожидаемой нормальной гемодинамикой ПКС. Аналогично следует включить показатели артериального давления, частоты сердечных сокращений, роста, веса и площади поверхности тела. Частота сердечных сокращений влияет на продолжительность диастолического наполнения и, следовательно, на средние градиенты в митральном клапане и ТК; площадь поверхности тела помогает оценить наличие НПП и размер камеры.
- Эхокардиографическое исследование: Пациентам с ПКС рекомендуется проведение стандартизированных измерений камер сердца, систолической и диастолической функции, корня аорты и восходящей аорты согласно руководствам ASE. Для оценки всех компонентов протезированного клапана следует использовать зум-визуализацию с несколькими видами (таблица 1). Из-за акустической реверберации от протезного материала визуализация центрального окклюдера или створок может потребовать внеосевой визуализации. Бипланарная визуализация позволяет одновременно оценить структуру клапана в реальном времени и локализовать паравальвулярную регургитацию с помощью цветного допплера. Умеренное утолщение часто является первым признаком первичной несостоятельности биологического клапана и сигналом к сокращению интервала между последующими исследованиями. Самостоятельные или качающиеся движения заменяемого клапана являются признаком дегидратации и могут быть более диагностическими для клапанов в аортальной позиции.25 В митральной позиции нормальная повышенная подвижность клапана может быть обусловлена кольцевым движением, предсердной или кольцевой реконструкцией или расположением сшивного кольца (то есть в пределах левого предсердия); ее нужно дифференцировать с дегидратацией при отсутствии ПВУ. Утолщение корня аорты вследствие гематомы и отека после установки безстентового клапана обычно исчезает через 3-6 месяцев, но может быть ошибочно принято за абсцесс корня аорты. Просмотр послеоперационного или интраоперационного исследования полезен для подтверждения этого вывода. Заметьте, что тщательное внимание к возможности образования абсцесса необходимо на уровне кольца или сшивного кольца.25 При использовании 3D-эхокардиографии протез следует оценивать с помощью объемных 3D-данных, с цветным допплером и без него, с того ракурса изображения, который лучше всего визуализирует клапанную или параклапанную структуру. Вид протезированных клапанов спереди позволяет легче локализовать ПВУ и управлять чрескожными вмешательствами. При получении наборов 3D-данных следует использовать двумерные (2D) мультипланарные изображения для оптимизации плотности линий и частоты кадров, что позволяет точно оценить пространственные и временные изменения. Этого можно достичь с помощью однотактных узких объемов с использованием режимов 3D в реальном времени или многотактного сбора с использованием режимов 3D в реальном времени, масштабирования или полного объема, желательно с частотами объема, превышающими 20 Гц. Если измерения проводятся с использованием 3D-объемов, предпочтение отдается одноканальному сканированию с высокой объемной скоростью. Однако, если 3D цветной допплер необходим для количественной оценки площади Вена контракта (ВК), то для улучшения плотности линий и объемной скорости может потребоваться многоканальное сканирование. Оптимальные 3D-изображения будут включать окружающие ткани и клапанные ориентиры, чтобы можно было определить и отобразить локализацию поражения в соответствии с рекомендациями ASE и Европейской ассоциации эхокардиографии.26
iii. Допплеровская эхокардиография: Принципы исследования и регистрации скорости потока через протезированные клапаны с использованием импульсно-волнового (ИВ), непрерывно-волнового (НВ) и цветного допплера подобны тем, что используются при оценке функции нативного клапана.
- Определение градиентов через протезированные клапаны: Скорость через протезированный клапан зависит от потока, размера и типа клапана. Упрощенное уравнение Бернулли (DP = 4V2) является ключевым для неинвазивного расчета градиентов давления. У пациентов с аортальными протезами и высоким сердечным выбросом или узким ВТЛЖ, у которых проксимальная скорость (V1) составляет >1,5 м/с, проксимальную скорость больше нельзя игнорировать, и оценка градиента давления составляет DP = 4(V2 2 V1 2 ). Однако, в протезах желчного пузыря и шариковых клапанах может происходить переоценка градиента больше, чем в биопротезах, особенно при меньшем размере клапанов и высоком сердечном выбросе (см. “Восстановление давления”: Гемодинамические условия и клинические последствия”; Рис. 3).27,28
- Эффективная площадь отверстия (ЭПО): Эффективная площадь отверстия протезного клапана, полученная с помощью уравнения непрерывности, является лучшим показателем функции клапана, чем просто градиент, поскольку она меньше зависит от потока через клапан:
EOA = ударный объем/интеграл скорости-времени протезированного клапана (ИСВ).
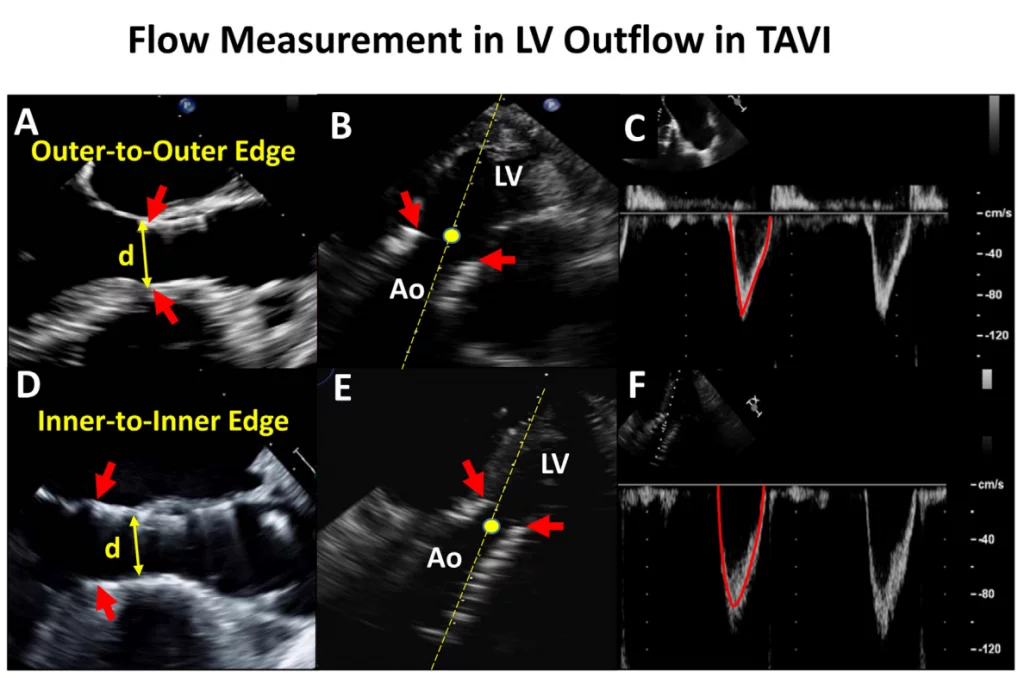
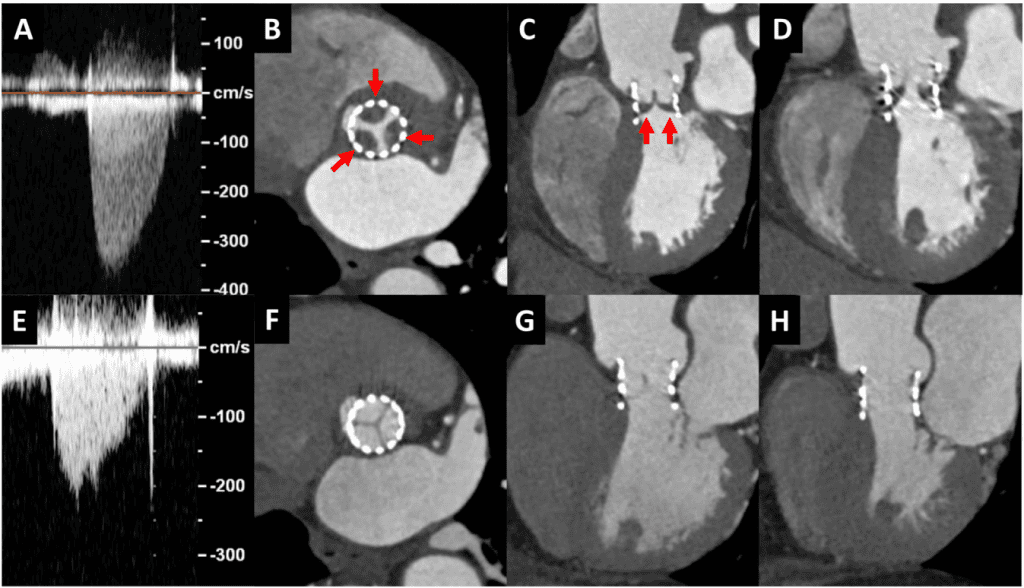
Для расчета ударного объема с использованием ВТЛЖ измерение диаметра ВТЛЖ и соответствующее положение объема ИХ допплеровской пробы вносят наибольшие погрешности в оценку ЭПО.1,2 Используемый диаметр всегда должен быть наибольшим диаметром, измеренным перпендикулярно к направлению ВТЛЖ, а не средним значением, поскольку погрешность заключается в недооценке диаметра ВТЛЖ. При хирургической замене аортального клапана (ХЗАК) диаметр измеряют чуть ниже плоскости клапана. При ТИАК диаметр ВТЛЖ преимущественно определяется как наружный диаметр стентированного клапана.3,11 Объем ИХ допплеровского образца также должен быть размещен апикально к каркасу стента на пике систолы. Можно использовать внутренний диаметр стента, но соответствующий объем ИК допплеровской пробы внутри стента может регистрировать ускорение потока, завышая ударный объем (рис. 4). Использование размера этикетки протезированного клапана для расчета площади поперечного сечения кольца не рекомендуется.29 Метод бипланарных дисков для расчета объема левого желудочка (ЛЖ) (модифицированный метод Симпсона) и 3D-объемов ЛЖ являются альтернативными методами для расчета общего ударного объема ЛЖ и ЭПО, особенно при наличии ускорения потока в ВТЛЖ. Однако, для предотвращения недооценки ударного объема ЛЖ, которая, как известно, случается при эхокардиографии по сравнению с СМРТ, настоятельно рекомендуется избегать форшоринга ЛЖ и использовать ультразвуковые усилители.30,31 При протезированных митральных клапанах можно использовать ударный объем, рассчитанный на уровне кольца аорты или легочного кольца, при условии отсутствия значительного митрального, аортального или ЛЖ.
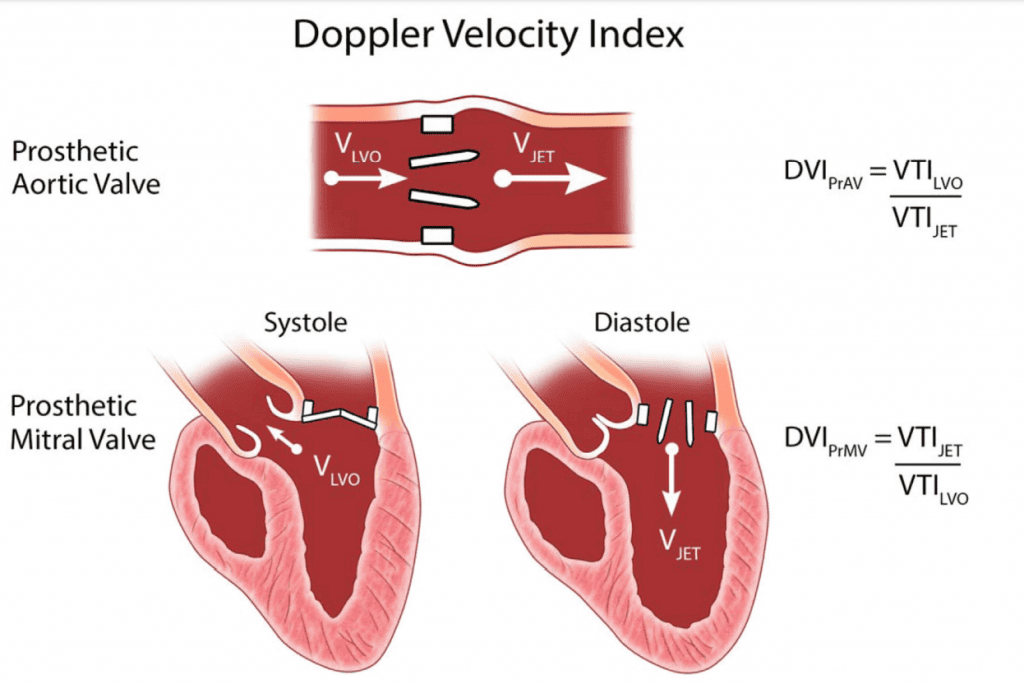
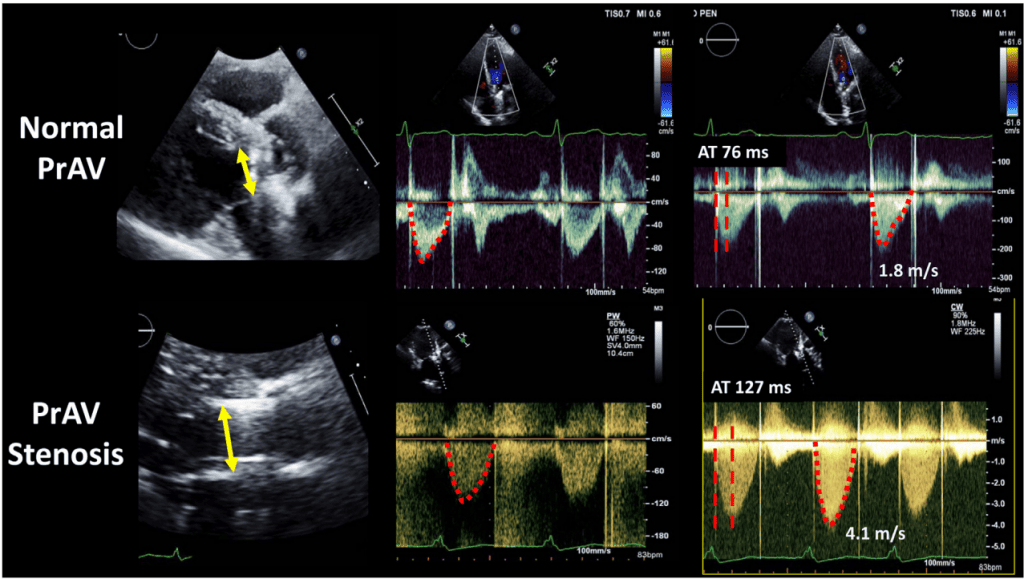
- Допплеровский индекс скорости (ДИС): В протезированных аортальных клапанах ДИС – отношение ИСВ проксимально к клапану к ИСВ через клапан – можно использовать для оценки функции аортального клапана.29,32 ДИС 0,35 ассоциируется с неблагоприятными последствиями для ХЗАК, но не для ТИАК.32 Обратное значение этого показателя используется для протезирования митральных клапанов (Рис. 5).33 Для митральных клапанов этот показатель также помогает выявить значительную митральную регургитацию (МР), поскольку скорость потока увеличивается через митральный клапан и уменьшается в ЛЖ при значительной МР. Параметр ДИС также может применяться к протезированным легочным клапанам и ТК, но требуется дополнительная валидация.
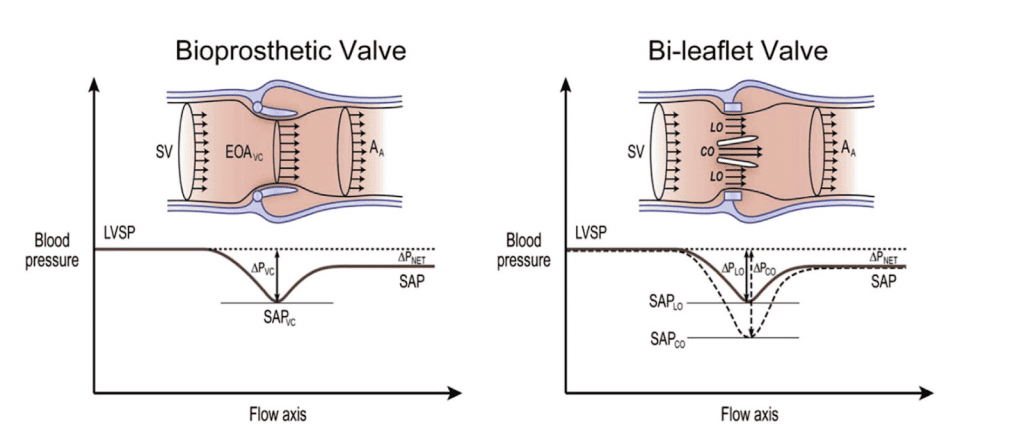
Рисунок 3 Восстановление давления в протезированных клапанах. Схемы изменения скорости и давления в протезированных аортальных клапанах. Скорость ниже, а систолическое артериальное давление (SAT) выше на дистальном отделе аорты, чем на уровне ВК. На левом рисунке показаны изменения скорости и давления от оттока крови из левого желудочка LV к восходящей аорте (AA) в стентированном биопротезном клапане. Когда поток расширяется в более широкий просвет за клапаном, скорость и кинетическая энергия уменьшаются, а давление восстанавливается. Величина этого явления невелика, за исключением пациентов с аортами диаметром <3 см. Дело в том, что в механических протезах желчного протока скорость выше в центральном отверстии (CO) по сравнению с боковыми отверстиями (LO); следовательно, падение давления на этом уровне выше. Этого не наблюдается ни в одном тарельчатом или биопротезном клапане. Меньший объем CO создает струю с большей скоростью, что соответствует локальному падению давления, которое затем восстанавливается, как только центральный поток воссоединяется с потоками из двух боковых отверстий. Допплеровская оценка скорости и градиентов обычно не может различить минимальную и максимальную скорость, что приводит к завышенной оценке по сравнению с инвазивным стандартом. LVSP, систолическое давление в левом желудочке; SV, ударный объем в выходном тракте ЛЖ.
Рисунок 4 Расчет потока в выходном тракте левого желудочка в транскатетерных аортальных клапанах. Подход по умолчанию заключается в измерении диаметра ВТЛЖ, используя внешний диаметр от края до края на нижнем (желудочковом) конце стента клапана (А, стрелка). ИХ объем образца с апикальной проекции размещается непосредственно проксимальнее места ускорения потока на входе в стент (В). Затем рассчитывают ударный объем, как обычно, предполагая круговую геометрию ВТЛЖ как 0,785 d2 ИСВ. В случаях, когда саморасширяющийся клапан размещен низко в выходном тракте левого желудочка, особенно если нижний конец стента не находится в непосредственной близости к передней митральной створке и межжелудочковой перегородке, альтернативным подходом является измерение внутреннего диаметра стента клапана от края до края непосредственно проксимальнее створок (D). Затем объем допплеровского образца следует разместить непосредственно внутри стента, но проксимальнее от места ускорения потока на створках клапана (E). Скорость и ИСВ будут большими, если ИХ допплеровский объем будет размещен непосредственно внутри стента (F против C). Обратите внимание, что при использовании транскатетерных клапанов наблюдается ускорение потока на входе в стент и снова на створках клапана. Красные стрелки указывают на нижний конец стента. Ао – аорта; LV- левый желудочек.
Рисунок 5 DVI допплеровский индекс скорости, индекс эффективности работы клапана, полученный для протезированного аортального клапана (ПрАК) (PrAV) и для протезированного митрального клапана (ПрМК) (PrMV).Интеграл скорости-времени ИСВ (VTI) в выходном тракте ЛЖ (ИТ) (LVOT) определяется с помощью ИХ допплерографии, а в струйном отделе – с помощью НВ допплерографии. Такую же концепцию можно применить к легочному клапану и ТК. Использование DVI в протезах митрального, трикуспидального и легочного клапанов допустимо при отсутствии значительной АР.
D. Восстановление давления: Гемодинамические условия и клинические последствия
В протезированных клапанах явление восстановления давления может происходить в двух участках (Рис. 3): (1) ниже по течению от протезного клапана и (2) внутри некоторых протезных клапанов, как правило, створчатых или шариковых.27,34-36
В первом сценарии (рис. 3, слева), когда поток расширяется в более широкий просвет за клапаном, скорость и кинетическая энергия уменьшаются, а давление восстанавливается. На величину восстановления давления и точность допплеровских градиентов влияют несколько факторов, включая профиль потока, скорость потока, размер камеры за клапаном и упрощение уравнения Бернулли, что может привести к более высоким градиентам при допплерографии по сравнению с инвазивными измерениями.37 Величина этого расхождения, как правило, невелика, за исключением пациентов с аортами диаметром <3 см.
Во втором сценарии (рис. 3, справа) конструкция механических двустворчатых и шариковых протезированных клапанов создает отдельное восстановление давления на уровне клапана, чего не наблюдается в моностворчатых или биопротезных клапанах.38 В двустворчатых клапанах меньшее центральное отверстие создает высокоскоростную струю, которая соответствует локальному падению давления, нормализующемуся, как только центральный поток воссоединяется с потоками, выходящими из двух больших боковых отверстий.34,38 НВ допплеровская запись часто включает эту высокоскоростную струю, что приводит к переоценке градиентов и недооценке ЭПО по сравнению с инвазивными гемодинамическими мероприятиями, особенно при небольших протезах и высокоскоростных состояниях. Дифференциация струй из центрального и бокового отверстий возможна при протезированных митральных клапанах с помощью трансэзофагальной эхокардиографии (ТЭЭ; в ближнем поле), но не с помощью трансторакальной эхокардиографии (ТТЭ). Эффект восстановления давления обычно не мешает оценке функции ПКС, поскольку он уже заложен в нормальных значениях допплеровских скоростей, градиентов и ДИС различных клапанов (Приложение, таблицы А1-А9). Однако у пациентов с небольшими створками аортального клапана (например, 19 мм), сопровождающимися высоким потоком, дифференциация аномальной функции может потребовать дальнейшей оценки движения и структуры клапана с помощью рентгеноскопии, КТ или ТТЭ. Последнее и самое важное: когда клапан (биопротезный или механический) становится стенозированным, эхокардиографические и инвазивные методы исследования клапанной гемодинамики становятся согласованными и ассоциируются с результатами.27,28,37
E. Несоответствие протеза пациенту
НПП возникает, когда ЭПО протезированного клапана слишком мала относительно размера тела и потребностей кровотока в состоянии покоя пациента.39 ЭПО, а также морфология и подвижность створок являются нормальными; однако, индексированный ЭПО является малым для размера тела.40 Хотя НПП может быть одной из причин высоких трансклапанных градиентов, градиенты могут быть нормальными при НПП с низким кровотоком, что ассоциируется с плохими последствиями.41
Диагностика аортальной НПП основывается на измерении ЭПО с использованием уравнения непрерывности, индексированного на площадь поверхности тела пациента. КТ может предоставить дополнительную диагностическую информацию, включая подтверждение нормальной подвижности створок, размера протеза и площади входа стента. Она также позволяет выявить обструкцию клапана (сниженную подвижность из-за тромба, кальцификатов или паннуса).2 Было показано, что градиенты увеличиваются экспоненциально, когда индексированная ЭПО составляет <0,8-0,9 см2 /м2. 39,42 Важно, что индексированная ЭПО может переоценивать тяжесть НПП на фоне ожирения (индекс массы тела > 30 кг/м2), и поэтому для таких пациентов предложены различные пороги НПП.
Влияние аортальной НПП на клинические последствия возрастает с увеличением степени тяжести.43,44 Сообщается, что частота умеренной аортальной НПП при ХЗАК варьирует от 20% до 70%, тогда как частота тяжелой НПП – от 2% до 20%.40 Частота тяжелой НПП при ТИАК ниже, чем при ХЗАК.45,46 Следует подчеркнуть, что индексированный ЭПО (а не размер или геометрические характеристики протеза) является единственным параметром, который последовательно связан с послеоперационными градиентами и/или неблагоприятными клиническими последствиями. ХЗАК НПП ассоциируется со снижением способности к физической нагрузке и более низким функциональным классом. Основным неблагоприятным клиническим последствием НПП является снижение краткосрочной и долгосрочной выживаемости, но также сообщалось о более высоких показателях сердечной недостаточности и госпитализации, меньшей регрессии гипертрофии ЛЖ и более быстром развитии СДК.40 Худшие результаты также были описаны в определенных подгруппах пациентов, таких как лица в возрасте от 65 до 70 лет и лица с сопутствующей дисфункцией ЛЖ, значительной гипертрофией, низкоградиентным аортальным стенозом и МР.47,48 Аортальной НПП обычно можно избежать47,49,50 с помощью расчета прогнозируемой индексированной ЭПО протеза перед имплантацией. Если предполагается НПП, рекомендуется выбрать альтернативный протез, сделать выбор в пользу ТИАК или рассмотреть возможность операции по расширению корня аорты.40
НПП также может возникать при использовании митральных протезов, но корреляция между индексированным ЭПО и трансклапанными градиентами не такая сильная, как при использовании аортальных протезов.51 Расчет индексированной ЭПО для митральных протезов лучше всего проводить с помощью уравнения непрерывности; следует подчеркнуть, что расчет ЭПО по методу полупериода давления (ППД) часто является неточным и приводит к завышению ЭПО, особенно в нормальных клапанах.52,53 Пороговые значения для митральной НПП выше, чем для аортальных клапанов, с идеальной индексированной ЭПО >1,2 см2 /м2, чтобы избежать аномально высоких послеоперационных градиентов.53 Умеренная митральная НПП определяется как <1,2 см2 /м2, а тяжелая митральная НПП определяется как #0,9 см2 /м2. 2,54 Распространенность митральной НПП варьирует от 39% до 71%. Он ассоциируется со стойкой легочной гипертензией и сниженным периоперационным и долгосрочным выживанием.55,56 Митральный НПП можно предотвратить или минимизировать путем имплантации протеза с большим прогнозируемым ЭПО, когда это возможно.54
F. Физиологическая регургитация
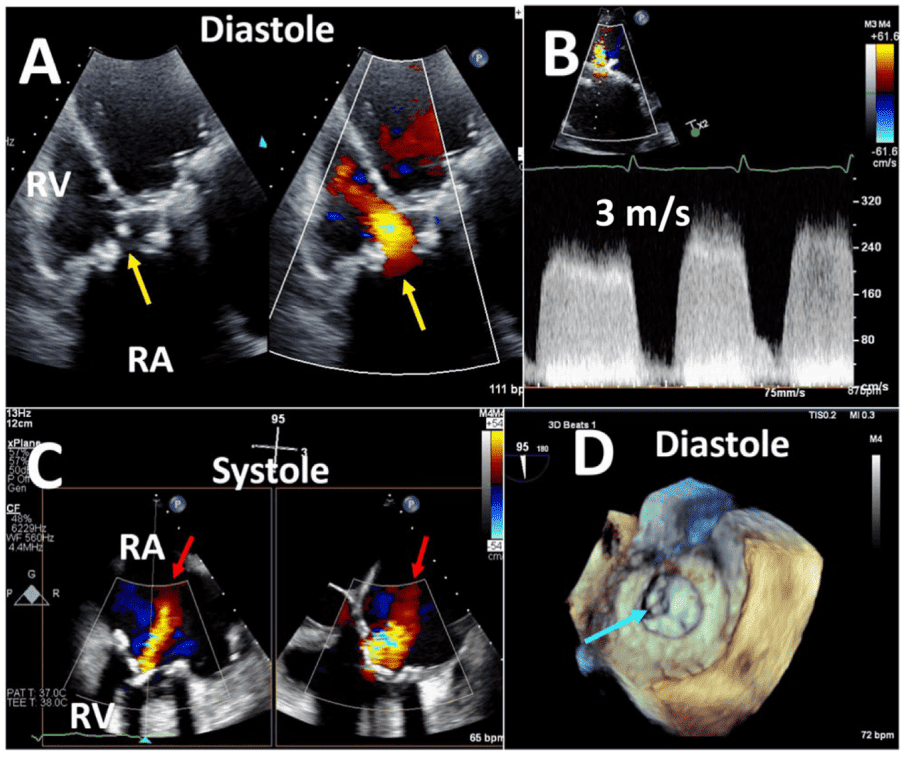
Механические клапаны обычно имеют незначительные регургитационные струи. Можно наблюдать два типа “физиологической” регургитации: объем закрытия (ретроградное вытеснение крови, вызванное движением окклюдера) и настоящую тривиальную или легкую регургитацию на шарнирах окклюдера. Для клапана StarrEdwards обычно характерен малый объем закрытия и незначительная или отсутствующая истинная трансклапанная регургитация (рис. 1). Клапаны с одним наклоненным диском имеют оба типа регургитации, но схема может отличаться: клапан BjorkShiley имеет небольшие струи, расположенные непосредственно внутри сшивного кольца, где закрытый диск соприкасается с корпусом, тогда как клапан Medtronic-Hall имеет те же самые струи плюс одну большую струю через центральное отверстие в диске, где он поворачивается (Рис. 1). Двустворчатые клапаны, которые сейчас широко используются, обычно имеют несколько струй, расположенных непосредственно внутри сшивного кольца, где закрытые створки соприкасаются с корпусом, и по центру, где закрытые створки соприкасаются друг с другом (рис. 1). Считается, что эти “промывные струи” предотвращают образование тромбов в местах застоя внутри сшивного кольца. Фракция регургитации обычно не превышает 10-15%; соответствующая цветная струя может выглядеть большой, до 5 см длиной (особенно в клапанах Medtronic-Hall), но узкой в начале. В случае двустворчатых клапанов промывные струи, как правило, располагаются в форме, по две из каждой точки поворота; иногда эти одиночные поворотные промывные струи разделяются на два или три отдельных “шлейфа” (Рис. 1). Струи всегда имеют низкий импульс, поэтому они однородны по цвету, а алиасинг приурочен преимущественно к основанию струи. Все чаще сообщается о регургитации в нормальных биологических клапанах, главным образом из-за улучшенной допплеровской чувствительности современных ультразвуковых аппаратов. Нестентированные клапаны, включая гомографты и аутографты, чаще, чем стентированные клапаны, имеют незначительные регургитационные струи. Чрескожные аортальные клапаны редко имеют небольшую центральную регургитацию. Чаще регургитация является паравальвулярной в месте прилегания стента к кальцинированному нативному клапану (Рис. 2).3 Частота паравальвулярной регургитации значительно уменьшилась с усовершенствованием конструкции створок клапана.
G. Патологическая регургитация при протезировании
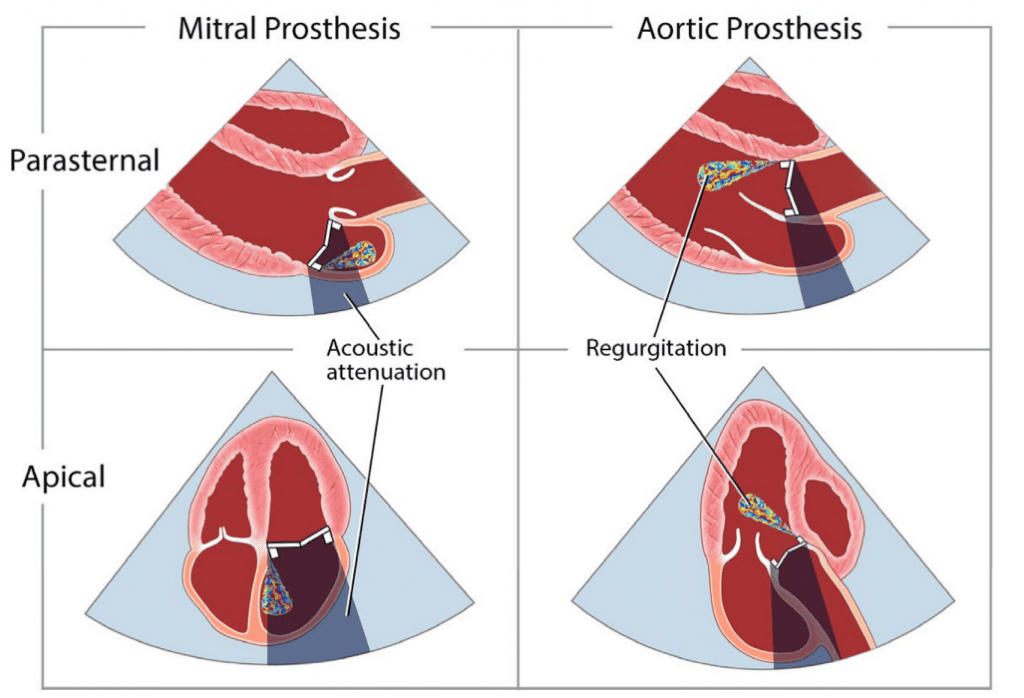
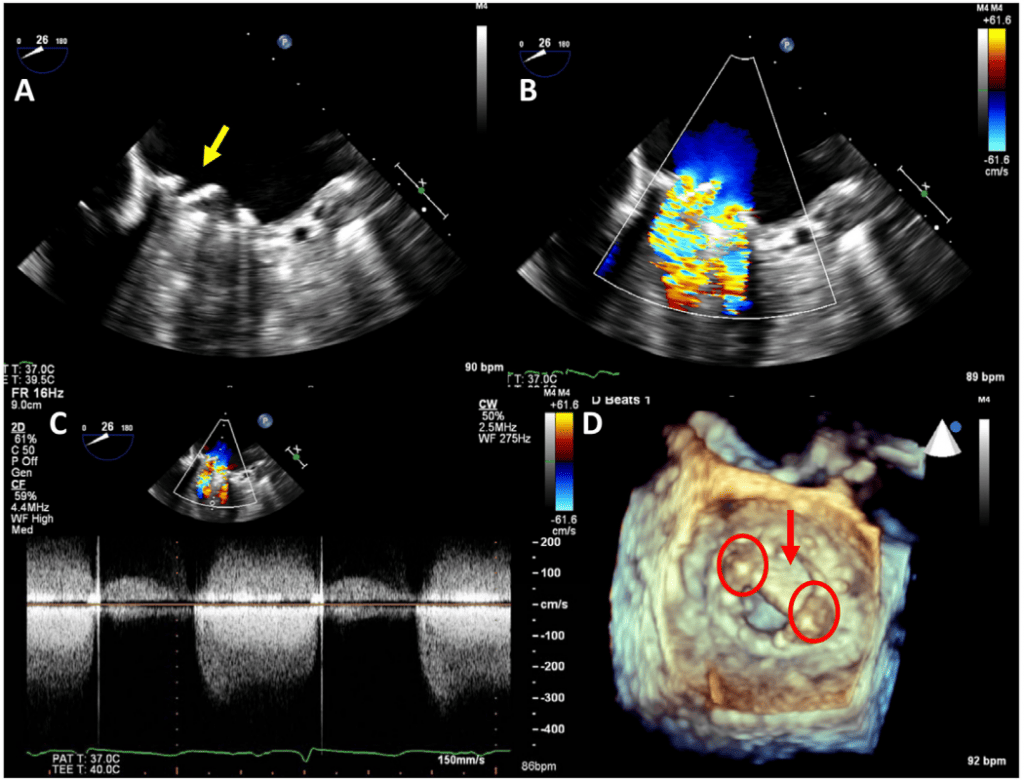
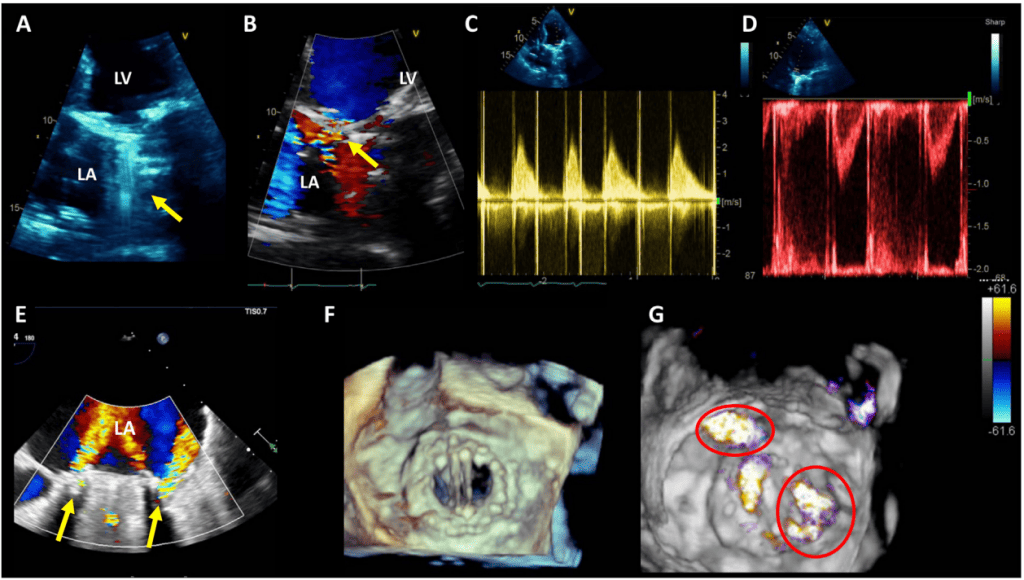
Патологическая регургитация может быть центральной или параклапанной. Патологическая центральная клапанная регургитация чаще всего наблюдается при использовании биологических клапанов, тогда как параклапанная регургитация может наблюдаться при любом типе клапанов, но чаще при механических и чрескожных клапанах (Рис. 2). Локализация паравертебральной регургитации может быть сложной, но возможной, если можно визуализировать струю, которая выходит из-под сшивного кольца и движется за его пределами. Для этого может потребоваться использование нескольких положений датчика и внеосевых изображений.3 Мультипланарная и/или 3D-ТЭЭ может быть полезной, особенно при исследовании митрального клапана и ТК. Хотя паравальвулярная регургитация является патологией, небольшие струи не являются редкостью, особенно во время периоперационного обследования на ранней стадии после хирургического вмешательства. Сразу после имплантации распространенность паравальвулярной регургитации колеблется от 5% до 20%57; большинство этих утечек, однако, являются клинически и гемодинамически незначимыми и, при отсутствии эндокардита, имеют доброкачественное течение. В общем, те же самые методы, используемые для количественной оценки нативной клапанной регургитации58 , могут быть использованы для протезированных клапанов, но применение этих методов может быть более сложным. Из-за акустической реверберации и затенения от протеза обнаружение регургитации с помощью ТТЭ является более сложным для клапанов в митральной и трикуспидальной позициях, особенно для механических клапанов (рис. 6). Косвенные признаки по различным допплеровским параметрам могут указывать на наличие значительной регургитации. Однако для диагностики МР часто требуется проведение ТЭЭ. Частая эксцентриситетность регургитационных струй, особенно в механических клапанах, затрудняет или ограничивает количественную оценку регургитации в целом. Множественные небольшие нормальные нормальные транспротезные струи не поддаются точному количественному определению, но они, как правило, не имеют клинической значимости. Для паравальвулярных струй доля окружности сшивного кольца, которую занимает струя, дает приблизительное представление о тяжести.3 Сравнительные измерения потока для определения объема или фракции регургитации, которые часто основываются на определении ударного объема в кольцевых участках, могут быть использованы для протезирования аортальной регургитации (АР) и ЛР, но не для протезирования МР, поскольку митральный приток не может быть измерен с помощью допплерографии из-за наличия митрального протеза. Использование 3D-ТЭЭ с допплерографией улучшает оценку и количественную оценку протезированной регургитации.59
Рисунок 6 Влияние положения механического протеза клапана и вида эхокардиографического изображения на ослабление ультразвука и маскировку цветной допплеровской струи потока регургитации. Более высокий эффект от трансторакальной визуализации наблюдается на протезах в митральной позиции по сравнению с аортальной позицией.
H. Изменения во время стресса
Стресс-эхокардиография может быть полезной для оценки симптомов у пациентов с протезированными клапанами,60 особенно когда есть несоответствие между гемодинамикой клапана в состоянии покоя и симптомами пациента. Нормально и аномально функционирующие протезированные клапаны могут иметь подобные трансклапанные градиенты в состоянии покоя.61 Симптомы могут развиваться вследствие протезного стеноза или регургитации, НПП, коронарных стенозов или легочных заболеваний, и их можно оценить во время стресс-эхокардиографии. Поскольку гемодинамика может быстро вернуться к исходному уровню после нагрузок на беговой дорожке, лучшими методами являются велоэргометрия в положении лежа и фармакологический стресс с добутамином; оба позволяют оценить клапанную гемодинамику во время стресса и на пике стресса. Упражнения, как правило, лучше фармакологического стресса из-за их физиологической реакции, что является важным в этих клинических обстоятельствах. В общем, оценка обструкции клапана должна быть подобной оценке стеноза нативного клапана, а детали относительно протоколов стрессовых тестов были описаны ранее.60
I. Соображения относительно интраоперационного и интрапроцессуального руководства
ТЭЭ с использованием как 2D, так и 3D визуализации остается основой для интраоперационного и интрапроцедурного руководства при установлении ПКС. Кроме того, внутрисердечная эхокардиография (ВСЭ), включая 3D ВСЭ и слияние изображений, становится все более важной для визуализации во время структурных процедур. Другие подходы, такие как эпикардиальная и эпиаортальная эхокардиография, используются в операционной нечасто, согласно местному опыту.62 i. Интраоперационная эхокардиография во время установки протезированного клапана: Помимо оценки дисфункциональных протезированных клапанов или недавно установленных протезов, ТЭЭ может выявить ранее невыявленную патологию для соответствующего хирургического планирования и направлять размещение канюль для облегчения сердечно-легочного шунтирования, особенно при малоинвазивных и роботизированных операциях на клапанах. Фундаментальной целью интраоперационной оценки новых клапанов является диагностика любой патологии, которая требует восстановления искусственного кровообращения и немедленной хирургической коррекции. К ним относятся значительная параклапанная регургитация, расслоение протезов и осложнения в соседних структурах, такие как коронарная остистая обструкция или застревание створок протезного клапана. Трехмерная ТЭЭ имеет значительное влияние на оценку ПКС при митральной позиции по сравнению с другими позициями из-за близости митрального клапана к левому предсердию и визуализации всего митрального клапана “анфас”. Трехмерная ТЭЭ особенно полезна для выявления и характеристики параклапанной регургитации. Более комплексный подход к интраоперационной визуализации протезированных клапанов обсуждается в руководствах ASE по использованию ТЭЭ для помощи в принятии хирургических решений.62
- Ориентирование по изображению во время чрескожной замены протезированного клапана
- Двумерная и трехмерная ТЭЭ: ТЭЭ является важным инструментом для наведения изображения при чрескожной замене ПКС, особенно для протезирования митрального клапана, а также для устранения паравальвулярной регургитации.63 ТЭЭ для ТИАК также была широко рассмотрена. Замена легочного клапана (ЗЛК) часто выполняется под руководством ИСЭ. Телевизионное вмешательство все еще является экспериментальным, но проводится с помощью ТЭЭ, дополненной, при необходимости, ИХЭ.
- ТИАК: Управление изображением во время ТИАК выполняется с использованием как трансторакального, так и чреспищеводного эхокардиографических подходов.3,64 Основное внимание уделяется выявлению паравальвулярной регургитации с учетом основных осложнений, которые могут возникнуть после ТИАК, таких как разрыв кольца аорты, дефект межжелудочковой перегородки, периаортальная гематома, обструкция ВТЛЖ и вмешательство в работу митрального клапана.64,65. Большинство лабораторий применяют полуколичественный подход, используя цветную допплерографию только в этом случае, а при необходимости подтверждают диагноз инвазивной гемодинамикой и аортографией.
- Ремонт или замена митрального клапана. Трехмерная ТЭЭ была революционной в отношении руководства транскатетерным ремонтом митрального клапана от края до края и развертывания устройства.66,67 Трехмерная ТЭЭ также важна для размещения КвК в митральной позиции при дегенеративном биопротезировании клапана, неудачном восстановлении митрального клапана хирургическим кольцом или при процедуре кальцификации кольцевого клапана в митральном отделе.63
- Ремонт или замена трикуспидального клапана при врожденной трикуспидальной регургитации (ТР): Ремонт или замена ТК, как правило, проводится с помощью 2D и 3D ТЭЭ. В этой более сложной и относительно новой процедуре рекомендуется дополнительная визуализация из глубокой пищеводной позиции, чтобы избежать акустического шума со стороны левых отделов сердца. С этого уровня наиболее полезными являются изображения притока-истока с ортогональными 140 и 40-60 видами из глубокого пищевода.68 Вид 140 ТЭЭ полезен из-за отсутствия близлежащих структур, которые препятствуют прохождению ультразвукового луча.68-70.
Таблица 2 Мультимодальная визуализация протезированных клапанов после первичной трансторакальной эхокардиографической оценки: преимущества и ограничения
| Методы диагностики | Преимущества | Недостатки |
| ТЭЭ | – Высокое пространственное и временное разрешение в реальном времени структуры и функции клапанов – Допплеровская количественная гемодинамическая оценка функции клапанов – Лучшая визуализация и оценка митрального клапана (анфас), а также аортального, трикуспидального и легочного клапанов: Движение створок и окклюдера/стулок, этиология дисфункции, градиент; оценка локализации и тяжести регургитации (транс- или параклапанная) – 3D ТЭЭ, с использованием прямых изображений и/или МПР, может предложить более точную оценку структуры клапана, движения створок/окклюдера, локализации ПВУ и оценку исходного уровня перед структурным вмешательством. – Выявление клапанных вегетаций (малых, подвижных) – Выявление параклапанных осложнений (дегисценция, абсцесс, псевдоаневризма) – Портативность, возможность использования в отделениях интенсивной терапии/отделениях неотложной помощи и у интубированных пациентов – Отсутствие противопоказаний при почечной дисфункции | – Оптимальная визуализация и оценка клапана зависит от положения клапана и датчика – реверберация/затенение от протезированных клапанных структур ближнего поля препятствуют визуализации структур дальнего поля; изменение акустических окон может позволить визуализировать ранее затененные структуры. – Меньшая возможность оценить структуру и функцию легочного клапана; нужны специальные виды |
| ВСЭ | – Лучшая модальность для оценки легочного клапана и створок и передних структур сердца – 3D ВАИТ может показывать прямую проекцию легочного клапана и створок, а также митрального клапана (при выполнении из левого предсердия) – Одновременная двухплоскостная визуализация с использованием 3D ВАИТ имеет более высокое временное и пространственное разрешение по сравнению с 3D объемными изображениями. | – Узкая ширина сектора объемных изображений 3D ВСЭ с ограниченным временным и пространственным разрешением – Цветной допплер в 3D ВСЭ имеет низкое пространственное и временное разрешение в современных системах |
| КТ | – Отличное пространственное разрешение – Хорошая визуализация движения окклюдера/стулки, паннуса и кальцификации/утолщения створки независимо от положения клапана – Выявление параклапанных осложнений (дегидратация, абсцесс, псевдоаневризма) – Полезно в контексте нескольких протезированных клапанов, где артефакт может влиять на качество ТЭЭ | – Отсутствие гемодинамической оценки – тяжесть регургитации клапана определяется на основе анатомического дефекта; легкая регургитация или шунт могут быть не обнаружены. – Артефакт укрепления луча, особенно в механических клапанах, может препятствовать выявлению вегетаций, тромба, паннуса, небольшой дегидратации – Нефротоксичные контрастные вещества, необходимые для ангиографии (неконтрастная КТ может быть использована для механического движения клапана) – Полные R-R съемки способствуют увеличению дозы облучения – Временное разрешение может быть ограничено. |
| СМРТ | – Количественное определение пиковой скорости и градиентов (в биопротезированных клапанах), независимо от положения клапана – Количественное определение объема и фракции регургитации в регургитационных клапанах – Определение анатомической площади клапана и патологий створок в биопротезированных клапанах (утолщение, створки) – Выявление больших параклапанных осложнений (например, дегисценция, псевдоаневризма) | – Ограниченное пространственное и временное разрешение – Артефакт от протеза мешает оценке механических клапанов и некоторых биопротезных клапанов – Невозможность обнаружения мелких, высокоподвижных растений – Нерегулярный ритм и фибрилляция предсердий влияют на визуализацию клапанов (потенциал для преодоления с помощью кинескопов в реальном времени) и количественное определение потока крови |
ВАИТ, Отделение интенсивной терапии; МПР, мультипланарная реконструкция.
J. Другие методы оценки ПКС
- Кино-флюороскопия: Кино-флюороскопия была начальной неинвазивной методикой оценки механических клапанов.71 Благодаря рентгеноконтрастной основе и дисковому окклюдеру можно оценить аномальный наклон кольца основы и нарушение подвижности дискового окклюдера. Аномальный наклон опорного кольца свидетельствует о значительной дегидратации клапана и параклапанной регургитации. Нарушение подвижности тарельчатого окклюдера можно оценить путем расчета углов открытия и закрытия, что свидетельствует о дисфункции протезированного клапана.71 Кинефлюороскопия имеет ограниченную ценность при биопротезировании клапанов. Кальцификаты на створках биопротеза могут свидетельствовать о дегенерации клапана, хотя ее гемодинамическое влияние невозможно оценить. С появлением ТЭЭ и все более широким применением КТ сердца кино-флюороскопия теперь является прежде всего дополнительным инструментом для оценки механической подвижности клапанов.
- Катетеризация сердца: Широкая доступность эхокардиографии ограничивает потребность в инвазивной гемодинамической оценке при дисфункции протезированного клапана. Для инвазивного расчета ЭПО клапана используется формула Горлина.72 В идеале следует использовать подход с двумя катетерами для одновременного измерения давления перед и после клапана. Следует избегать пересечения катетером механического клапана для измерения градиента давления из-за потенциальных осложнений.73 При протезированном митральном стенозе давление в легочной артерии (ЛА) для измерения трансмитрального градиента давления часто приводит к переоценке истинного градиента, что приводит к недооценке площади клапана; прямое измерение давления в левом предсердии с помощью транссептальной техники рекомендуется в обстоятельствах, когда необходима инвазивная оценка митрального стеноза.74,75 Инъекция контраста может быть использована для оценки протезированной трансклапанной или параклапанной регургитации и других осложнений, включая свищи и псевдоаневризму.
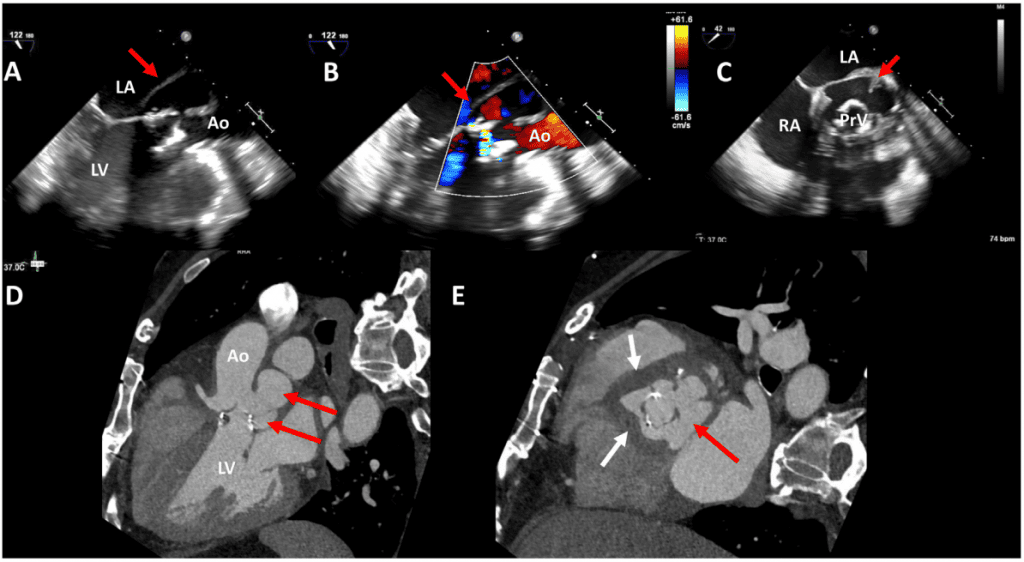
iii. КТ: КТ с электрокардиографическим гейтингом обеспечивает объемную визуализацию протезированного клапана и камер сердца с высоким пространственным разрешением, которую можно комбинировать с визуализацией полного сердечного цикла для обеспечения функциональной и анатомической оценки. У пациентов с аритмиями часто полезной является ретроспективная стробилизация, которой способствует использование реконструкций с абсолютной задержкой (в миллисекундах), а не относительной задержкой (в процентах).76 КТ является наиболее полезной, когда дисфункция клапана обнаружена на ТТЭ, но ее этиология не выяснена или планируется структурное вмешательство. Преимущества и ограничения современных методов визуализации после первичного трансторакального эхокардиографического исследования протезированных клапанов подробно описаны в таблице 2. Относительные преимущества ТТЭ, ТЭЭ, КТ и СМР в оценке структуры, функции и осложнений протезированных клапанов показаны в таблице 3. КТ имеет ограниченную роль в рутинном наблюдении или количественной оценке тяжести гемодинамических нарушений. Неконтрастные изображения можно использовать для оценки механической подвижности клапана, когда можно точно измерить степень открытия створки. Добавление внутривенного контраста позволяет выявить и потенциально дифференцировать тромб и паннус как основную причину любого ограничения движения (Рис. 7).77 Точность КТ с контрастом находится на уровне 3D ТЭЭ для ПКС и может быть выше для механических клапанов аорты и легочных клапанов.77 При биопротезировании клапанов рутинное использование внутривенного контраста является полезным, поскольку позволяет оценить утолщение створок и ограничение движения, а также выявить и локализовать значительные ПВУ.78,79 Следует отметить, что фетр или закладные могут иметь несколько более высокие или сходные единицы Хаунсфилда в качестве контраста, и поэтому могут быть ошибочно восприняты за небольшие ПВУ. Сравнение неконтрастных изображений и корреляция с эхокардиографией являются важными для точной идентификации ПВУ. С другой стороны, небольшие ПВУ могут быть скрыты металлическими артефактами от протезного кольца или дисковых окклюдеров. Кальцификация створок биопротезного клапана является маркером дегенерации, однако в настоящее время не существует количественной или балльной стратегии, которая бы позволила использовать его в диагностических целях.80 КТ также может играть дополнительную роль в диагностике эндокардита протезного клапана, при этом ТЭЭ обеспечивает более точную оценку вегетаций створок и перфораций, тогда как КТ обеспечивает более точную оценку наличия абсцесса корня клапана.81
- КТ: КТ играет вспомогательную роль в оценке функции ПКС (табл. 2). ПКС можно безопасно визуализировать с помощью 1,5- и 3-Тл магнитов, которые являются наиболее распространенными напряженностью поля, используемых в клинической практике.82- 84 Различные методики, используемые в СМР и их применение для оценки протезированных клапанов, подробно описаны на рисунке 8. Наличие стеноза или регургитации протезированного клапана можно сначала распознать на кино-изображениях. Однако кадры с забалансированной устойчивой прецессией (ЗУП) чувствительны к артефактам и менее чувствительны к потоку. Последовательности быстро-градиентного эхо-сигнала могут помочь уменьшить артефакты, связанные с потоком,85,86 а последовательности спин-эхо-сигнала можно использовать для уменьшения артефактов протезированного клапана.83 Степень артефакта связана с типом клапана (например, механический vs биопротез, двустворчатый vs одностворчатый, стентированный vs нестентированный) и может быть незначительным или значительным, причем последний случай делает невозможным диагностическую оценку. При наличии минимальных артефактов кино-изображения могут помочь визуализировать экскурсию створок биопротеза или механических окклюдеров ПКС, позволить провести планиметрию области биопротезного клапана,85,86 и идентифицировать преувеличенное движение протеза в контексте дедисценции клапана.
Фазово-контрастные съемки с использованием плоскостного фазового кодирования могут помочь улучшить визуализацию турбулентности потока через стенозированные протезированные клапаны или как клапанную, так и параклапанную регургитацию. Для оценки стеноза ПКС фазово-контрастные изображения с использованием сквозного фазового кодирования дают возможность прямой количественной оценки пиковых скоростей/градиентов через ПКС.87 Однако это обычно невозможно для механических протезов в митральной и трикуспидальной позициях из-за артефакта и часто является сложной задачей для биопротезированных клапанов из-за кольцевой трансляции. Для оценки клапанной или параклапанной регургитации сквозные фазово-контрастные изображения могут обеспечить количественную оценку общего ударного объема, объема регургитации и фракции регургитации для ПКС в аортальной и легочной позициях (рис. 9, табл. 2).58,88 Для митрального клапана и ТК необходим непрямой подход с использованием комбинации ударного объема желудочков и сквозных фазово-контрастных изображений в аортальной или легочной позициях.58,88 Конкретные методы описаны в соответствующих разделах по клапанам ниже и в предыдущих руководствах ASE.3,58
- Позитронно-эмиссионная томография сердца (ПЭТ): Основная роль ПЭТ сердца заключается в обследовании при подозрении на эндокардит протезированного клапана. ПЭТ с фтордезоксиглюкозой покажет интенсивное увеличение поглощения в прилегающей кольцевой ткани при наличии эндокардита протезированного клапана (рис. 10),89 хотя это следует интерпретировать с осторожностью, поскольку низкое или промежуточное паравальвулярное поглощение является нормальной находкой даже через 1 год после операции.90,91 Фтор-18 может быть полезным для выявления клапанов с риском структурной дегенерации; однако результаты в этой области ограничены, и необходима дальнейшая работа.80
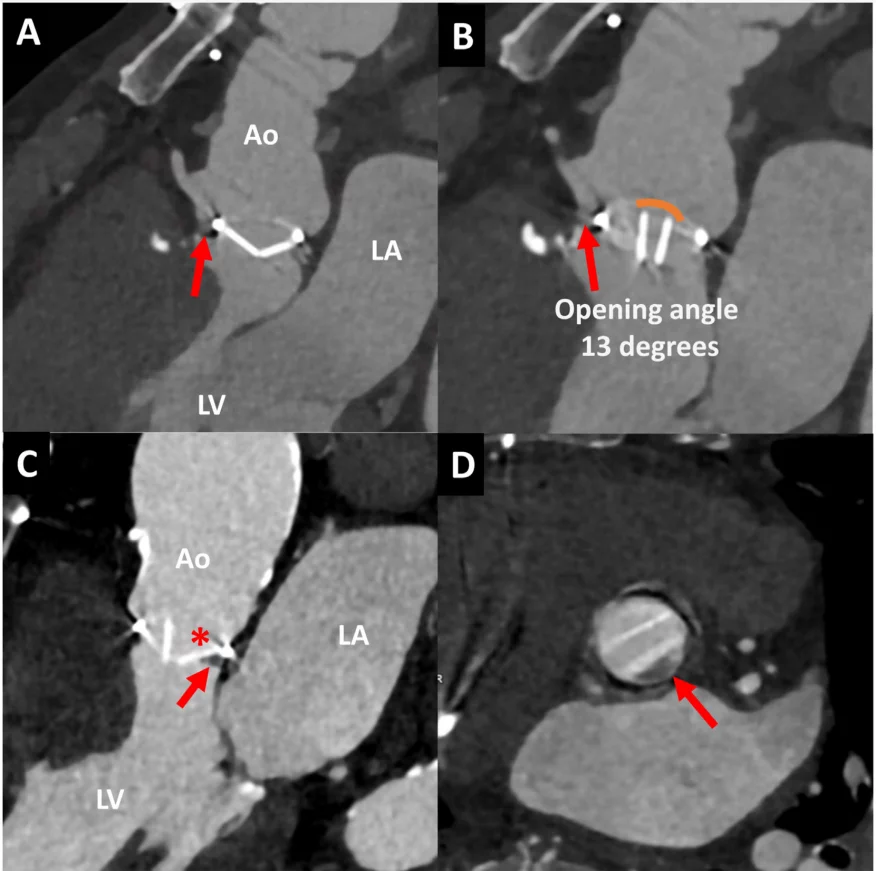
Рисунок 7 Два случая двустворчатых механических аортальных клапанов, изображенных с помощью компьютерной томографической ангиографии сердца. В случае 1 пациента после процедуры Bentall (верхние панели) показан аортальный клапан в диастолу (А) и систолу (В) с нормальными углами закрытия и открытия. Однако имеется передняя паравальвулярная дедисцензия (красные стрелки). В случае 2 (нижние панели) на трехкамерных и короткоосевых изображениях видно застывший диск механического аортального клапана (звездочка), изображенный в систолу (С). Паннус виден над левым коронарным концом (стрелка) на продольных (С) и коротких (D) изображениях, единицы Хаунсфилда 150. Ао – аорта; LA – левое предсердие; LV – левый желудочек.
Ключевые моменты для оценки ПКС 1.
Перед оценкой гемодинамики функции МКК необходимо понимать различные типы МКК. Важным является знание типа и размера клапана у конкретного пациента. 2. Дисфункцию биопротезного клапана можно разделить на следующие категории: СДК, неструктурная дисфункция клапана, тромбоз и эндокардит. 3. Комплексная оценка функции протезированного клапана включает эхокардиографическую визуализацию (2D и 3D), допплерографическую оценку и соответствующую клиническую информацию. 4. Стресс-эхокардиография может быть полезной для оценки симптомов у пациентов с протезированными клапанами. 5. Двумерная ТЭЭ и 3D ТЭЭ остаются основой для интраоперационного и интрапроцедурного руководства при установлении ПКС. 6. КТ и СМР предоставляют дополнительную и ценную информацию к трансторакальной эхокардиографической оценке МКП. КТ особенно полезна для оценки анатомии клапанов, в то время как СМР может обеспечить оценку гемодинамики.
Сердечный магнитный резонанс протезированных клапанов, Гомотрансплантаты и кондуиты 1,5Т и 3Т подходят
| Анатомия и визуализация потока и потока | Количественный поток/скорость | 3D Анатомия | Фиброиды |
| ЗУП – Стандартное кино – Несколько плоскостей – Желудочки и клапаны – Количественная оценка объемов камер – Оценка движения створок/утолщения в биопротезных клапанах и каналах – Клапанная планиметрия – Проблемы с большой сигнальной пустотой ПКС | 2D фазовый контраст – измеряйте поток и скорость – размещайте на 0,25-0,44 мм ниже по течению от ПКС – может быть сложным при МК/ТК из-за сквозной плоскости; косвенная оценка с помощью желудочкового УО и аортального/легочного потока может улучшить оценку в этих ситуациях – 3D фазовый контраст может больше характеризовать эксцентричные стенозирующие струи. | 3D МРА – Оценка аорты и легочных артерий – Оценка размера и стеноза кондуита | Характеристика тканей – Оценка фиброза миокарда – Оценка фиброза/воспаления сосудов |
| Градиентное эхо – Уменьшает эффект потока – Несколько плоскостей – Проблемы с большой пустотой сигнала ПКС | 4D фазовый контраст – Измерение потока и скорости в 3 плоскостях одновременно по всему сердцу и сосудам – Визуализация потока, количественная оценка потока и улучшение гемодинамики – Осуществимо в ПКС с низким уровнем сигнала | ||
| Спин-эхо – Только полные изображения – Несколько плоскостей – Не зависит от пустого сигнала ПКС |
Рисунок 8 Методология магнитного резонанса сердца и соответствующие применения в оценке протезов аортальных клапанов, гомографтов и кондуитов. МРА, магнитно-резонансная ангиография; МК, митральный клапан; ЗУП, сбалансированная устойчивая прецессия; УО, ударный объем.
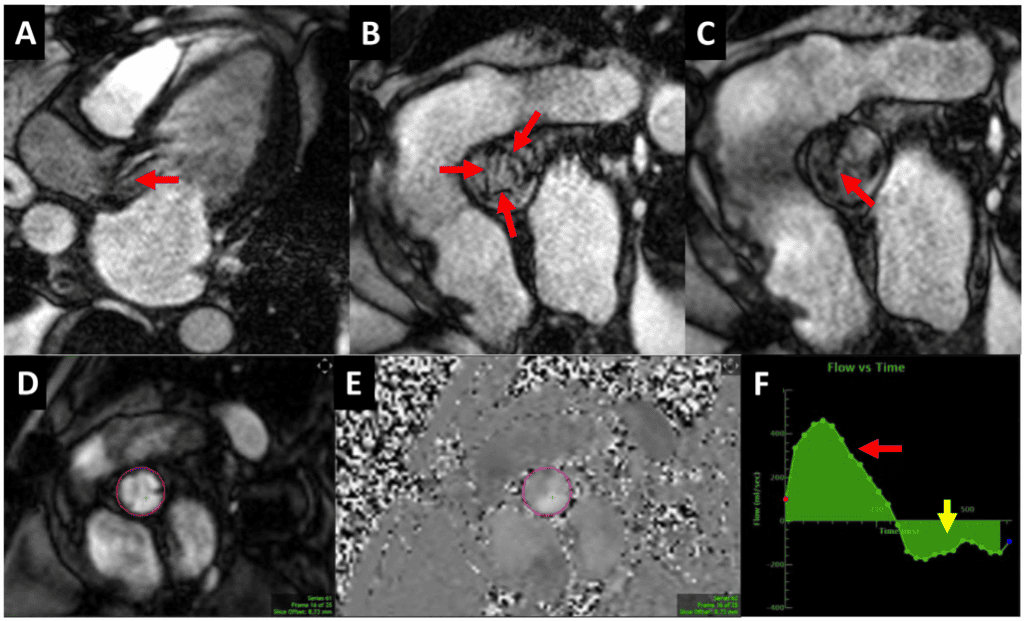
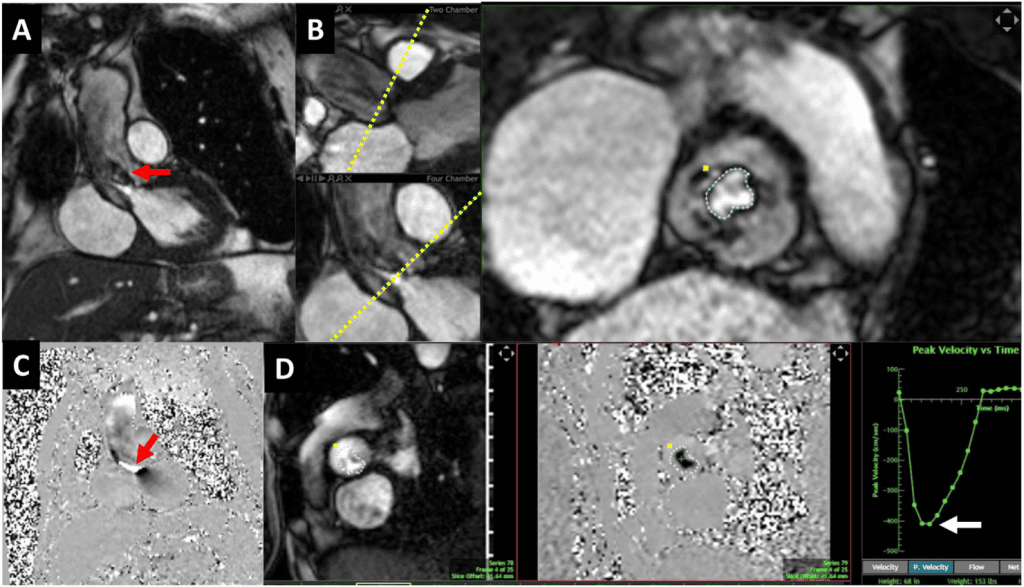
Рисунок 9 Магнитно-резонансная томография сердца пациента с тяжелой биопротезной АР. (А) Трехкамерное продольное изображение на сбалансированной свободной прецессионной кино-СМРТ, демонстрирующее дефазификацию спина в диастолу через клапан, что свидетельствует о турбулентности вследствие АР (красная стрелка).
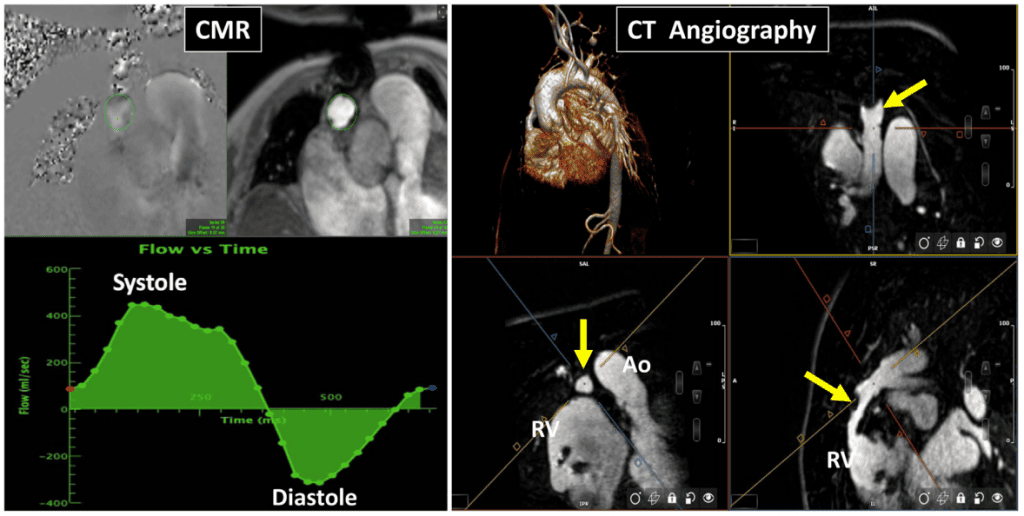
(B, C) Короткоосевые изображения биопротезного клапана в систолу, демонстрирующие нормальную систолическую экскурсию (B, три стрелки) и деформацию створки в диастолу (C, стрелка). (D-F) Магнитно- и фазово-контрастная последовательность CМР с областью интереса на уровне синотубулярного соединения. Кривая “поток против времени” (F) показывает прямой (красная стрелка) и обратный (желтая стрелка) поток для прямой оценки АР (объем регургитации = 55 мл).
Рисунок 10 Пример эндокардита с поражением механического аортального клапана и восходящего аортального трансплантата (G), обнаруженного при ПЭТ с фтордезоксиглюкозой (ФДГ). Пациент обратился с жалобами на недомогание и одышку. С помощью ТТЭ было выявлено пролабирование трехстворчатого клапана и выраженную АР. ФДГ ПЭТ, выполненная после длительного голодания, показала интенсивное поглощение вокруг аортального клапана в области предполагаемого абсцесса (А, стрелки) и, что важно, также в аортальном трансплантате (В, верхняя стрелка). Компьютерная томографическая ангиография подтвердила возможный абсцесс перед аортальным клапаном (С, стрелка) и расслоение протеза аортального клапана (PrAV) (ПрАК) с 10-мм ПВУ (D, стрелки).
ІІ. ОЦЕНКА ПРОТЕЗОВ АОРТАЛЬНЫХ КЛАПАНОВ
A. Эхокардиографическая и допплерографическая оценка функции протезированного аортального клапана
- Эхокардиографическое и допплерографическое исследование: Применение инструментов визуализации для оценки функции протезированного аортального клапана следует начинать с определения размера и типа имплантированного протезированного клапана с последующим проведением комплексного эхокардиографического исследования (табл. 4). Хотя хирургические типы клапанов и методики остаются стабильными в течение многих лет, внедрение бесшовных клапанов, а также ТИАК в нативных клапанах и в дегенерированных биопротезах увеличило объем и сложность оценки протезированных клапанов. Оценка функции протезированного аортального клапана
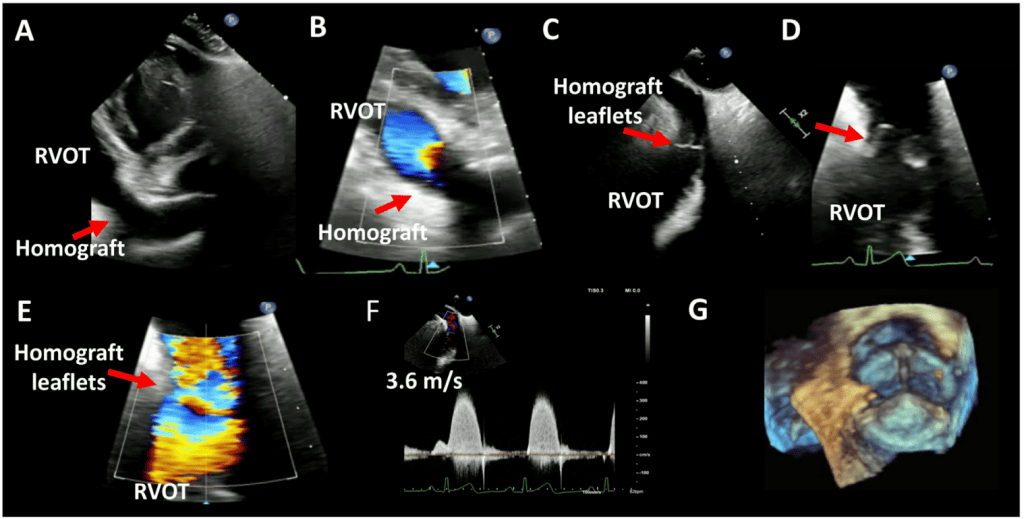
- TTЭ: TTЭ является начальным методом визуализации, который используется для оценки пациентов с ХЗАК или ТИАК. Параметры для оценки ПКС в аортальной позиции подробно описаны в таблице 4. Стандартные виды, необходимые для оценки функции клапана, были обобщены ранее (Рис. 11).1,3 Хотя оценка биопротезов ХЗАК и ТИАК с помощью TTЭ является сходной, особое внимание следует уделять чрескожным клапанам. Полная оценка чрескожных клапанов должна включать позицию клапана в корне аорты, короткоосевую форму клапана, прилегание стента клапана к родной ткани аорты и наличие повреждения кольца аорты или дефектов межжелудочковой перегородки. Кроме того, для выявления регургитации клапана необходимо провести плоскость визуализации через клапан, поскольку струи регургитации не могут быть адекватно обнаружены в одной плоскости клапана (см. недавнее руководство для более подробной информации3 ). Низкое развертывание ТИАК-протеза может ограничить анкеровку и привести к выпячиванию нативных створок клапана над аортальным краем каркаса. Это повышает риск задержки миграции клапана в ВТЛЖ или левый желудочек. В дополнение к регургитации клапана, низкое развертывание может влиять на функцию митрального клапана, вызывая МР. Неполное раскрытие клапана ТИАК из-за кальция может привести к параклапанной и клапанной регургитации и более высокому градиенту клапана.3
- ТЭЭ: ТЭЭ играет важную роль в оценке функции протезированного аортального клапана.3,92 Одним из ограничений трансторакальной эхокардиографической оценки протезированного аортального клапана является реверберация и затенение, связанные с аортальным протезом, что делает невозможным полное исследование заднего кольца и корня (Рисунок 12). И наоборот, хотя ТЭЭ позволяет прекрасно визуализировать задний корень аорты, оценка переднего корня может быть ограничена из-за того же артефакта. Эту проблему можно решить путем регулирования угла визуализации или глубины введения чреспищеводного датчика, чтобы “сместить” артефакт и позволить частичную визуализацию других сегментов протезированного клапана. Наличие механического митрального клапана также влияет на оценку ВТЛЖ с помощью ТЭЭ. Таким образом, трансгастральные изображения играют ценную роль у пациентов с протезированными аортальными клапанами, позволяя оценить движение створок протезированного клапана, градиент и регургитацию. Однако следует помнить, что допплеровская ангуляция при трансгастральном доступе может быть неоптимальной. Трехмерная транспищеводная визуализация створок протезированного аортального клапана или механического окклюдера может быть сложной. Ориентация протезированного аортального клапана коаксиально к лучу инсоляции может привести к выпадению створок тканевых протезов, особенно если створки тонкие и некальцинированные. И наоборот, механические и тканевые клапаны, которые сильно кальцинированы, также представляют проблему из-за артефактов, вызванных затуханием и/или реверберацией от кальция створок, дисков, стоек клапана или кольцевого отверстия. По этим причинам точное движение и экскурсия металлических створок может быть нечетко очерченным; если это клинически необходимо, например, при обструкции клапана или НПП, рекомендуется проводить рентгенологическое исследование (КТ или рентгеноскопию; табл. 2 и 3). Детали по получению и представлению 3D-визуализации аортального клапана приведены в предварительных рекомендациях Европейской ассоциации эхокардиографии и ASE.26
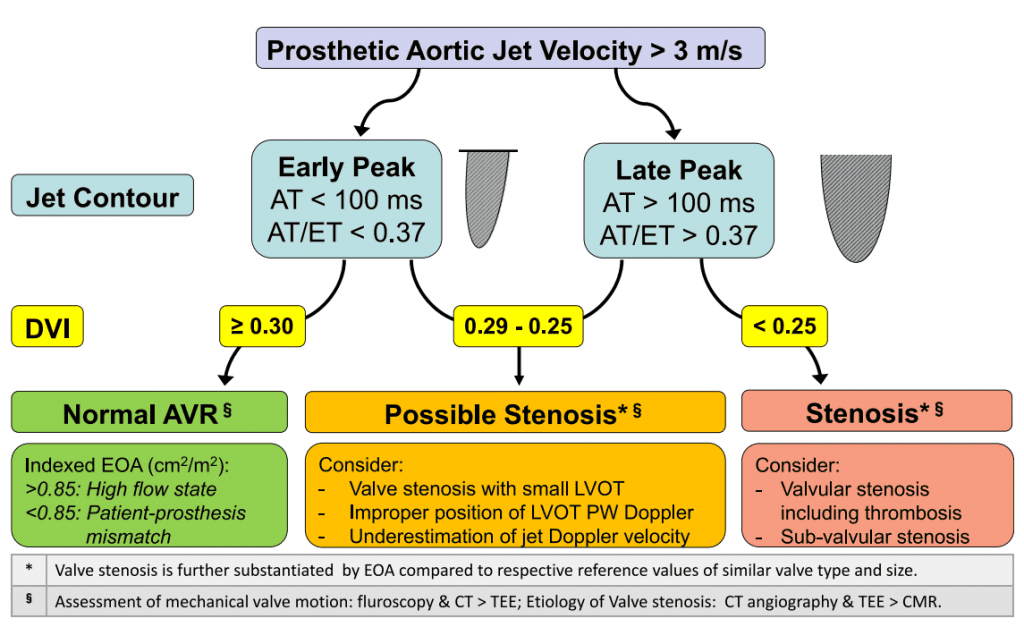
iii. Допплеровская эхокардиография: Оценка функции протезированного аортального клапана включает пиковую скорость через клапан, средний градиент и ЭПО, в дополнение к другим критериям, таким как ДИС, контур струи и время ускорения (таблицы 4 и 5, рисунки 11 и 12). Допплеровский алгоритм, который помогает облегчить оценку функции протезированного аортального клапана у пациентов с повышенной максимальной скоростью через протез, показан на рисунке 13. Как и при заболевании нативного аортального клапана, допплеровская инсонация должна быть получена из всех возможных окон. Также следует использовать небольшой невизуализационный датчик для лучшего доступа между реберными промежутками и для оптимального угла наклона надпредсердной вырезки. Рекомендуемые критерии оценки возможного или значительного стеноза, СДК и НПП приведены в таблицах 5-7 соответственно. Рекомендации по СДК несколько отличаются от других опубликованных критериев.13,94,95 Диагноз стеноза протезированного клапана не должен основываться на измерении одного параметра, поскольку колебания кровотока могут влиять на допплеровские измерения.13 Диагноз должен включать оценки двух или более серийных эхокардиограмм, если они доступны. Базовые постпроцедурные эхокардиограммы имеют решающее значение для установления наличия НПП после имплантации и для сравнения работы клапана с течением времени. Следует исключить другие причины повышенных допплеровских градиентов, такие как состояния высокого потока, надклапанную обструкцию и восстановление давления. Интеграция данных допплеровской гемодинамики со специальной визуализацией для визуализации створок протеза, часто с помощью ТЭЭ или КТ (особенно в механических клапанах [Таблица 3], как описано ниже), является важной, поскольку это улучшает диагностические показатели и часто определяет конкретную этиологию повышенного трансклапанного градиента.96 Обратите внимание, что у пациентов с плохой функцией ЛЖ или повышенным системным артериальным давлением высокие градиенты могут отсутствовать, несмотря на значительный створчатый стеноз клапанов.
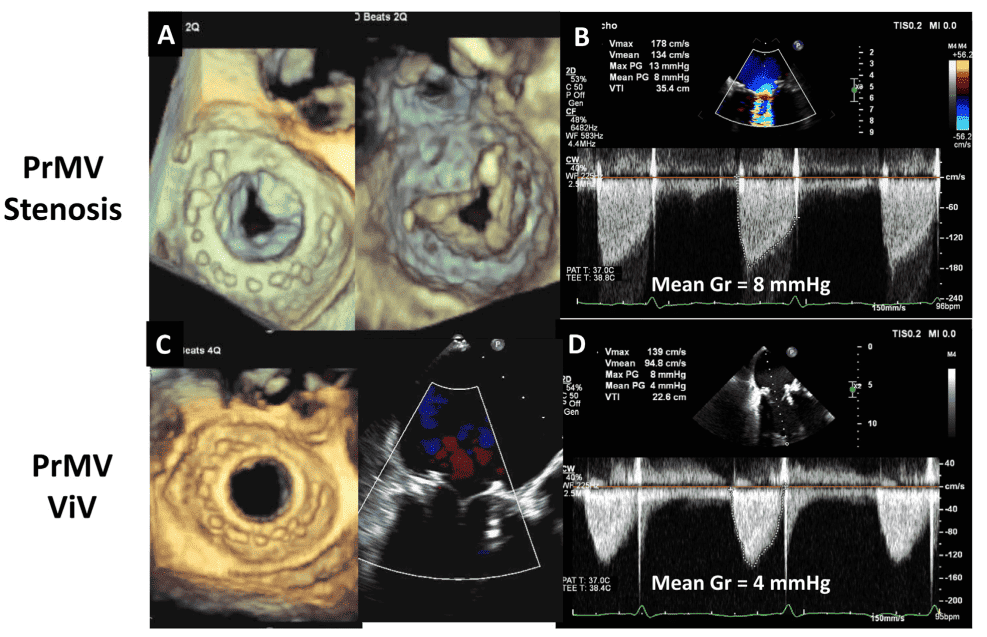
- Соображения относительно ТИАК и КвК: При ТИАК в нативных клапанах ускорение потока внутри стента происходит в двух местах: под клапаном и на уровне створок.97 Таким образом, измерение диаметра и потока ВТЛЖ следует проводить непосредственно проксимальнее стента, чтобы предотвратить переоценку ЭПО из-за ускорения потока внутри стента (рис. 4). Рекомендуется использовать одно высокозависимое от потока измерение (например, пиковая скорость, средний градиент) и одно менее зависимое от потока измерение (например, ЭПО) для оценки стеноза протезированного аортального клапана.13 Исследования продемонстрировали, что по сравнению с пациентами с ХЗАК пациенты с ТИАК имеют сходные или более низкие градиенты клапана, более высокий индекс ЭПО и более низкие показатели НПП.98,99 Однако, хотя процент пациентов с умеренной или тяжелой АР был сходным между клапанами ХЗАК и ТИАК третьего поколения, распространенность постпроцедурной легкой АР выше у пациентов с ТИАК.99 В случае ТИАК КвК на эхокардиографические параметры влияют тип и размер как первично имплантированного хирургического или ТИАК клапана, так и второго имплантированного клапана.100,101 В таблице А3 Приложения обобщены результаты эхокардиографических исследований после КвК через 1 год после операции. Эхокардиографические результаты на основе первичного имплантированного клапана и вторичного ТИАК-клапана в литературе ограничены. В общем, надкольцевые клапаны по сравнению с внутрикольцевыми имеют большую ЭПО, более низкий средний градиент и меньшую частоту умеренной или большей АР. Повышенные эхокардиографические градиенты КвК (средний градиент > 20 мм рт.ст.) обнаруживают у 28% пациентов после КТК. Клинически значимые повышенные градиенты должны быть подтверждены катетеризацией сердца, поскольку эхокардиографические градиенты могут быть выше по сравнению с инвазивными измерениями из-за явления восстановления давления и ограничения упрощенного уравнения Бернулли.102-104 Степень дискордантности выше при использовании саморасширяющихся клапанов, чем при использовании баллонных клапанов.104-106 Значительная НПП также наблюдалась после КвК, с умеренной или большей НПП у 60% пациентов и тяжелой НПП у 25%.102 Однако наличие умеренной или большей НПП не влияет на 1- или 3-летнюю смертность или клинические результаты.102,107,108. Наконец, долгосрочные исследования показали, что эхокардиографические результаты остаются стабильными до 5 лет после процедуры, а частота ухудшения состояния клапана составляет примерно 6,6% через 5 лет.109
Таблица 4 Эхокардиографическая оценка протезированных аортальных клапанов
| Параметр | |
| Допплер-эхокардиография аортального клапана | Пиковая скорость/градиент пиковой скорости/градиент |
| Средний градиент Контур скорости струи; время ускорения ДИС (ДИС = ИСВ ВТЛЖ/ИСВ ПрАК) ЭПО Наличие, локализация и тяжесть регургитации | |
| Соответствующие камеры сердца | Размер, функция и гипертрофия ЛЖ |
| Предварительные послеоперационные исследования, при наличии | Сравнение вышеупомянутых параметров является особенно полезным при подозрении на дисфункцию протезированного клапана |
ИСВ ПрАК, ИСВ через протез аортального клапана.
Рис. 11 Допплер-эхокардиографические данные при нормальном и стенозированном механическом аортальном клапане, показывающие разницу в скорости и ее контуре, а также время ускорения (AT). Нормальный клапан: Диаметр ВТЛЖ 2 см, ИСВ ВТЛЖ 19 см, ИСВ ПрАК 31 см, ДИС 0,6 и ЭПО 1,92 см2 . Рассчитанное соотношение AT ко времени выброса (ВВ) в норме составляет 0,24. Стенозирующий клапан: Диаметр ВТЛЖ 2 см, ИСВ ВТЛЖ 24 см, ИСВ ПрАК 98 см, ДИС 0,24, ЭПО 0,77 см2 , рассчитанное соотношение AT/ЧВ 0,4. ПрАК, протез аортального клапана.
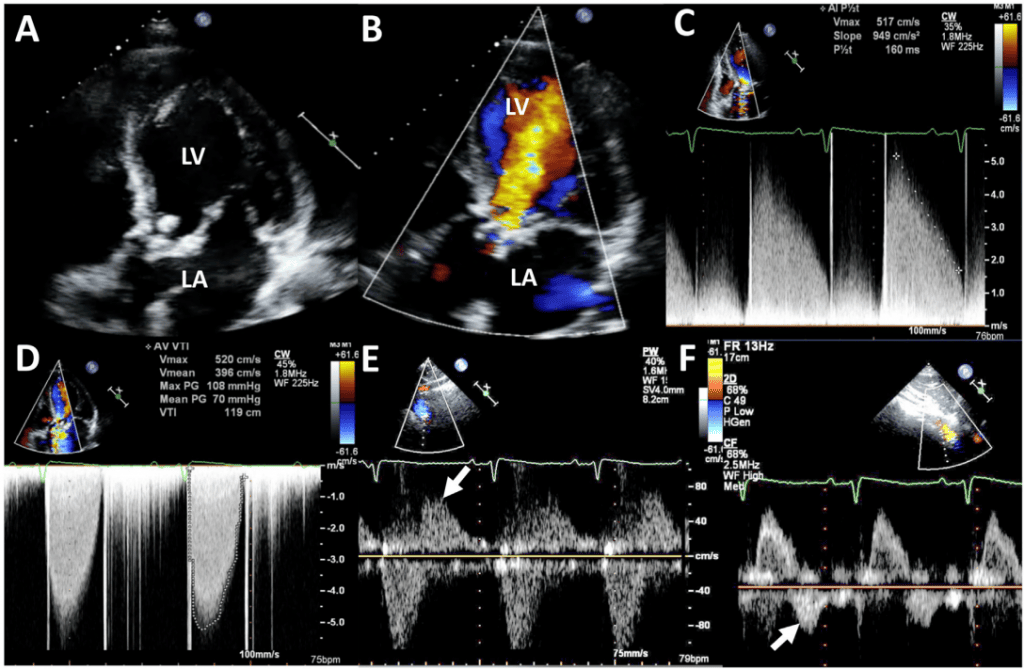
B. Эхокардиографическая и допплеровская оценка регургитации протезированного аортального клапана
- ТТЭ и ТЭЭ: ТТЭ используется для выявления как протезированной аортальной внутриклапанной, так и параклапанной регургитации. В дополнение к оценке локализации и механизма АР, ТТЭ может выявить связанные с ней осложнения, такие как эндокардит, образование абсцессов, образований и тромбов (Рис. 14). Для того, чтобы убедиться, что все струи идентифицированы, часто необходимы парастернальные длинно- и короткоосевые сканирования. Для определения происхождения струи могут потребоваться внеосевые изображения. Из-за реверберации и затенения от протеза задняя паравальвулярная АР может быть скрыта при ТТЭ, тогда как передняя регургитация может быть замаскирована при ТЭЭ.3 Таким образом, ТТЭ и ТЭЭ дополняют друг друга в этом отношении для выявления всех локализаций паравальвулярной АР. Наконец, технические ограничения и артефакты, связанные с протезами, при проведении ТТЭ могут ограничить оценку структурных аномалий, связанных с механизмом развития ЛА, что предопределяет необходимость использования других методов визуализации, таких как ТЭЭ или КТ (табл. 2 и 3, рис. 15).
| Норма | Возможен стеноз | Указывает на значительный стеноз | |
| Подходит для всех протезированных аортальных клапанов | |||
| Контур скорости реактивной струи * * | Треугольный, ранний пик | Треугольный до промежуточного | Округлый, симметричный |
| Время разгона, мсек* | <80 | 80-100 | >100 |
| Отношение времени разгона к времени выброса ЛЖ | <0.32 | 0.32-0.37 | >0.37 |
| Пиковая скорость, м/с†‡ | <3 | 3-4 | >4 |
| Конкретные соображения относительно AVR | |||
| ХЗАК | |||
| Средний градиент, мм рт. ст.* | <20 | 20-34 | <35 |
| ДИС§{ | >0.35 | 0.25-0.35 | ≤0.25 |
| ЭПО§ | Референтное ЕПО 6 1 СВ | На 1 СВ меньше референтной ЭПО | На 2 СВ меньше, чем референтная ЭПО |
| ТИАК (изменение от базового уровня) | |||
| Средний градиент† | Изменение <10 мм рт.ст. от начального уровня†. | Повышение на 10-19 мм рт.ст. от исходного уровня | Повышение ≥20 мм рт.ст. от начального уровня |
| ДИС§{ | Изменение <0,1 или 20% от базового уровняk | Уменьшение на 0,1-0,19 или 20%-39% от базового уровня | Уменьшение на ≥0,2 или ≥40% от базового уровняk |
| ЭПО§ | Изменение <0,3 см2 или 25% от начального уровня | Уменьшение на 0,3-0,59 см2 или 25%-49% от базового уровня | Уменьшение ≥0,6 см2 или ≥50% от базового уровня |
ЗАК, замена аортального клапана. Значительный стеноз должен соответствовать по крайней мере одному потокозависимому параметру (то есть скорости и среднему градиенту) и одному потоконезависимому параметру (то есть ЭПО или ДИС). *На это может влиять функция ЛЖ и частота сердечных сокращений. † Зависит от потока. Действителен при нормальном ударном объеме (50-90 мл) и скорости потока (200-300 мл). § Независим от потока. { ДИС рассчитывается с использованием ИСВ, как в таблице 4. k Базовый уровень определяется как ТТЭ, выполняемый при стабильных гемодинамических условиях.
Рисунок 13 Алгоритм начальной оценки повышенной пиковой скорости аортальной струи протеза, включающий ДИС, контур потока, а также показатели времени ускорения (ЧП) и отношение ЧП ко времени выброса (ВВ). Неправильный объем ИХ допплеровской пробы влияет на расчеты ДИС и ЭПО: слишком близкое расположение к клапану увеличивает ДИС и ЭПО, тогда как слишком далекое (апикальное) – уменьшает их. AVR, замена аортального клапана.
- Допплер-эхокардиография: Цветная допплеровская оценка струи АР требует визуализации конвергенции потока, ВК (vena contracta) и проксимального продолжения струи в ВТЛЖ и левый желудочек. Ограничениями этого метода являются акустическая реверберация и затенение от протеза, которые могут ухудшить визуализацию участков конвергенции потока и ВТС или оценку ширины струи в ВТЛЖ. В этой ситуации ширину, площадь и окружность ВК можно оценить с помощью тщательно полученного короткоосевого изображения.3 Подобно нативным клапанам, измерение ширины эксцентричной струи в выходном тракте может переоценить выраженность регургитации. Кроме того, захват струи регургитатора в ВТЛЖ может привести к переоценке из-за быстрого расширения струи. И наоборот, пристеночная аортальная паравертебральная струя может привести к недооценке из-за невыразительной цветной допплеровской площади струи.
Полуколичественные и количественные спектральные допплеровские методы оценки тяжести АР не зависят от протезированного аортального клапана. Наличие ППД <200 мс или реверсии голодиастолического потока в брюшной аорте свидетельствует о наличии выраженной регургитации (рис. 14). Количественные параметры, такие как объем регургитации, рассчитываются с помощью 2D или 3D методов. Заметьте, что для расчета ударного объема следует быть осторожным, чтобы не размещать объем образца слишком близко к протезу, что может привести к завышению ударного объема из-за проксимального ускорения. Методы количественного определения объема и фракции регургитации после ХЗАК и ТИАК описаны ранее.1,3
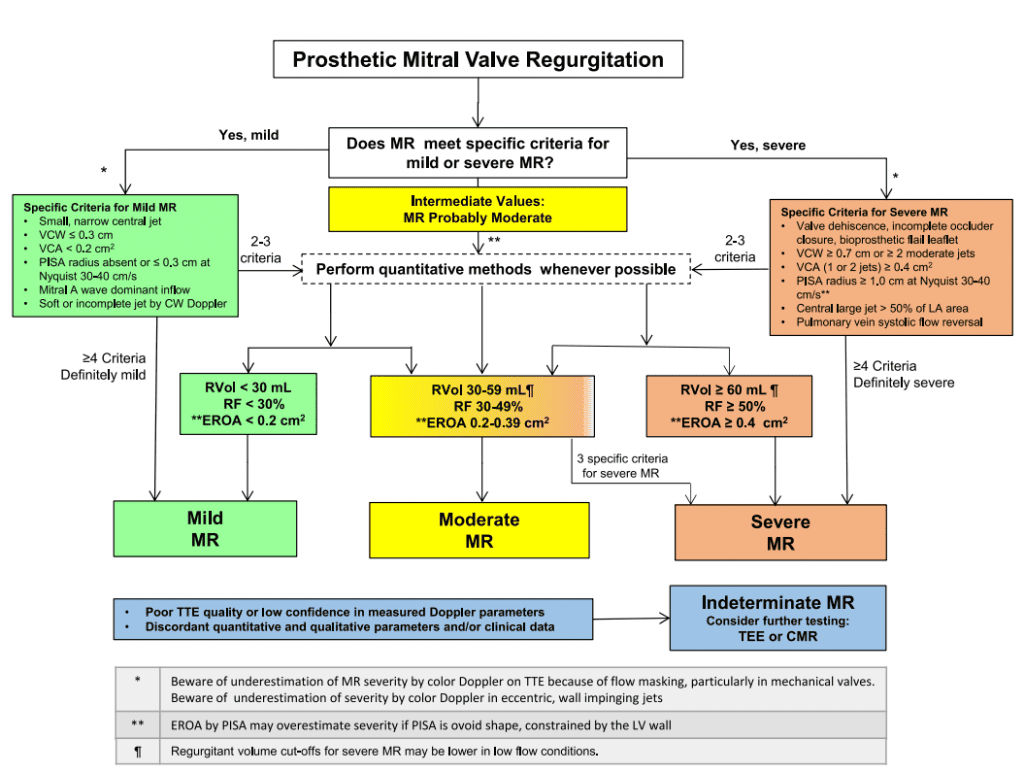
Классификация тяжести внутри- и параклапанной протезной АР подобна предложенной для нативных клапанов, поскольку оценка требует интеграции качественных и полуколичественных параметров (табл. 8).3,58 Однако определение тяжести протезной клапанной АР может быть сложнее из-за наличия комбинированных клапанных и параклапанных струй регургитации, множественных струй регургитации или эксцентричных струй. На рисунке 16 показан предложенный алгоритм оценки тяжести протезированной клапанной АР с помощью эхокардиографии, подобный недавно предложенному алгоритму.3 Как правило, если качественные и полукачественные параметры соответствуют легкой форме регургитации, то оценка считается завершенной. Если есть расхождение или несоответствие между параметрами, то следует выяснить причины, связанные с качеством изображения, техническими и физиологическими факторами. Для пациентов, у которых невозможно определить консенсусную градацию и есть необходимость идентифицировать механизм и/или количественно оценить тяжесть АР, скорее всего, нужно провести ТЭЭ, СМРТ или КТ. Каждая из этих методик имеет свои преимущества и ограничения (табл. 2 и 3). Обратите внимание, что были опубликованы рекомендации ASE, которые описывают оценку АР после чрескожной замены аортального клапана.3
Таблица 6 Гемодинамические критерии структурного износа клапана* † † Гемодинамические критерии структурного износа клапана
| Возможен структурный износ клапана | Значительный структурный износ клапана |
| Увеличение среднего трансклапанного градиента на 10 мм рт.ст., что приводит к среднему градиенту на 20 мм рт.ст. с сопутствующим уменьшением ЭПО на 0,3 см2 или 25% и / или уменьшением ДИС на 0,1 или 20% по сравнению с базовой оценкой (1-3 месяца) после процедуры | Увеличение среднего градиента на 20 мм рт.ст., что приводит к среднему градиенту на 30 мм рт.ст. с сопутствующим уменьшением ЭПО на 0,6 см2 или 50% и/или уменьшением ДИС на 0,2 или 40% по сравнению с базовой оценкой (1-3 месяца) после процедуры |
| Новое появление или увеличение по крайней мере одной степени интрапротезной АР, что приводит к умеренной или большей АР | Новое появление или увеличение по меньшей мере двух степеней интрапротезной АР, что приводит к умеренной или от большей до тяжелой АР |
При наличии сопутствующего стеноза и регургитации критерии значительного структурного поражения клапана могут присутствовать при более низких пороговых значениях. *Критерии предполагают стабильную функцию ЛЖ и артериальное давление. Морфологические неблагоприятные изменения протеза должны быть очевидными
C. Роль КТ в оценке протезирования аортальных клапанов
КТ является распространенным вспомогательным методом визуализации у пациентов с дисфункцией ПМК, заподозренной во время эхокардиографии. КТ позволяет оценить морфологию клапана, структурные аномалии, стенозированные отверстия, регургитационные отверстия, осложнения сшивного кольца и параклапанные осложнения. Проспективный электрокардиографический запуск является адекватным для оценки морфологии, но ретроспективный строб необходим для динамической 3D-оценки клапана и функциональной количественной оценки. Неусиленное исследование полезно для выявления кальцификатов и послеоперационных изменений, тогда как отсроченная фаза (60-90 сек) помогает оценить полости абсцесса с усилением краев и тромбом.
КТ стала полезным дополнительным методом визуализации при дальнейшей оценке транскатетерных сердечных клапанов.110 Недавнее применение КТ (подобно ее использованию при первичной ТИАК) – это планирование имплантации аортального клапана КвК. КТ имеет преимущество в предоперационном планировании, поскольку на нее меньше влияют металлоиндуцированные артефакты. Смещение нативных створок аортального клапана во время установки транскатетерного клапана связано с минимальным, но важным риском дальнейшей окклюзии устья коронарных артерий, частота которого составляет от 0,6% до 4,1%.111 Пациенты с большими и сильно кальцинированными створками клапана и коротким расстоянием между кольцевой плоскостью и устьем коронарных артерий подвергаются большему риску. Следовательно, важно сообщать о расстоянии между остями коронарных артерий и кольцевой плоскостью.112
Таблица 7 Критерии допплеровских параметров аортального и митрального клапанов НПП
| Норма | Умеренные | Тяжелые | |
| Аортальное ЭПО* | >0,85 см2 /м2, если ИМТ < 30 кг/м2 >0,70 см2 /м2, если ИМТ ≥ 30 кг/м2 | 0,85-0,66 см2/м2, если ИМТ < 30 кг/м2 0,70-0,56 см2/м2, если ИМТ ≥ 30 кг/м2 | ≤0,65 см2/м2, если ИМТ < 30 кг/м2 ≤0,55 см2/м2, если ИМТ ≥ 30 кг/м2 |
| Митральное ЭПО* | >1,2 см2 /м2, если ИМТ < 30 кг/м2 >1,0 см2 /м2, если ИМТ ≥ 30 кг/м2 | 1,2-0,91 см2/м2, если ИМТ < 30 кг/м2 1,0-0,76 см2/м2, если ИМТ ≥ 30 кг/м2 | ≤0,90 см2 /м2, если ИМТ < 30 кг/м2 ≤0,75 см2 /м2, если ИМТ ≥ 30 кг/м2 |
ИМТ – индекс массы тела. *Структура и движение клапанов в норме; измеренная ЭПО находится в пределах 1 СО от референсной ЭПО.
Рисунок 14 Пример сочетанной АГ и стеноза у пациента с тканевым протезом аортального клапана (АК). (А) ТТЭ в апикальном пятикамерном изображении во время диастолы демонстрирует вегетацию на тканевом протезе АК.
(В) Соответствующее цветное допплеровское изображение демонстрирует выраженную регургитацию. (С) На НВ допплеровском изображении PHT составляет <200 мс, что соответствует выраженной регургитации. (D) Виден высокий систолический градиент через клапан. (E) ИХ допплеровское изображение проксимального отдела нисходящей грудной аорты демонстрирует реверсию потока (стрелка). (F) Реверсия потока также наблюдается в брюшной аорте (стрелка). ЛП – левое предсердие; ЛЖ – левый желудочек; Max – максимальная; PG – градиент давления; Vmax – максимальная скорость; Vmean – средняя скорость.
Роль КТ в оценке осложнений заключается в следующем:
- Стеноз: КТ может помочь определить, существуют ли патологические причины повышенного градиента давления на клапане. Их может быть трудно распознать на TTЭ и ТЭЭ, особенно в механических клапанах. Возможные причины включают стеноз вследствие структурной недостаточности, кальциноза, обструкции паннусом или тромбом, или гипоаттенуированное утолщение створки с ограничением или без ограничения движения (Рисунки 7, 15 и 17).
- Регургитация: Структурная несостоятельность биопротезного клапана является самой распространенной причиной центральной патологической регургитации и часто возникает близко к спайке в месте разрыва створки. КТ позволяет идентифицировать и количественно оценить достаточно большое отверстие для регургитации, а также оценить его вторичные последствия. Измерение площади регургитационного и стенозированного отверстия с помощью КТ показывает хорошую точность, сравнимую с точностью ТТЭ.113,114 Компьютерная томографическая ангиография также может выявить значительную дегидратацию клапана и такие осложнения, как образование псевдоаневризмы (Рис. 15). В таблице 9 описана потенциальная роль КТ в оценке различных осложнений ПКС, приводящих к стенозу, регургитации или к обоим этим явлениям. Сравнительные преимущества, ограничения и сильные стороны КТ по отношению к ТТЭ и СМР подробно описаны в таблицах 2 и 3.
D. Роль КТ в оценке протезирования аортальных клапанов
- Стеноз протезированного аортального клапана
- Анатомический участок клапана: Используя стопку тонких срезов (4-5 мм), перпендикулярных к протезированному клапану в двух ортогональных плоскостях (с использованием перекрестных линий), можно измерить анатомическую площадь клапана, отслеживая наибольшее систолическое отверстие (Рис. 18).124 Правильное выравнивание на кончиках створок имеет решающее значение для воспроизводимости и точности измерения. Это можно сделать на биопротезных клапанах (при отсутствии металлических распорок), но металлический артефакт от механических клапанов препятствует оценке движения створок.85 Исследования in vivo и in vitro показали сильную согласованность между СМР и эхокардиографией, с более высокой меж- и внутринаблюдательной вариабельностью СМРТ.125 Одно исследование, в котором оценивали 65 биопротезированных аортальных клапанов, показало сильную корреляцию между анатомической площадью, определенной с помощью СМРТ, и эхокардиографическими измерениями эффективной площади (средние расхождения 0,02 6 0,24 см2 при ТТЭ и 0,05 6 0,15 см2 при ТЭЭ).85 Важно знать, что анатомическая площадь клапана на 10-20% больше эффективной площади клапана из-за явления сужения потока.2
- Фазово-контрастная визуализация: При стенозе турбулентность потока создает пустоты сигнала из-за дефазировки протонов.126,127 СМР имеет преимущество в оценке потока в плоскостной фазе (как допплеровская эхокардиография) и в сквозной фазе (перпендикулярно к максимальной скорости через протезный клапан). С помощью двух ортогональных изображений с фазовым кодированием в плоскости (полученных из кинетического трехкамерного изображения и изображения коронарного отдела аорты, чтобы увидеть место смещения струи) создается сквозное изображение перпендикулярно струе аортального стеноза, и можно измерить самую высокую скорость пикселя (Рисунок 18). Новая ЭПО, полученная с помощью СМРТ, была сравнима с площадью клапана, полученной с помощью допплеровской эхокардиографии в нативных и протезированных аортальных клапанах.128,129 Используя фазово-контрастную визуализацию для оценки объема трансклапанного прямого потока и деления его на ИСВ для получения фазово-контрастной эффективной площади регургитационного отверстия (ЭПР), это измерение дало благоприятные результаты и показало отличную согласованность с клинической классификацией степени тяжести стеноза протезированного аортального клапана.129 Новая методика, использующая трехмерное картирование потока с временным разрешением (четырехмерный [4D] поток), может визуализировать турбулентный поток с картиной вихреобразования и измерить оценку перепада давления в трехмерной плоскости. Эта методика не является широко распространенной и занимает много времени.125,130 В целом, поскольку данные в СМР усредняются за несколько сердечных циклов, аритмии и быстрый нерегулярный сердечный ритм могут вносить погрешности в измерения. Из-за ограниченного временного разрешения СМР (из-за эффекта частичного объема при высоких скоростях струи) наблюдается недооценка скоростей при использовании фазово-контрастных последовательностей СМР по сравнению с допплеровской эхокардиографией.124 Неблагоприятные сердечные эффекты хронической перегрузки ЛЖ давлением (гипертрофия ЛЖ, заместительный фиброз) могут быть точно оценены с помощью СМРТ. Очаговый заместительный или инфарктоподобный фиброз (обнаруженный с помощью позднего гадолиниевого усиления на СМРТ) наблюдается у 30-50% пациентов с аортальным стенозом и, как было показано, прогнозирует худший периоперационный риск и выживаемость, связанную с сердечно-сосудистыми заболеваниями, у пациентов, проходящих ТИАК или ХЗАК.131,132
- Регургитация протезированного аортального клапана: СМР имеет преимущество над эхокардиографией в предоставлении абсолютных объемов и фракций регургитации независимо от количества струй регургитации, эксцентриситета или типа протезированного клапана.3,58 Кроме того, у пациентов с аневризмами и/или аортопатией можно одновременно оценить анатомию корня аорты и аорты. Последовательности Cine ЗУП вместе с фазово-контрастной визуализацией могут помочь разграничить транс- или паравальвулярные регургитационные струи, первые из которых вызывают дефазировку спина. В зависимости от ферромагнитного материала хирургической стойки или рамы, могут возникать артефакты, препятствующие точному определению происхождения регургитации.
- Фазово-контрастная визуализация: Фазово-контрастная визуализация в плоскости может помочь разграничить транс- или паравальвулярную регургитацию, используя трехкамерные и коронарные изображения аорты. Используя сквозную фазово-контрастную визуализацию перпендикулярно к стенке аорты непосредственно над протезированным клапаном, можно непосредственно измерить как антеградный, так и ретроградный поток. Затем можно рассчитать объем регургитации и, следовательно, фракцию (объем регургитации/прямой объем) (Рис. 9).126,133 Можно использовать альтернативный метод, использующий разницу между прямым аортальным и чистым легочным потоком.133 Кроме того, наличие голодиастолического реверса потока в нисходящей аорте продемонстрировало отличную чувствительность и специфичность для выявления тяжелой регургитации.134,135 Исследования, в которых сравнивали эхокардиографию и КДК в оценке паравертебральной регургитации, дали различные результаты, с недооценкой объемов регургитации при использовании ТТЭ и ТЭЭ.88 В недавнем мета-анализе, в котором оценивали АР после ТИАК, было обнаружено значительное расхождение между ТТЭ и СМРТ, однако ТТЭ смогла отличить умеренную или тяжелую АР от легкой или отсутствующей.136 В этих исследованиях использовали различные значения отсечения для СМРТ, что могло повлечь значительные расхождения между обоими методами визуализации. Ограничения фазово-контрастного метода включают артефакт, связанный с металлом, или неламинарный поток, создающий пустоты в сигнале, аритмии, снижающие точность измерений, и более низкое временное разрешение. Кроме того, диастолический поток коронарной артерии включается в общий объем регургитации. В будущем новые методики, такие как 4D-поток, могут обеспечить прямую оценку потока при регургитационных поражениях.127
Рисунок 15 Случай биопротезирования аортального клапана (АК), осложненного большой псевдоаневризмой корня аорты, изображенный с помощью ТЭЭ и компьютерной томографической ангиографии. На продольных (A, B) и коротко-осевых (C) изображениях средостения видно большую псевдоаневризму (стрелки). Клапан имеет признаки кальцификации, но не имеет дискретных вегетаций. (В) То же изображение с цветной допплерографией, демонстрирующее эксцентрическую параклапанную регургитацию в диастолу. (D) Ангиографическая компьютерная томограмма сердца в сагиттальной проекции показывает дегидратацию под левой верхушкой с большой псевдоаневризмой (две красные стрелки). (E) Модифицированная сагиттальная проекция показывает циркулярную гипотонию на корне аорты, что указывает на прикорневой абсцесс (белые стрелки). Наблюдается умеренное утолщение и кальцификация биопротеза AV (визуализируется в систолу). Над левым синусом видна псевдоаневризма (красная стрелка). Ао – аорта; LA – левое предсердие; LV – левый желудочек; PrV – протез клапана; RA – правое предсердие.
В общем, рекомендуемые показания для проведения КМР при оценке протезированного аортального клапана являются следующими: 1. Расхождения в клиническом анамнезе и эхокардиографических данных или когда качество изображения при ТТЭ или ТЭЭ является неоптимальным.
- Случаи, когда на ТТЭ наблюдается несоответствие между площадью и градиентом клапана; СМР является дополнительным методом для оценки анатомической площади биопротеза клапана и обеспечения самой высокой скорости, регистрируемой через клапан.
- Оценка корня аорты при осложненном эндокардите (паравальвулярное распространение заболевания, псевдоаневризма или абсцесс корня)
- Количественная оценка тяжести АР
- Оценка неблагоприятного ремоделирования ЛЖ
Таблица 8 Параметры для оценки тяжести регургитации протезированного аортального клапана
| Параметры | Легкая | Умеренная | Тяжелая |
|---|---|---|---|
| Структура и движение клапана | |||
| Механический или биопротез | Обычно нормальная | Абнормальная | Абнормальная |
| Параметры структуры | |||
| Размер ЛЖ | Нормальный† | Нормальный или слегка расширенный† | Расширенный† |
| Допплеровские параметры (качественные или полуколичественные) | |||
| Ширина потока в центральных каналах, % Диаметр ВТЛЖ, (СВ)‡ | Узкий (#25%) | Промежуточный (26%-64%) | Большой (≥65%) |
| Ширина ВК, см (СВ) | <0.3 | 0.3-0.6 | >0.6 |
| Площадь ВК, см2 (2D/3D СВ)§ (2D/3D СВ)§ | <0.10 | 0.10-0.29 | ≥0.30 |
| Круговое распространение ПВУ, % (СВ){k | <10 | 10-29 | ≥30 |
| Плотность потока (НВ) | Неполная или низкая | Плотная | Плотная |
| Скорость замедления струи (ППД), мс (НВ)#. | Медленная (>500) | Вариабельная (200-500) | Стремительная (<200) |
| Реверсия диастолического потока в нисходящей аорте (ИХ) | Отсутствует или короткая ранняя диастола | Промежуточная | Выраженная, голодиастолическая |
| Допплеровские параметры (количественные) | |||
| Объем регургитации, мл/мин | <30 | 30-59 | ≥60 |
| Фракция регургитации, % | <30 | 30-50 | ≥50 |
КД, цветная допплерография *Аномалии механических клапанов: например, неподвижный окклюдер (клапанная регургитация), дегисценция или рокировка (параклапанная регургитация); аномалии биологических клапанов: например, утолщение или пролапс створок (клапанная регургитация), дегисценция или рокировка (параклапанная регургитация). Применяется к хронической, поздней послеоперационной АР при отсутствии других этиологий. Параметр применяется для центральных струй и менее точен для эксцентрических струй; предел Найквиста от 50 до 60 см/сек. § Площадь ВК измеряется путем планиметрии ВК струи (струй) на 2D или 3D CD-изображениях в виде короткой оси. {Измеряется как сумма окружных длин каждой регургитационной створки (без учета нерегургитационного пространства между отдельными створками), разделенная на окружность внешнего края клапана. k Окружную протяженность ПВУ лучше использовать не отдельно, а в комбинации с шириной и/или площадью створки. # Влияет на соответствие ЛЖ.
Ключевые моменты и рекомендации по протезированию аортальных клапанов
- Трансторакальная эхокардиографическая оценка протезированных клапанов в аортальной позиции может быть ограничена реверберацией и затенением заднего кольца/корня. ТЭЭ рекомендуется для улучшения визуализации заднего кольца/корня при плохой визуализации с помощью ТТЭ или если есть беспокойство относительно патологии заднего кольца/корня. КТ и СМР могут предоставить дополнительную информацию в этих ситуациях.
- Специализированная визуализация створок механического протеза аортального клапана рекомендуется с использованием рентгенологической визуализации с помощью КТ или рентгеноскопии, когда диапазон движения не может быть определен с помощью эхокардиографии и есть клиническое беспокойство относительно обструкции протезированного аортального клапана.
- При оценке стеноза протезированного аортального клапана рекомендуется получать допплеровскую инсоляцию из всех возможных окон и, по возможности, использовать небольшой не визуализирующий датчик.
- У пациентов с повышенными допплеровскими градиентами протезированного аортального клапана рекомендуется исключить такие причины, как состояния высокого потока, НПП, над- или подклапанную обструкцию и восстановление давления.
- Для оценки стеноза протезированного аортального клапана рекомендуется использовать по крайней мере одно высокозависимое от потока измерение (например, пиковая скорость, средний градиент) и одно менее зависимое от потока измерение (например, ЭПО, ДИС).
- Для клапанов ТИАК ускорение потока внутри стента происходит ниже клапана и на уровне створок. Рекомендуется проводить измерения диаметра и скорости ВТЛЖ непосредственно проксимальнее от стента, чтобы предотвратить переоценку ЭПО из-за ускорения потока внутри стента.
- Классификация тяжести регургитации внутри- и параклапанного протезированного аортального клапана подобна классификации нативных клапанов. Если существует расхождение между эхокардиографическими качественными и полукачественными параметрами тяжести АР, которое не может быть объяснено качеством изображения, техническими или физиологическими факторами и препятствует консенсусной классификации, тогда необходимо проведение ТЭЭ, СМРТ или КТ. Эти дополнительные методы визуализации также могут предоставить информацию об этиологии дисфункции ПКС.
ІІІ. ОЦЕНКА ПРОТЕЗИРОВАННЫХ МИТРАЛЬНЫХ КЛАПАНОВ
Как и в случае с протезами аортального клапана, первичная оценка функции протезированного митрального клапана начинается со знания типа и размера имплантированного протеза.
A. Типы протезирования клапанов в митральной позиции
Основным механическим клапаном, используемым в митральной позиции, является трехстворчатый клапан. Двустворчатые механические клапаны склонны к восстановлению давления через небольшое отверстие между двумя наклоненными дисками, что может привести к незначительной переоценке градиента при допплерографии и недооценке ЭПО с помощью уравнения непрерывности (рис. 3). Трехмерная планиметрия отверстия хорошо коррелирует с прогнозируемой производителем ЭПО.137 ЭПО механических митральных клапанов находится в диапазоне от 2 до 3 см2, а средний градиент составляет от 2 до 3 мм рт.ст., причем некоторые меньшие клапаны имеют градиент до 5-6 мм рт.ст. при физиологической частоте сердечных сокращений (Таблица А5 Приложения). Митральные биопротезы клапанов бывают только стентирующими. Классический митральный биопротез – это стентированный гетерографт, состоящий из трех биологических створок, реконструированных из аортального клапана свиньи или перикарда крупного рогатого скота. Гемодинамика этих хирургических клапанов сходная и зависит от размера имплантата, но имеет ожидаемую ЭПО от 2,2 до 3,5 см2 и средний градиент от 3 до 5 мм рт.ст. при физиологической частоте сердечных сокращений (Таблица А5).
Рисунок 16 Предложенный алгоритм для интеграции нескольких параметров тяжести АР после замены аортального клапана. Предполагается качественная эхокардиографическая визуализация и полный сбор данных. Если визуализация является технически сложной, для оценки тяжести следует рассмотреть возможность проведения ТЭЭ или СМР. Степень тяжести регургитации может быть неопределенной из-за низкого качества изображения, технических проблем с данными, внутренней несогласованности между эхокардиографическими данными или расхождения с клиническими данными. RF – фракция регургитации; Rvol – объем регургитации; ВКА – площадь ВК.
В настоящее время только один протез одобрен для чрескожной установки в митральной позиции. Клапан Edwards SAPIEN 3 одобрен FDA для чрескожной установки в митральной позиции для имплантации КвК и клапана в кольце (по состоянию на июль 2021 года). На момент написания этих рекомендаций он остается не одобренным для имплантации клапана в митральное кольцо. Гемодинамика клапана SAPIEN 3 в митральной позиции138-140 подобна гемодинамике клапанов биопротезов, перечисленных выше, и суммирована в Таблице А6 Приложения. На момент написания этой статьи существовало несколько исследовательских исследований чрескожного протезирования митрального клапана, а также систем для восстановления митрального клапана. В одном из них недавно были опубликованы отличные 2-летние результаты141 , однако долговременная долговечность не была установлена, и ни один из этих клапанов пока не одобрен FDA. Поэтому среди чрескожных митральных клапанов мы сосредоточим нашу дискуссию на клапане SAPIEN 3 (Приложение, таблица А6).
B. Эхокардиографическая оценка протезированных митральных клапанов
- Оценка функции протезированного митрального клапана: Комплексная оценка протезированных митральных клапанов с помощью эхокардиографии приведена в таблице 10 и включает следующее: ЧСС; пиковую раннюю скорость; средний градиент давления; ППД; заключение о наличии или отсутствии значительной регургитации, размеры ЛЖ, правого желудочка (ПЖ) и левого предсердия; и, если возможно, оценку давления в ПЖ и давления в правом предсердии (ПП). ЭПО и ДИС особенно важны для оценки стеноза, но также могут указывать на наличие значительного МР, который может увеличивать градиент и ДИС из-за высокого потока через клапан и меньшего системного выброса через ВТЛЖ. Диагностические критерии протезированного митрального стеноза при допплерэхокардиографии остаются подобными рекомендациям 2009 года (табл. 11). Пример тяжелого протезированного митрального стеноза показан на рисунке 19. Важным является сообщение о частоте сердечных сокращений, при которой проводятся допплеровские измерения. Основными критериями диагностики значительного митрального стеноза являются средний градиент >10 мм рт.ст. при нормальной частоте сердечных сокращений, ППД >200 мс, ДИС >2,5 и КДР <1 см2 . 33,52,142,143 В одном исследовании было показано, что ДИС, рассчитанный как ИСВ ПрМК/ИСВ ВТЛЖ, является наиболее специфическим и чувствительным допплеровским параметром стеноза.143 Расчет ЭПО описан выше в общем разделе о допплерографии. Для митрального клапана,
ЭПО = ударный объем/ИСВ ПрМК,
где ИСВ ПрМК – это ИСВ через протез митрального клапана, а ударный объем измеряется через ВТЛЖ при отсутствии значительной АР. Причинами протезированного митрального стеноза являются дегенерация клапана, тромбоз клапана, образование паннуса и большие вегетации. Хотя допплеровская эхокардиография является основным методом диагностики стеноза и обструкции, ТЭЭ позволяет увидеть митральный клапан в прямой проекции, что является важным для подтверждения диагноза и оценки механизма дисфункции (Рис. 19). Другие мультимодальные исследования играют вспомогательную роль (см. ниже).77,144 НПП значительно реже встречается при митральной позиции по сравнению с аортальной. Однако она может быть недодиагностирована. Критерии НПП подробно описаны в таблице 7. Клинические последствия могут быть хуже при митральной, а не аортальной позиции, особенно у пациентов в возрасте до 70 лет.145
Рисунок 17 (Панель А) Увеличение среднего градиента (28 мм рт.ст.) и пиковой скорости 3,6 м/с на 23-мм клапане SAPIEN 3 наблюдали примерно через 4 месяца после ТИАК. КТ сердца продемонстрировала гипоатенуированное утолщение створок (HALT; красные стрелки) с вовлечением от 50% до 75% створок (B, C) и гипоатенуацию, влияющую на движение (D). После начала антикоагуляции средний градиент снизился до 14 мм рт.ст. (E). Повторная КТ сердца продемонстрировала устранение HALT (F, G) с нормальной подвижностью створок (H).
- Оценка МР протезированного клапана: ТТЭ показана для рутинного наблюдения и может быть начальным тестом выбора при подозрении на дисфункцию митрального протеза, но визуализация МР-струй при ТТЭ часто ограничена акустической реверберацией или затенением от митрального протеза (рис. 6). Парастернальное окно часто является оптимальным видом для оценки МР-струй протеза, хотя апикальные виды могут быть полезными для выявления подозрения на эксцентрическую регургитационную струю или параклапанную регургитацию.146 Апикальные виды также могут обеспечить лучшую визуализацию створок протезированного клапана для выявления вегетации, тромба, паннуса или дегенеративных изменений створок. Учитывая, что трансторакальная эхокардиографическая визуализация протезной или паравускулярной МР часто ограничена, особенно важно искать косвенные спектральные допплеровские доказательства выраженной МР. Критерии, указывающие на значительную МР, подробно описаны в таблице 12 и включают следующее:
- Плотный НВ МР-поток
- Повышение скорости митрального Е (>1,9 м/с в механических клапанах)1
- Низкий системный выброс и ИСВ ВТЛЖ, несмотря на гипердинамический левый желудочек
- Повышенное соотношение ИСВ ПкМР/ИСВ ВТЛЖ (>2,5)
- Большая зона конвергенции систолического потока на стороне ЛЖ митрального протеза
- Значительное повышение давления в ЛА по сравнению с предыдущим исследованием При подозрении на значительный протезный или паравальбулярный МР на основе этих параметров часто полезно провести ТЭЭ для окончательной визуализации морфологии протезной створки и подвижности створки или диска, а также для количественной оценки тяжести МР (Рис. 20). Комбинированные трансторакальные и чреспищеводные эхокардиографические параметры и критерии оценки тяжести МР подробно описаны в таблице 13. Предложенный алгоритм оценки тяжести МР с помощью эхокардиографии показан на рисунке 21.
iii. Роль ТЭЭ: ТЭЭ играет очень важную роль в оценке протезированных митральных клапанов. Протез митрального клапана можно визуализировать в прямой проекции, что позволяет тщательно оценить его структуру, подвижность створок или окклюдера механических клапанов, а также выявить любую дегисценцию или регургитацию. ТЭЭ имеет решающее значение для оценки регургитации протезированного клапана, особенно в механических клапанах, где акустическая реверберация и затенение на ТЭЭ является правилом. Трехмерная ТЭЭ играет ключевую роль в диагностике патологии протезированного митрального клапана, обеспечивая полный обзор клапана, его кольца и прилегающих структур (Рис. 19, 20 и 22). Сравнительные преимущества и ограничения ТЭЭ и других методов исследования подробно описаны в таблицах 2 и 3.
C. Роль КТ в оценке протезированных митральных клапанов
- Стеноз клапана: КТ сердца является ценным дополнительным инструментом для оценки стеноза протезированного митрального клапана ввиду высокого пространственного разрешения и получения 3D-объема. Для оценки протезированного клапана обычно выполняют ретроспективную электрокардиографически управляемую съемку, чтобы обеспечить оптимальную визуализацию протезированного клапана в течение всего сердечного цикла; однако доза облучения выше, чем при проспективной электрокардиографически управляемой съемке.147-149 Если нет противопоказаний, можно назначить b-блокаторы для снижения ЧСС до 60 уд/мин, чтобы уменьшить двигательные артефакты. Изображения реконструируются с шагом от 5% до 10% от интервала R-R, чтобы можно было оценить работу протезированного клапана в течение всего сердечного цикла. Углы открытия и закрытия механического клапана можно оценить на снимках без контрастного усиления, таких как кино-рентгеноскопия, но этиологию ограниченного открытия клапана определить невозможно.147 Снимки с контрастным усилением позволяют оценить дегенерацию створки биопротеза (утолщение и кальцификацию), подвижность створки или диска окклюдера, кальцификацию кольца биопротеза, тромб, паннус или вегетацию.150 Геометрическую площадь отверстия протезированного митрального клапана можно измерить, используя мультипланарную реконструкцию.151 В механических клапанах можно измерить углы открытия и закрытия в дополнение к геометрической площади отверстия.152 ТЭЭ и КТ являются более точными в определении этиологии протезированного митрального стеноза по сравнению с ТТЭ; КТ является более чувствительной в выявлении паннуса как причины обструкции клапана.77 Существуют технические ограничения для КТ, поскольку артефакты «цветения» и затвердевания луча от кольца клапана или дисковых окклюдеров могут ухудшить оценку. Эти металлические артефакты можно уменьшить, используя более высокое напряжение на трубке и итеративную реконструкцию.153
Таблица 9 Потенциальная роль КТ в различных осложнениях протезирования аортальных клапанов
| Осложнения | Потенциальная роль MDCT |
| Механическая дисфункция створки | Может оценить движение и угол открытия механической створки (створок) и сравнить его со спецификациями производителя Нормальный угол открытия составляет 73-90 для двустворчатых клапанов и 60-80 для одностворчатых клапанов |
| НПП | Небольшая ЭПО, нормальное движение створки, отсутствие массы и малая геометрическая площадь отверстия115 |
| Структурная несостоятельность | Выявление кальцификации клапанов, несмотря на нормальные градиенты116 |
| Дегисценция протеза | Выявление зазора между кольцом и сшивочным кольцом протеза. Для протеза аортального клапана чрезмерное движение сшивающего кольца с качанием >15 свидетельствует о значительной параклапанной регургитации1. |
| ПВУ | Заполненный контрастным веществом канал в паравальвулярной области, который соединяет просвет проксимально и дистально от клапана (например, для аортального клапана, аорты и ВТЛЖ) Помогает отличить от псевдоаневризмы и абсцесса117 Помогает отличить от материала тромба (HU тромба значительно выше, чем у контрастного вещества [383-494 HU против 202-367 HU]118) |
| Эндокардит | Большие образования (>1 см) на створке клапана или сшивном кольце, обычно на желудочковой стороне аортального клапана119; в целом уступает ТЭЭ при выявлении небольших образований (<4 мм) и перфораций (<2 мм), но превосходит ее в оценке параклапанного и экстракардиального расширения120 КТ может выявить другие проявления инфекции, такие как утолщение стенки аорты, медиастинальный газ, жировые прожилки, скопления119,120. |
| Псевдоаневризма | Заполненные контрастным веществом мешкообразные или веретенообразные выпоты, возникающие из кольцевого отверстия, которые могут содержать тромб При инфицировании могут наблюдаться воспалительные изменения прилегающих мягких тканей |
| Тромбы | Нерегулярное образование, обычно подвижное, без усиления, прикрепленное к ПКС Важно отличить от паннуса Тромб чаще наблюдается на ранних стадиях после операции, прикреплен, как правило, к аортальной стороне протеза аортального клапана и имеет более низкую ослабленность (<200 HU) Паннус наблюдается на поздних стадиях после операции, обычно расположен со стороны желудочка и имеет более высокую ослабленность (>200 HU)121 Для отличия тромба от паннуса полезным является пороговое значение 145 HU, при этом 87. 5% чувствительностью и 96% специфичностью121 КТ позволяет прогнозировать ответ на тромболизис. Полный лизис чаще наблюдается в тромбах с ослаблением менее 90 HU против 90-145 HU121 |
| HALT и HAM | Помогает идентифицировать HALT, с ограничением движения или без него, который способствует антикоагуляции122 |
| Расслоение аорты | Клапоть интимы с истинным и ложным просветом, внутреннее смещение кальциноза интимы, задержка увеличения ложного просвета, расширение аорты и средостения, язвенные проекции контрастного вещества и сжатие истинного просвета123 |
HALT, гипоатенуированное утолщение листьев; HAM, гипоатенуация, влияющая на движение; HU, единица Хаунсфилда; MDCT, мультидетекторная компьютерная томография.
- Регургитация клапана: Чрезмерное покачивание протеза митрального клапана во время сердечного цикла наблюдается при клапанной дегидратации. Размер ПВУ на КТ коррелировал со степенью регургитации на эхокардиографии в ранних наблюдениях, большинство из которых включали значительную регургитацию.78 Небольшие ПВУ могут быть скрыты из-за металлических артефактов от протезного кольца или дисковых окклюдеров, или спутаны с задатком. В этих ситуациях важно подтверждение или исключение регургитации с помощью допплеровской эхокардиографии. Закладки можно идентифицировать также с помощью неконтрастного сканирования или тщательной проверки ослабления на усиленном контрастом сканировании, поскольку войлочный задел может иметь большее ослабление, чем кровь, усиленная контрастом.153 Площадь регургитационного отверстия можно измерить в систолическую фазу, при этом она хорошо согласуется с данными ТЭЭ и результатами хирургического вмешательства.154
D. Роль СМР при оценке Протезированных МИтральных Клапанов
- Стеноз клапана: Оценка стеноза митрального клапана с помощью СМР может быть выполнена тремя методами: визуальная оценка биопротезов или экскурсии окклюдера, прямая планиметрия клапанного отверстия биопротеза или измерение пиковой скорости через протез с помощью фазово-контрастной визуализации. Для визуальной оценки следует использовать комбинацию из трех продольных и коротковолновых изображений. Это может выявить нарушение экскурсии механических ПКС окклюдеров или створок биопротеза и продемонстрировать потенциальную причину стеноза, включая паннус, тромбоз или эндокардит. Основным ограничением остается артефакт чувствительности, особенно при использовании механических клапанов. Для количественной оценки выраженности стеноза можно измерить анатомическую площадь отверстия на биопротезированных клапанах.86,87 Если присутствует артефакт, который ограничивает оценку створок, можно рассмотреть возможность проведения быстроградиентной эхокардиографии.
Таблица 10 Эхокардиографические параметры для оценки функции протезированного митрального клапана (стеноз или регургитация)
| Допплер-эхокардиография митрального клапана | Пиковая ранняя скорость пиковой скорости
Средний градиент давления Частота сердечных сокращений на момент допплерографии ППД ДИС (ИСВ ПрМК/ИСВ ВТЛЖ) ЭПО* Наличие, локализация и выраженность регургитации |
| Другие соответствующие эхокардиографические параметры | Размер и функция ЛЖ
Размер левого предсердия Размер и функция ПЖ Оценка давления в ПЖ |
ИСВПрМК, ИСВ через протез митрального клапана *С использованием уравнения непрерывности.
Рисунок 18 Случай биопротезированного аортального стеноза, оцененного с помощью СМРТ.
(А) Продольный МР снимок аорты в стационарном состоянии со свободной прецессией показывает дефазировку вращения в систолу, что соответствует высоким скоростям, исходящим из стеноза. Обратите внимание на отсутствие значительного металлического артефакта. (В) Двойная ортогональная проекция на кончики створок клапана во время максимального систолического открытия показывает соответствующий короткоосевой вид протезированного аортального клапана и признаки стеноза с анатомической площадью клапана 0,9 см2. (C, D) Фазово-контрастное изображение демонстрирует дефазию на уровне аортального клапана. Магнитно-фазовое контрастирование с использованием двойной ортогональной плоскости на уровне аортального клапана с кодированной скоростью СМР 450 см/с показывает отсутствие алиасинга и пиковую трансклапанную скорость 4,1 м/с (белая стрелка на графике потока).
Рисунок 19 Случай тяжелого механического стеноза митрального клапана, вторичного к тромбообразованию. (А) Двумерная ТЭЭ, вид из средостения в диастолу, показывает ограниченную подвижность створки (желтая стрелка) с высоким цветным алиасингом притока (В) и выраженный протезный стеноз (средний градиент 29 мм рт. ст. при ЧСС 86 уд/мин) при НВ допплерографии (С). (D) 3D-ТЕЭ механического митрального клапана в реальном времени (вид спереди), демонстрирующая ограниченное движение створки в диастолу (красная стрелка) и две неподвижные массы (круги) вдоль шарнирных точек механического клапана.
Таблица 11 Допплерографические данные, указывающие на стеноз протезированного митрального клапана
| Норма | Возможный стеноз† | Предположение о значительном стенозе* † † предположение о значительном стенозе | |
| Пиковая скорость, м/с § | <1.9 | 1.9-2.5 | ≥2.5 |
| Средний градиент, мм рт.ст.‡§ | #5 | 6-10 | >10 |
| ІСВ ПрМК/ІСВ ВТЛЖ‡§ | <2.2 | 2.2-2.5 | >2.5 |
| ЭПО, см2 | ≥2.0 | 1-2 | <1 |
| ППД, млсек | <130 | 130-200 | >200 |
ИСВПрМК, ИСВ через протез митрального клапана. *Для механических или биопротезированных клапанов; точность диагностики является наилучшей, если большинство перечисленных параметров являются нормальными или отклоняются от нормы соответственно. Значения параметров должны побуждать к более тщательной оценке функции клапана и/или других соображений, таких как увеличение потока, увеличение частоты сердечных сокращений или НПП. ‡ Эти параметры также являются ненормальными при наличии значительного протезированного МР. § Несколько более высокие значения отсечения, чем показано, могут наблюдаться у некоторых биопротезированных клапанов.
Основным ограничением этого метода является предположение, что самый узкий участок находится в одной плоскости, что часто не соответствует действительности. Однако предыдущие небольшие исследования показали высокую реалистичность, хорошую вариабельность между наблюдателями и согласованность с планиметрией митрального клапана с помощью СМР и эхокардиографией, измеренной с помощью ППД.86 Другим потенциальным методом оценки стеноза биопротезированного клапана является получение сквозных фазово-контрастных изображений, перпендикулярных к транспротезной приточной струе на уровне створок клапана. Граница Найквиста должна быть тщательно подобрана, чтобы обеспечить отсутствие алиасинга. Планиметрия площади потока обеспечит измерение пиковой скорости, а недавние данные in vitro продемонстрировали возможность измерения ИСВ и расчета площади митрального клапана.87 Основной проблемой этого подхода является сквозное движение кольца, что затрудняет измерение скорости в одной и той же точке в течение сердечного цикла. Кроме того, этот подход ограничен для механических клапанов из-за артефактов чувствительности. Общая клиническая валидизация методов оценки протезированного митрального стеноза остается ограниченной.
- Регургитация клапана: Регургитацию протезированного клапана можно визуально оценить по наличию СМРТ-индуцированной дефазировки интервокселей в левом предсердии на ЗУП-изображениях.155 Размер струи можно классифицировать в зависимости от площади левого предсердия (легкая, менее одной трети; умеренная, от одной трети до двух третей; тяжелая, более двух третей) и имеет хорошую согласованность с данными эхокардиографии, особенно при более чем умеренной МР.155 Хотя межвоксельная дефазировка может быть первым признаком биопротезной МР, она не может быть достоверно идентифицирована из-за артефактов чувствительности от ПКС. Кино-изображения также могут помочь идентифицировать механизмы регургитации, такие как дегисценция, вегетация или абсцесс. Однако, преимущество СМР заключается в количественной оценке МР путем измерения объема и фракции регургитации. Это лучше всего достигается с помощью косвенного метода. В идеале это должно включать планиметрию левого желудочка с использованием ЗУП-кинескопов для измерения общего ударного объема ЛЖ; ударный объем передней части аорты рассчитывают с помощью сквозных фазово-контрастных изображений на уровне проксимального отдела восходящей аорты. Разница между общим ударным объемом ЛЖ и ударным объемом передней стенки аорты является объемом МР.88 Деление объема регургитации на общий ударный объем ЛЖ дает фракцию регургитации. Если аортальные фазово-контрастные данные недоступны, можно также использовать сквозные фазово-контрастные изображения легочного клапана. Потенциальным ограничением этой стратегии является риск возникновения артефакта чувствительности на базальных короткоосевых кино-изображениях с ПКС, что снижает точность количественного определения общего ударного объема ЛЖ. Наконец, при отсутствии фазово-контрастных данных и трикуспидальной, легочной или аортальной регургитации разница между общим ударным объемом ЛЖ и ПЖ может быть использована для количественной оценки объема и фракции регургитации.88
| Находки | Чувствительность | Специфичность | Комментарии |
| Пиковая скорость митрального выброса ≥1,9 м/сек*. | 90% | 89% | Также учитывайте сильный поток, НПП |
| ІСВ ПрМК/ІСВ ВТЛЖ ≥2.5* | 89% | 91% | Погрешности измерения увеличиваются при фибрилляции предсердий из-за сложности согласования сердечных циклов; также учитывайте НПП |
| Средний градиент ≥5 мм рт.ст.*. | 90% | 70% | При физиологической частоте сердечных сокращений; также учитывайте сильный поток, НПП |
| Максимальная скорость струи ТР >3 м/с*. | 80% | 71% | Рассмотреть остаточную послеоперационную легочную гипертензию или другие причины |
| Ударный объем ЛЖ, полученный с помощью 2D или 3D эхокардиографии, на >30% выше, чем системный ударный объем по данным допплерографии | Умеренная чувствительность | Специфически | Валидация отсутствует; значительная МР подозревается, когда функция ЛЖ нормальная или гипердинамическая, а ИСВ ВТЛЖ небольшой (<16 см) |
| Конвергенция систолического потока в левом желудочке по направлению к протезу | Низкая чувствительность | Специфично | Валидация отсутствует; технически сложно выявить |
ИСВ ПрМК, ИСВ через протез митрального клапана. *Данные Olmos и соавт. 33 Когда и пиковая скорость, и соотношение ИСВ повышены при нормальной ППД, специфичность приближается к 100%.
Рисунок 20 Случай паравальвулярной МР в механическом клапане. (А) Апикальная четырехкамерная проекция показывает акустическую реверберацию за механическим митральным клапаном (МК) в систолу (стрелка). (В) Цветная допплерография показывает эксцентричный МР (стрелка); артефакт, происхождение и степень которого трудно установить. (С) Спектральная допплерография показывает повышенные скорости и градиент на клапане (средний градиент 9 мм рт.ст. при ЧСС 87 уд/мин) с ИСВ МК 52 см. (D) Спектральная ИХ допплерография в ВТЛЖ показывает сниженную скорость и ИШК 17 см. Соотношение протезного МК ИСВ к ИСВ ВТЛЖ, равное 3, указывает на наличие сопутствующей регургитации при отсутствии митрального стеноза, что выводится из нормальной ППД. (E) ТЭЭ средостения показывает две паравальвулярные струи регургитации (стрелки). (F) Трехмерная ТЭЭ показывает широко открытый клапан в диастолу. (G) Трехмерная ТЭЭ с цветом показывает два ПВУ, один на 11 часов, а другой на 5 часов (кружочки). Третья более центральная струя – это промывная струя, как видно на (E). LA, левое предсердие; LV, левый желудочек
Ключевые моменты для оценки протезированных митральных клапанов
- Оценка функции протезированного митрального клапана начинается со знания типа и размера имплантированного протеза.
- Структурная и гемодинамическая оценка с помощью TTE и ТЭЭ дает ключевое понимание функции протезированного митрального клапана.
- При допплеровском исследовании протезированных митральных клапанов следует измерять пиковую скорость, средний градиент, ППД, ЭПО или ДИС и частоту сердечных сокращений, когда это возможно, и сообщать о них.
- Из-за затенения и маскировки потока в левом предсердии, особенно при механических митральных клапанах, значительный протезный МР может быть пропущен при цветной допплерографии на ТТЭ. Признаками значительной МР при спектральной допплерографии являются повышенная ранняя пиковая скорость митрального выброса, средний градиент, ДИС и относительно низкий системный ударный объем по отношению к общему ударному объему ЛЖ. ТЭЭ показана в случаях подозрения на значительную МР.
- ТЭЭ (2D и 3D) обеспечивает обзор протезированного митрального клапана в прямой проекции, что позволяет оценить структуру клапана, движение окклюдера, а также наличие, локализацию и степень клапанной регургитации; последнее имеет решающее значение для руководства интервенционными процедурами.
- КТ и КМР обеспечивают дополнительную оценку протезированных митральных клапанов, особенно когда необходима дополнительная информация о структуре, функции протеза или связанных с ним осложнениях. КТ позволяет оценить структуру клапана и движение механического окклюдера клапана, а также локализовать значительную параклапанную регургитацию и выявить связанные с ней осложнения. КТ позволяет оценить клапанную структуру биопротезированных клапанов и является особенно полезной для количественной оценки ремоделирования МЖ и ЛЖ при протезировании
Таблица 13 Эхокардиографические критерии тяжести регургитации с протезированным митральным клапаном по данным ТТЭ и ТЭЭ
| Легкая | Средний | Тяжелая | |
| Структурные параметры | |||
| Размер ЛЖ | Нормальный* | Нормальный или расширенный | Обычно расширенный† |
| Протезированный клапан | Обычно нормально | Ненормальный | Ненормальный |
| Допплеровские параметры | |||
| Площадь потока цветного допплера‡{ | Небольшой центральный поток (обычно <4 см2 или <20% площади ЛП) | Варьируется | Большая центральная струя (обычно >8 см2 или >50% площади ЛП) или пристеночная импульсная струя разного размера, закручивающаяся в левом предсердии |
| Конвергенция потока k | Отсутствует или минимальная | Средняя | Большая |
| Плотность потока (НВ)‡ | Неполная или слабая | Плотная | Плотная |
| Контур потока(НВ)‡ | Параболический | Обычно Параболический | Ранний пик: триангулярная форма |
| Легочный венозный кровоток | Систолическая доминанта# | Систолическое притупление#. | Реверсия систолического потока** |
| Количественные параметры††† | |||
| Ширина ВК (см)‡ | <0.3 | 0.3-0.69 | ≥0.7 |
| RVol, мл | <30 | 30-59‡‡ | ≥60‡‡ |
| RF, % | <30 | 30-49 | ≥50 |
| ЭПР, см2 | <0.20 | 0.20-0.39 | ≥0.40 |
МК, митральный клапан; ФР, фракция регургитации; RVol, объем регургитации. *Размер ЛЖ применяется только к хроническим поражениям с прогрессирующим увеличением. † При отсутствии другой этиологии увеличения ЛЖ и острой МР. Параметр может быть лучше всего оценен или получен при проведении ТЭЭ, особенно при наличии механических клапанов. § Аномалии механических клапанов: например, неподвижный окклюдер (клапанная регургитация), дегисценция или качание (параклапанная регургитация); аномалии биологических клапанов: например, утолщение или пролапс створок (клапанных), дегисценция или качание (параклапанная регургитация). { При пределе Найквиста 50-60 см/сек. k Минимальная и большая конвергенция потока определяются как радиус конвергенции потока <0,4 и ≥0,9 см для центральных струй, соответственно, со смещением базовой линии при пределе Найквиста 40 см/сек; отсечение для эксцентричных струй может быть выше. # Если нет других причин систолического притупления (например, фибрилляция предсердий, повышенное давление в левом предсердии). **Реверсия легочного венозного систолического потока является специфической, но не чувствительной для тяжелой МР. ††Эти количественные параметры менее хорошо валидированы, чем при нативной МР. Объем отсечения регургитации может быть ниже в условиях низкого потока.
IV. ОЦЕНКА ПРОТЕЗИРОВАННЫХ ЛЕГОЧНЫХ КЛАПАНОВ
Нативный клапан легочной артерии расположен спереди и выше аортального клапана и лучше всего визуализируется с помощью TTE с использованием изображения ВТПЖ из парастернального окна (модифицированного из парастернального короткоосного изображения на уровне аортального клапана) или субкостального окна. Протезированный клапан не всегда находится в том же положении, что и нативный клапан легочной артерии, особенно если вовлечен кондуит. Важно понимать, что при использовании эхокардиографии могут потребоваться внеосевые изображения. КТ и СМР обеспечивают улучшенное пространственное разрешение и должны использоваться для дополнения результатов эхокардиографии. При оценке протеза легочного клапана важно учитывать дополнительную информацию об анатомии ВТПЖ и ЛА, а также размер, функцию и давление легочного клапана.
A. Хирургическая и транскатетерная ЗЛК
Родной больной легочный клапан может быть заменен либо клапанным кондуитом для полного устранения врожденного порока, либо протезом клапана без кондуита при изолированной клапанной патологии. Наиболее распространенным показанием для установки клапанного кондуита является тетрада Фалло. Другие показания включают процедуру Растелли (транспозиция крупных артерий при дефекте межжелудочковой перегородки) или в рамках процедуры Росса (врожденный стеноз аортального клапана) или операции Ясуи (прерванная дуга аорты с уменьшенной восходящей аортой). Клапанный канал, как правило, является биологической тканью (например, гомотрансплантат, ксенотрансплантат). Стентированные биологические протезы обычно имплантируют при регургитации легочного клапана, которая чаще всего возникает у пациентов, ранее перенесших реконструкцию ВТПЖ.156
Впервые о транскатетерной ЗЛК было сообщено в 2000 году, и с тех пор она стала жизнеспособной альтернативой хирургической ЗЛК у некоторых пациентов.157 Результаты обоих типов вмешательств являются благоприятными и сопоставимыми, при этом транскатетерная ОЛК ассоциируется с более коротким пребыванием в больнице и перипроцедурными осложнениями, но более высоким уровнем эндокардита.158 Количество процедур ОЛК возросло с годами, при этом наблюдается постоянная тенденция к увеличению хирургической ОЛК.159. Кроме того, возраст пациентов, которым проводят ЗЛК, заметно отличается в разных центрах США, а административные данные свидетельствуют об общем увеличении количества молодых пациентов, которым проводят ЗЛК.160 Тенденции свидетельствуют о том, что для оценки патологических осложнений замененных протезов, вероятно, будет привлекаться больше абсолютных показателей взрослых пациентов. Важно понимать типы хирургических и транскатетерных замен для лучшего понимания риска осложнений.
B. Оценка стеноза протезированного легочного клапана
- Эхокардиографическое и допплеровское исследование: При оценке тяжести стеноза протезированного клапана важно помнить, что высокие скорости потока могут наблюдаться в других местах, кроме протезированного клапана. Стеноз сосудов ветви или стеноз края канальца также могут присутствовать и затруднять НВ допплеровское исследование скоростей через протезированный клапан. В предыдущих руководствах ASE описаны общие соображения по визуализации и проблемы оценки ЗЛК, включая нетрадиционную форму ВТПЖ, расположение протеза и ассоциацию с хирургически установленными каналами.1 Эхокардиографическая оценка обструкции клапана должна включать (1) характеристику типа и размера протеза, как указано в таблице 14, (2) наблюдение за качественными показателями обструкции (например, тромб, паннус), (3) количественную оценку тяжести стеноза и (4) любые изменения по сравнению с предыдущими оценками при серийных обследованиях. Кроме того, систолическое давление в ПЖ следует определять с помощью струи ТР, если оно присутствует. Следует отметить, что систолическое давление в ЛА при наличии стеноза ЗЛК – это разница между систолическим давлением в ПЖ и градиентом через обструктивный клапан. Биологические протезы остаются самым распространенным типом ЗЛК. Однако, эти клапаны, скорее всего, со временем выйдут из строя и потребуют замены. Механические протезы нечасто имплантируют в этой позиции, поэтому данных о патологии, влияющей на эти клапаны, немного. Учитывая, что более молодой возраст при ЗЛК является прогностическим для отказа протезированного клапана, а также то, что больше процедур ЗЛК выполняется у молодых людей, стеноз протезированного легочного клапана станет более распространенным явлением.161 Отказ или дисфункция протезированного клапана преимущественно проявляется в виде стеноза, а не регургитации, с частотой примерно 80% в течение 10 лет после первичной имплантации.161 При возникновении эндокардита в ЗЛК или кондуитах обструкция на момент установления диагноза является более распространенной, чем тяжелая регургитация: 53% против 29%, соответственно.162 Определение локализации стеноза является важным, поскольку обструкция может возникнуть дальше по ходу канала или в ЛА, а не на клапане. ИК допплерография помогает определить точную локализацию обструкции. Сужение протока и влияние на правый желудочек также являются индикаторами обструктивного поражения. Количественные параметры обычно ограничиваются пиковой скоростью и средним градиентом (Рисунок 23). Интересно, что существуют данные, свидетельствующие о том, что нормально функционирующие механические протезы чаще имеют более низкую пиковую скорость и средний градиент по сравнению с биологическими клапанами в легочной позиции.163 Индикаторы стеноза протезируемых клапанов приведены в Таблице 15.
- Роль ТЭЭ и 3D: ТЭЭ может быть сложной задачей при оценке ЗЛК, поскольку легочный клапан является передней структурой, и если есть кондуит, то его расположение является нетипичным. Классически ТЭЭ легочного клапана выполняется в средостенном положении с углом датчика от 50 до 70 или из глубокого трансгастрального положения с углом датчика примерно от 50 до 90. 164 Полезно использовать цветную допплерографию для локализации протеза и панорамирования от 0 до 90, чтобы найти наилучший угол, особенно при врожденных пороках сердца (ВПС). ИХ и НВ допплерография важна для оценки стеноза клапана или протока. 3D в реальном времени или 3D-зум с использованием средостения с углом датчика от 50 до 70 можно использовать для отображения вида легочного клапана анфас со стороны ЛА или со стороны ВТПЖ с вращением для отображения передней створки в положении на 12 часов.26 Многоплоскостная реконструкция набора 3D-данных может быть быстро использована для оценки спаек трех створок на предмет кальцификации или сращения в дополнение к отслеживанию отверстия клапана.165 При чрескожной реимплантации легочного клапана ВСЭ обеспечивает лучшую визуализацию гомотрансплантата или канала и может выявить инфекционный эндокардит, связанный с протезированным клапаном.166,167
Рисунок 21 Предложенный алгоритм для интеграции нескольких параметров тяжести МР после замены митрального клапана. Предполагается качественная эхокардиографическая визуализация и полный сбор данных. Если визуализация является технически сложной, для оценки тяжести следует рассмотреть возможность проведения ТЭЭ или СМР. Тяжесть МР может быть неопределенной из-за низкого качества изображения, технических проблем с данными, внутренней несогласованности между эхокардиографическими данными или расхождения с клиническими данными. LA – левое предсердие; PISA – площадь поверхности проксимальной изовекторной скорости; RF – фракция регургитации; Rvol – объем регургитации; VCA- площадь ВК; VCW – ширина ВК.
iii. Роль СМРТ: Кино-визуализация с ЗУП или градиентным эхо позволяет визуализировать использованный стент, если есть артефакт стента, и позволяет оценить сосуд, поскольку имеет пониженную чувствительность к металлическим артефактам, с ограничением статического изображения.168 Сквозное фазово-контрастное изображение через протез позволяет оценить пиковую скорость через клапан, кондуит и/или основную ЛА или ЛА отдельно. Если есть артефакт стента, фазовый контраст может быть размещен проксимальнее и дистальнее артефакта стента.169 Пиковая скорость, как правило, немного ниже, чем та, что получена при допплеровской эхокардиографии под оптимальным углом. Магнитно-резонансная ангиография с контрастным усилением позволяет получить трехмерный набор данных, который можно использовать для дальнейшей идентификации участков стеноза. Позднее гадолиниевое усиление с длительным временем Т1 можно использовать для выявления тромба как причины стеноза.127,170 КТ нельзя использовать для точной оценки кальцификации протеза или кондуита.
- роль КТ: Если значительный артефакт, связанный со стентом, препятствует адекватной оценке с помощью СМРТ, КТ может быть использована для оценки легочного клапана или кондуита (Рис. 24).171 Это может быть полезным, когда этиология стеноза неясна или для оценки для чрескожного структурного вмешательства.
Рисунок 22 Чреспищеводной эхокардиографии стеноза митрального клапана (ПрМК) с биопротезом в исходном положении и после установки транскатетерного КвК. Базовые 3D чреспищеводные изображения (А) показывают утолщенные створки с резко ограниченным открытием в диастолу и средним диастолическим градиентом (Гр) 8 мм рт. ст. (В) после каталитической установки КвК. (С) После установки транскатетерного КвК транскатетерный клапан хорошо прилегает, створки нормально открываются в диастолу, нет значительной протезной или паравальвеолярной регургитации, а средний трансклапанный Гр составляет 4 мм рт.ст. (D). Max – максимальный; PG – градиент давления; Vmax – максимальная скорость; Vmean – средняя скорость.
Таблица 14 Самые распространенные типы ЗЛК
| Тип клапана/кондуита | Производитель; размер (диаметр клапана или кондуита) | |
| Хирургические | Гомотрансплантат (криоконсервированный аортальный или легочный) | Разнообразие размеров |
| Ксенотрансплантаты | Medtronic Contegra; 12-22 мм | |
| Shelhigh; 10-24 мм | ||
| Medtronic Freestyle; 19-29 мм | ||
| Композитные синтетические каналы с биопротезными/механическими клапанами | Клапан Carpentier-Edwards Porcine; 12-30 мм | |
| Medtronic Hancock; 12-26 мм | ||
| Изготовлены вручную; различные размеры | ||
| Биопротезные или механические клапаны | Разнообразие типов и размеров | |
| Транскатетер | В пределах кондуитов или биопротезных клапанах | Medtronic Melody; 18 мм |
| Edwards SAPIEN; 23-29 мм | ||
| В родном канале оттока | Medtronic Harmony; 22 та 25 мм |
Рекомендуется электрокардиографическое изображение всего сердечного цикла с контрастным усилением, особенно в случаях, когда необходимо чрескожное вмешательство. Наличие кальцификации указывает на структурную дегенерацию клапана, но не может быть использовано для количественной оценки степени стеноза. Наличие утолщения створки, паннуса или тромба также может быть оценено для выявления других причин стеноза.172 КТ сердца может быть использована для определения размера клапана или канала, используя эффективный диаметр, полученный на основе измерения площади или периметра, если предыдущие хирургические записи недоступны. Однако следует отметить, что эти измерения являются менее точными для кондуитов, где послеоперационная кальцификация может привести к изменению размера и формы.173
Рисунок 23 Примеры нормально функционирующего протезированного легочного клапана (A, B) и другого со значительным стенозом (C, D). PkV, пиковая скорость через легочный клапан.
Таблица 15 Параметры протезирования стеноза легочного клапана
| Норма | Возможна обструкция | |
| Качественные | Нормальная структура и движение клапана Ламинарный поток | Нарушение структуры и движения клапана Используйте ИХ допплер для определения локализации стеноза Повышенная турбулентность по данным цветной допплерографии с узкой струей потока |
| Количественные*
* |
Пиковая скорость <3,2 м/с для биопротеза <2,5 м/с для гомотрансплантата Средний градиент <20 мм рт.ст. для биопротеза <15 мм рт.ст. для гомотрансплантата | Пиковая скорость ≥3,2 м/с для биопротеза ≥2,5 м/с для гомотрансплантата Средний градиент ≥20 мм рт.ст. для биопротеза ≥15 мм рт.ст. для гомотрансплантата |
| Последовательное сравнение с базовым уровнем | Стабильный пиковый/средний градиент и пиковая скорость Без изменений систолического давления ЛЖ Без изменений размера и систолической функции ЛЖ Без изменений ДИС | Увеличение пикового/среднего градиента и пиковой скорости Увеличение систолического давления в ПЖ Увеличение размера ПЖ и снижение систолической функции Уменьшение ДИС |
*Измерения предполагают нормальный ударный объем ПЖ. Точная НВ допплерография может быть сложной из-за положения гомотрансплантата или биопротеза клапана; важно использовать внеосевые парастернальные и супрастернальные изображения.
Рисунок 24 Случай тетрады Фалло с 20-мм гомографтом, установленным 25 лет назад. Систолический и диастолический систолический и диастолический поток с фазовым контрастированием (слева) демонстрирует значительный стеноз и регургитацию (4,1 м/сек, с фракцией регургитации 41%). Компьютерная томографическая ангиография с мультипланарной реконструкцией (панели) показывает стеноз гомографта (14-15 мм), вторичный к кальцификации. Желтые стрелки указывают на легочный гомограффт. Ао – аорта; RV – правый желудочек.
C. Оценка регургитации протезированного легочного клапана
- Эхокардиографическая и допплерографическая оценка: Существует недостаточно данных, которые бы конкретно оценивали ЛР протезированных клапанов, поэтому имеющаяся информация экстраполируется из оценки ЛР нативных клапанов. В таблице 16 подробно описаны эхокардиографические результаты при различных степенях тяжести протезированной ЛР, а в таблице 17 показаны преимущества и недостатки каждого метода визуализации в оценке ЛР. Эхокардиографическая оценка ЛЖ должна включать (1) характеристику типа и размера протеза; (2) наличие соответствующих анатомических аномалий, таких как дегенерация или вегетации; (3) количественную оценку выраженности регургитации; и (4) любые изменения по сравнению с предыдущими оценками при серийных обследованиях. Кроме того, необходимо оценить размер ПЖ и положение и движение межжелудочковой перегородки во время диастолы. Как обсуждалось ранее, протезный легочный стеноз встречается чаще, чем регургитация, как при дегенерации, так и при эндокардите. Однако при наличии клапанного протока может возникать как стеноз протока, так и регургитация клапана (Рис. 23). Для помощи в оценке используют цветной, ИХ и НВ допплер (таблица 16). Цветная допплерография демонстрирует диастолический поток в ВТПЖ, а продолжительность и ширина струи помогают определить степень тяжести. Тяжелый ЛЖ имеет короткую продолжительность струи, поскольку диастолическое давление в ПЖ и ЛЖ быстро выравнивается, что затрудняет визуальную оценку ЛЖ. Ширина цветной струи >50% кольца протеза указывает на тяжелую ЛР. Эти параметры менее достоверны при эксцентрической и параклапанной регургитации. Реверсия потока в дистальном отделе ЛП при ИХ допплерографии свидетельствует о по крайней мере умеренной ЛР. Короткое время диастолического замедления также указывает на тяжелую ЛР, но это также зависит от комплаентности правого желудочка. В исследовании, в котором сравнивали СМР с эхокардиографией, ППД <95 мс и наклон >4,9 м/с2 указывали на необходимость вмешательства на легочном клапане.174 Существует ограниченное количество методов количественной оценки ЛР, которые можно экстраполировать на протезированные клапаны. Сравнение ударного объема, полученного чуть ниже ЗЛК, и ударного объема, полученного на аортальном или митральном клапане, может обеспечить измерение объема и фракции регургитации (при отсутствии АР или МР соответственно). Фракция регургитации <30% считается легкой, а >50% – тяжелой.1
Таблица 16 Эхокардиографическая оценка тяжести регургитации протезированного легочного клапана
| Параметры | Легкая | Средняя | Тяжелая |
| Структура клапана | Обычно нормальная | Аномальная или дедисцизия клапана или дедисцизия клапана | Аномальная или дедисцизия клапана или дедисцизия клапана |
| Размер ПЖ | Нормальный или расширенный | Нормальный или расширенный | Дилатятоване або прогресуюче розширенння† |
| Величина потока по цветовой допплерографии (центральные струи) | Тонкий с узким началом; ширина потока #25% от легочного кольца | Средняя; ширина потока 26% – 50% от легочного кольца | Обычно большая, с широким началом; ширина потока>50% легочного кольца; может быть короткой по продолжительности |
| Плотность потока по данным НВ допплера | Неполный или слабый | Плотный | Плотный |
| Скорость замедления потока по данным НВ допплера | Медленное снижение скорости потока | Вариабельное снижение скорости потока | Резкое замедление, § раннее прекращение диастолического потока |
| Легочный систолический кровоток по сравнению с системным кровотоком по данным ИХ допплерографии{ | Незначительное увеличение | Среднее увеличение | Значительное увеличение |
| Реверсия диастолического потока в дистальном отделе магистральной ЛА | Нет | Имеется | Имеется |
Адаптировано по Zoghbi и соавт. 1 *Если не существует другой причины дилатации ПЖ, включая остаточную послеоперационную дилатацию. † Если нет других причин для исходного расширения ПЖ. Острая ЛЖ является исключением. Перегрузка объемом ПЖ обычно сопровождается типичным парадоксальным движением перегородки. При пределе Найквиста 50-60 см/сек; параметр касается центральных струй, а не эксцентрических струй. § Резкое замедление не является специфическим для тяжелой ЛЖ, поскольку может возникать при тяжелой диастолической дисфункции ПЖ. {Значение объема и фракции регургитации недостаточно обоснованы.
Таблица 17 Оценка протезированного легочного клапана и мультимодальная визуализация: преимущества и ограничения
| Эхокардиография | СМРТ | КТ | |
| Первичная недостаточность клапана | Преимущества Качественная оценка регургитации/стеноза Оценка пиковых/средних градиентов Оценка гемодинамики ЛЖ Ограничения Сложность коаксиального доступа при ЗЛК Сложность оценки стеноза ПЖ | Преимущества Пространственное разрешение Количественная оценка стеноза/регургитации Количественная оценка объема/функции ПЖ Анатомическая визуализация ЛА/бифуркации Ограничения Некоторые клапаны могут создавать артефакты | Преимущества Пространственное разрешение Визуализация створок при стенозе Оценка кальцификации клапана/провода Анатомическая визуализация ЛА/бифуркации Ограничения Оценка регургитации Отсутствует оценка гемодинамики Использование излучения/контраста |
| Тромбоз / паннус | Преимущества Качественная оценка регургитация/стеноз Оценка пиковых/средних градиентов Оценка гемодинамики ПЖ Ограничения Трудно визуализировать структуру клапана | Не идеально подходит для оценки | Преимущества Хорошая визуализация и пространственное разрешение Дифференцирует тромб и паннус Ограничения Излучение / контраст |
| Эндокардит | Преимущества Временное разрешение Качественная оценка регургитации/стеноза Ограничения Зависит от акустических окон | Не идеально подходит для оценки небольших вегетаций | Не идеально подходит для оценки небольших вегетаций |
- Роль ТЭЭ и 3D: Использование ТЭЭ, описанное ранее в разделе о легочном стенозе, может помочь оценить тяжесть ЛР (табл. 17).3 Протезированные клапаны могут иметь кальцификаты и тромбы, которые лучше визуализируются с помощью ТЭЭ. Оценка ЛР с помощью 3D-ТЕЭ также может быть достигнута с помощью 3D в реальном времени, 3D-зума или мультипланарной реконструкции. Дополнительным преимуществом 3D-ТЕЭ является возможность увидеть клапан вплотную к регургитационному отверстию.26 ВСЭ может быть учтено при оценке ЗЛК, когда ТЭЭ является неубедительной.166,167
iii. Роль КТ: Хотя КТ можно использовать для выявления подвижности створок и наличия пролапса, ее временное разрешение ограничено. Кроме того, хотя было продемонстрировано, что анатомическая область регургитационного отверстия является полезным инструментом для количественной оценки АР, исследований в отношении ЛР нет. Однако КТ может быть полезной для точной локализации и определения размеров ПВУ.78
- роль СМРТ: Преимуществом СМРТ для оценки регургитации является количественная оценка с помощью фазово-контрастной визуализации (Рис. 24).169 СМРТ превосходит эхокардиографию для количественной оценки ЛР.168 На основе измеренной фракции регургитации тяжесть ЛР считается легкой при <26%, умеренной при 26-35% и тяжелой при >35%.175 Другие исследователи считают фракцию регургитации >40% тяжелой.176 На фазово-контрастную КМР не влияют множественные или эксцентричные струи. При необходимости сквозная плоскость может быть размещена за пределами клапанного артефакта. Более новые последовательности, такие как 4D поток, могут быть использованы для лучшего понимания направления потока и количественной оценки регургитации, однако их надежность на данный момент не доказана. Кроме того, количественное определение объемов ПЖ является важным для оценки ЛР и лучше всего оценивается с помощью СМРТ.
Таблица 18 Эхокардиографические параметры, необходимые для комплексной оценки протезирования ТК
| Стандартные параметры | Размер и тип протеза, а также дата имплантации |
| 2D или 3D визуализация или визуализация в 3D | Частота сердечных сокращений и артериальное давление Утолщение/подвижность стенки Механическая подвижность окклюдера Наличие тромба, вегетации или паннуса Стабильность/расшатывание протеза |
| Цветной допплер | Расположение потока регургитации (центральное, эксцентрическое или паравертебральное) Проксимальное место конвергенции потока, радиус Струя регургитации ВК Площадь струи регургитации |
| НВ Допплерография | Пиковый и средний диастолический градиент ППД ДИС (ИСВ ПрТВ/УО ВТЛЖ) ЭПО Пиковая скорость ТР Контур и плотность ТР |
| Родственные камеры сердца | Размер и функция ПП, ПЖ Размер и дыхательные вариации ИВК Профиль печеночного кровотока в печеночных венах |
Рисунок 25 Трансторакальная (A, B) и транспищеводная (C, D) визуализация пациента с тяжелым биопротезным стенозом ТК. (А) Цветное сравнительное диастолическое изображение, показывающее кальцинированные и ограниченные створки (желтая стрелка) с турбулентным диастолическим потоком. НВ допплерография (Б) показывает пиковую скорость 3,0 м/с со средним градиентом 20 мм рт.ст. Чреспищеводное систолическое изображение показывает сопутствующую ТР (красные стрелки) в условиях заметно ограниченной подвижности створки биопротеза. Трехмерная визуализация подтверждает выраженное ограничение всех трех створок с малым диастолическим отверстием (синяя стрелка). RA – правое предсердие; RV – правый желудочек.
Таблица 19 Допплеровские показатели, свидетельствующие о стенозе протезированного ТК
| Биопротез | Механический | |
| Пиковая скорость Е, м/с) | ≥2.1 | ≥1.9 |
| Средний градиент, мм рт. ст. | ≥9 | ≥6 |
| ППД, мсек | ≥200 | ≥130 |
| ЭПО, см2 | <1.5 | <2.0 |
| ДИС (ИСВ ПрТК /ИСВ ВТЛЖ)* | ≥3.3 | ≥2.1 |
Ключевые моменты для оценки протезированных легочных клапанов и каналов
- Оценка протезированного легочного клапана требует понимания различных типов клапанов и клапанированных каналов, которые устанавливаются.
- Оценка с помощью эхокардиографии может потребовать внеосевого, нетрадиционного осмотра.
- Следует измерить и сообщить о пиковой скорости и среднем градиенте (и, возможно, ДИС), полученные с помощью допплерографии, если это возможно.
- При клапанной регургитации необходимо проводить цветное допплеровское исследование, спектральную допплеровскую регистрацию струи, обращая внимание на ее интенсивность и наклон.
- КТ и СМР позволяют лучше разграничить протезированные легочные клапаны относительно тромба и кальциноза. КТ особенно полезна для количественной оценки ЛР.
- Существует недостаточно данных по оценке ЛР в протезированных клапанах; имеющаяся информация в основном экстраполирована из оценки нативных клапанов.
V. ОЦЕНКА ПРОТЕЗИРОВАННЫХ ТРИКУСПИДАЛЬНЫХ КЛАПАНОВ
Оценка ТК находится в процессе развития, поскольку некогда «забытый» клапан привлек к себе большее внимание после того, как исследования естественной истории показали плохие результаты, связанные с прогрессирующим ухудшением заболевания.177,178. Учитывая современные рекомендации руководств,5 большинство ремонтов ТК или замен ТК (ЗТК) выполняют во время операции на левых отделах сердца, чаще всего только на митральном клапане.179 Почти 90% процедур ТК в США – это восстановление, при этом количество замен за последние десятилетия уменьшилось. Однако для изолированных процедур ТК замены продолжают преобладать, что, вероятно, связано с поздним выявлением изолированной болезни.180 Хотя большинство протезов ТК являются биопротезами, мета-анализы показывают, что существует одинаковый риск 30-дневной и поздней смертности, повторных операций и 5-летнего отказа клапана у пациентов с механическим и биологическим ЗТК.181. Некоторые исследователи показали, что скорость дегенерации биопротезов выше после 7 лет.182 Протезированные клапаны и протезные кольца имеют различные формы и способы выхода из строя. Хирургические биопротезы могут выйти из строя из-за протезного стеноза или регургитации. Средний промежуток времени между имплантацией трикуспидального биопротеза и возникновением дисфункции, требующей имплантации КВК, составлял 12 лет (диапазон 3-32 года).183 Лонгитюдные исследования восстановления ТК показали, что значительная рецидивирующая регургитация возникает в течение 5-7 лет после ремонта.184,185 В условиях стационарной смертности от 10% до 13%, связанной как с изолированной, так и с повторной операцией на ТК,180,186 транскатетерные варианты стали более распространенными для решения проблемы неисправности как нативного ТК, так и протезированного устройства.183,185,187,188 Оценка функции протезированного ТК, таким образом, включает оценку хирургического и транскатетерного ремонта и замены ТК, а также процедур КВК и клапана-в-кольце.
Рисунок 26 Пример биопротезирования ТК с выраженной регургитацией. ТЭЭ показывает множественные вегетации (красные стрелки, A и B) на биопротезе ТК, что приводит к выраженной регургитации (C). НВ допплер (D) показывает низкоскоростной плотный профиль с ранним систолическим пиком. ИХ допплерография печеночной вены (E) демонстрирует реверсию систолического потока (стрелки), что соответствует тяжелой регургитации. RA – правое предсердие; RV – правый желудочек.
A. Эхокардиографическая оценка протезирования
Функция ТК Для комплексной оценки ОТК необходима визуализация в нескольких плоскостях, при этом используют как 2D, так и 3D эхокардиографию (табл. 18). ТТЭ ОТК является особенно полезной из-за переднего расположения клапана. Для оценки родного ТК следует выполнять все стандартные плоскости визуализации.189 Скорость нативного и протезированного ТК изменяется в зависимости от продолжительности цикла и дыхания, поэтому при допплерографии следует получить несколько сердечных циклов.190,191. Для ИХ и НВ допплерографии необходимо усреднить по меньшей мере пять сердечных циклов при фибрилляции предсердий и синусовом ритме или провести измерения в состоянии апноэ.1 На ППД влияет частота сердечных сокращений, комплаенс камеры и условия нагрузки, поэтому его следует интерпретировать с осторожностью при использовании в качестве отдельного показателя функции ТК. Кроме того, расчет ЭПО на основе ППД переоценивает площадь ТК для биопротезированных клапанов по сравнению с методами, основанными на уравнении непрерывности, и не рекомендуется.192.
Новые рекомендации ASE по выполнению комплексной ТЭЭ перед структурным вмешательством на клапане предлагают стратегии для полной визуализации нативного ТК.193 В общем, эти же самые стратегии следует использовать для оценки протезированных ТК. Руководства предлагают стандартизированное отображение изображений для прямого осмотра нативного ТК, и такие же стандарты следует использовать для прямого осмотра протезированных клапанов ТК.26,194 Визуализация ТК с помощью ТЭЭ может быть более сложной, чем с помощью TTE, из-за положения клапана относительно пищевода (переднее и медиальное). Акустический шум от фиброзного тела сердца, а также материал протеза левой части сердца делает ТЭЭ из среднепищеводной проекции особенно проблематичной. Изображение с глубоких пищеводных или транспищеводных позиций датчика располагает датчик ближе к ТК и, следовательно, может устранить как затенение, вызванное структурами левого сердца, так и ослабление дальнего поля.92,194 Понимание этих ограничений может помочь определить оптимальную плоскость изображения для выявления специфических аномалий.68,195,196
B. Оценка стеноза протезированного ТК
- Эхокардиографическая оценка: ЗТК может выйти из строя рано или поздно после имплантации. Эхокардиографическая оценка функции протезированного ТК включает оценку параметров, перечисленных в таблице 18. Двумерные или трехмерные изображения, демонстрирующие утолщение и/или ограничение движения створок биопротеза или уменьшение экскурсии одного или нескольких механических дисков, являются очевидными признаками стеноза протеза. Стеноз также следует заподозрить при наличии суженной, измененной картины притока ТК при высокоскоростной цветной допплерографии (Рисунок 25). Дегенерация биопротезов ТК не является редкостью и случается у 0,4%-2,2% пациентов в год.197,198 Уровень свободы от дисфункции биопротезов ТК оценивается на уровне 66% через 5 лет.199 Механические протезы, как правило, становятся непроходимыми из-за тромбоза, паннуса или вегетации с частотой тромбозов от 0,5% до 3,3% пациентов в год.197,200,201 Средние значения градиента <6-9 мм рт.ст. ассоциируются с нормальной функцией биопротезов в широком спектре биопротезов.192 Аналогично, средний градиент <6 мм рт.ст. является маркером нормальной функции механического ТК.202 Следует подчеркнуть, однако, что есть несколько факторов, которые могут существенно влиять на средний градиент при отсутствии дисфункции протезированного клапана, включая меньший клапан и высокое исходное состояние. У пациентов, проходящих процедуру КвК или клапан-в-кольце, постимплантационный средний градиент >10 мм рт.ст. считается доказательством стеноза.203
Таблица 20 Эхокардиографические параметры для определения регургитации протеза ТВ: преимущества и ограничения
| Параметр | Преимущества | Ограничения |
| Морфология ТК (напр., повышенная подвижность створок, перфорация, дегисценция) | Аномалии должны быть выявлены, если присутствует тяжелая ТР | Влияет на настройки аппарата и физику ультразвука (например, глубина, акустический артефакт от протезного материала) |
| Размеры и функции ПП и ПЖ и ПЖ | Дилатация как правого предсердия, так и правого желудочка обычно наблюдается при значительной ТР Отсутствие дилатации ПЖ и ЛЖ свидетельствует об отсутствии тяжелого хронического ТР | Основная патология левых и правых отделов сердца, а также легочная гипертензия также могут вызвать дилатацию правых отделов сердца |
| Кровоток в НПВ и печеночной венах | При значительной ТР наблюдается дилатация НПВ и реверсия голосистолического потока в печеночной вене | После ЗТК часто наблюдаются изменения комплаенса RA, приводящие к притуплению печеночного венозного кровотока и/или позднего систолического разворота. Дилатация НПВ может наблюдаться и при других состояниях с высоким диастолическим давлением RA/RV |
| НВ Допплерография | Плотная систолическая спектральная регистрация с треугольной скоростью с ранним пиком свидетельствует о тяжелой ТР | Плотная систолическая спектральная регистрация с треугольной ранней пиковой скоростью свидетельствует о тяжелой ТР |
| Струя цветного допплера (размер, количество струй, расположение, эксцентриситет) | В режиме реального времени и быстро Большая центральная струя (площадь > 10 см2 ), что свидетельствует о тяжелой ТР | Влияет на настройки аппарата и физику ультразвука (например, глубина, акустический артефакт от протезного материала), а также гемодинамику Множественные и эксцентричные потоки труднее интерпретировать |
| ШВК | Быстрый ШВК ≥0,7 см в режиме реального времени свидетельствует о тяжелой ТР | Трудно оценить в струях с временной изменчивостью Ограниченная валидность для нескольких струй Ограниченная валидность для некруглой формы отверстия |
| Радиус ППИШ и ЭПРО* | Большая конвергенция потока (>0,9 см) свидетельствует о выраженной ЭПР < 0,2 см2 обычно легкой степени ТР; ≥0,4 см2 обычно ТР тяжелой степени | Может недооценивать тяжесть ТР при наличии нескольких струй, временной изменчивости или заметно асимметричной формы отверстия Влияние прибора на зону конвергенции потока ограничивает точность |
| Площадь ВК с помощью 3D планиметрии | Может быть самой точной оценкой ТР; однако, плохо обоснованной | Ограничения разрешения (осевого, бокового и временного), а также артефакты цветения Точность в неплоских отверстиях может быть ограниченной Трехмерная реконструкция каждого отверстия занимает много времени Может потребоваться временное усреднение |
НПВ, нижняя полая вена; ППИШ, площадь поверхности проксимальной изовекторной скорости; ШВК, ширина ВК. *Недостаточно валидизировано для количественного определения в ЗТК; для ППИШ смещение базовой границы Найквиста до 25-35 см/сек.
При отсутствии тахикардии обструкцию ТК биопротеза подозревают, когда скорость Е-волны НВ допплера составляет 2,1 м/с, тогда как обструкцию механического протеза предполагают, когда скорость Е-волны составляет 1,9 м/с (табл. 19).191,192,204 Предыдущие руководства рекомендовали, что ППД <230 мс согласуется с отсутствием протезного стеноза.1 В серии из 285 биопротезов Blauwetet et al. 202 обнаружили, что ППД <200 мсек является показателем нормальной функции биопротеза на ранних стадиях после имплантации. Механические эндопротезы ТК, напротив, имеют более низкую нормальную точку среза ППД (<130 мсек). ППД не рекомендуется проводить при наличии закругленных спектральных допплеровских контуров, поскольку при таких обстоятельствах измерение ППД не может быть достоверным.205 Следует также отметить, что на ППД влияет как частота сердечных сокращений, так и комплаенс правого желудочка
Таблица 21 Эхокардиографическая градация ТР после восстановления ЗТК или ТК
| Параметры | Легкая | Средняя | Тяжелая |
| Качественные | |||
| Площадь цветного потока струи* | Маленькая, узкая, централизованная | Умеренная централизованная | Большой центральный поток или эксцентричный пристеночный поток (поток(ы)) переменного размера, закручивающийся в правом предсердии |
| Зона конвергенции потока† | Незаметная или малая | Промежуточная по размеру | Большая |
| ТР НВ Допплеровская кривая скорости (плотность и форма) | Слабая/частичная/параболическая | Плотная, параболическая или триангулярная | Плотная, часто триангулярная |
| Трикуспидальный приток | Доминанта А-волны | Вариабельно | Доминанта Е-волны |
| Полуколичественные | |||
| ВК ширина, см* | <0.3 | 0.3-0.69 | ≥0.7 or ≥2 умеренные струи |
| Радиус ППИШ, см† | 0.5 | 0.6-0.9 | >0.9 |
| Кровоток в печеночных венах | Систолическое доминирование | Систолическое притупление | Реверс систолического потока |
| Количественные показатели | |||
| ЭПР, см2§ | <0.20 | 0.20-0.39 | ≥0.40 |
| RVol, mL§ | <30 | 30-44 | ≥45 |
ППИШ, площадь поверхности проксимальной изовекторной скорости; RVol, объем регургитации.
*С границей Найквиста > 50-60 см/сек. † Недостаточно валидирован для количественной оценки в ЗТК; базовая граница Найквиста смещена до 25-35 см/сек. Неспецифический, зависит от других факторов (диастолическая функция ПЖ, фибрилляция предсердий, давление РА).
- Показатели ЭПР и RVol с 2D ППИШ потребуют дальнейшей валидации пороговых значений или с помощью ППИШ, или объемными методами.
Хотя предыдущие руководства предлагали использовать градиенты протезирования и ППД для оценки функции протезирования, ДИС (ДИС = ИСВ ПрТК/ИСВ ВТЛЖ) и ЭПО недавно были включены как часть комплексной допплеровской оценки ЗТК. ДИС, связанный с нормальной функцией биопротеза ТК, значительно варьирует в зависимости от типа и размера клапана, с верхними значениями от 2,4 до 3,6. 192 Аналогично, ДИС, связанный с нормальной функцией механического ТК, значительно варьирует в зависимости от типа и размера клапана, а верхние пределы колеблются от 2,3 до 2,8.202 ЭПО можно рассчитать путем деления ударного объема в ВТЛЖ на диастолический трикуспидальный протезный ИСВ.192,202 Этот метод является наиболее точным при легкой или меньшей ТР и АР, хотя нормативных данных недостаточно. Если есть значительная АР, объем прямого удара может быть измерен с помощью ВТПЖ.206
Таблица 22 Перечень анатомий ВПС, которые могут нуждаться в протезировании сердечного клапана после первичного хирургического вмешательства
| Анатомия ВПС | Хирургические вмешательства | Чрескожные вмешательства на клапанах | |
| Аортальный клапан | Выраженный аортальный стеноз Комплекс Шейна
Прерванная дуга аорты с малым аортальным кольцом Двустворчатый аортальный клапан Одностворчатый аортальный клапан Одностворчатый аортальный клапан |
Процедура Росса
Процедура Росса-Конно Процедура Ясуи Замена аортального клапана |
Баллонная вальвулопластика КвК ТИАК |
| Митральный клапан | Врожденный стеноз митрального клапана Парашютный митральный клапан Аркадный митральный клапан Шейн комплекс AVSD | Восстановление митрального клапана Восстановление AVSD Механическая замена митрального клапана | Баллонная вальвулопластика КвК (клапан Melody или Edwards SAPIEN) |
| ТК | АВСД Аномалия Эбштейна Дисплазия ТК Трикуспидальная атрезия | Ремонт ТК Реконструкция конуса Механическая ЗТК Процедура Бьорка | КвК (Клапан Melody) |
| Клапан легочной артерии | Транспозиция магистрального ствола артерии с обструкцией ВТЛЖ ТФ/легочная атрезия Врожденный стеноз клапана легочной артерии | ПЖ-в-ЛА кондуит Растелли операция Гомотрансплантат | Балонна вальвулопластика Клапан Melody Клапан Edwards SAPIEN Клапан Harmony Транскатетерний легеневий клапан |
AVSD, дефект атриовентрикулярной перегородки; ТФ, тетрада Фалло.
Допплеровские параметры, указывающие на протезированный стеноз ТК, приведены в таблице 19. Хотя высокие градиенты давления могут указывать на протезированный стеноз, высокие транспротезные градиенты могут также отражать НПП. Предложенные значения ЭПО для ТК НПП колеблются от <0,9 до 1,19 см2 /м2. 192,207В настоящее время отсутствуют данные о влиянии этих индексированных пороговых значений ЭПО на результаты в лонгитюдных когортах.
- Роль КТ: КТ может помочь в оценке стеноза ВТК путем измерения геометрической площади отверстия и определения этиологии стеноза. Она показывает такие этиологии, как дегенерация створки, аномальная подвижность створки или окклюдера диска, кальцификация кольца биопротеза, тромб, паннус или вегетация.150 Для КТ-оценки протезированного ТК необходимо адекватное помутнение РА и ПЗ с ограниченным артефактом смешивания. Этого можно достичь с помощью трехфазного протокола введения контраста и времени съемки для помутнения правого сердца, а не левого.208 Максимальную геометрическую площадь отверстия протезированного ТК можно измерить в диастолу, используя мультипланарную реконструкцию по короткой оси на кончике створки биопротеза.151 У механических клапанов, помимо геометрической площади отверстия, можно измерить углы открытия и закрытия.152 Необходимо тщательно рассмотреть эти измерения, поскольку геометрическая площадь отверстия при КТ является большей, чем ЭПО при ТТЭ, как и ожидалось.151
iii. Роль СМРТ: Протезированный трикуспидальный стеноз может быть количественно оценен на СМР с планиметрией геометрической площади отверстия на кинетическом изображении или пиковой скорости и градиента на сквозном контрастно-скоростном картировании. Артефакт чувствительности от металлического кольца и дискового окклюдера может ограничить визуализацию отверстия клапана, но его можно минимизировать с помощью последовательности градиент-эхо, а не последовательности ЗУП.209 Использование картирования сквозной плоскости скорости может быть ограниченным из-за артефакта чувствительности от кольца клапана или дискового окклюдера и кольцевого движения в положении ТК.
Таблица 23 Проблемы оценки протезированного клапана у пациентов с ВПС Плохая эхокардиограмма
| Плохие эхокардиографические окна из-за ◦ Предыдущих операций ◦ Деформации грудной клетки ◦ Артефакты от протезных материалов ◦ Размеры тела |
| Недооценка градиентов протезированного клапана/проводника из-за ◦ Наличие ассоциированных шунтов ◦ Серийные стенозы ◦ Эксцентрические потоки |
| Расчет ЭПО может быть ограничен ◄ Последовательными стенозами, которые влияют на использование уравнения непрерывности ◄ Нециркулярной формой ВТЛЖ или ВТПЖ, что влияет на расчет потока перед протезом ◄ Неточностью ИСВ у пациентов с субаортальным или субпульмональным стенозом, когда картина скорости потока перед обструкцией не является ламинарной. |
Длинные трубчатые сужения кондуитов будут влиять на градиент давления, рассчитанный по модифицированному уравнению Бернулли с использованием пиковой скорости потока
C. Оценка регургитации протезируемого ТК
- Эхокардиографическая оценка: ТР может быть как трансклапанным, так и параклапанным по происхождению, поэтому необходима тщательная оценка протезированной ТК из всех доступных окон. Регургитация после использования транскатетерного устройства при заболевании нативного ТК была рассмотрена в недавних руководствах3 и здесь не рассматривается. Как и для всех оценок клапанной регургитации с помощью эхокардиографии, для общей оценки ТР необходим интегративный подход с использованием цветного, ИХ и НВ допплеров (Рис. 26, Таблицы 20 и 21). Цветную допплерографию следует выполнять из нескольких трансторакальных эхокардиографических изображений для оценки тяжести ТР, обращая внимание на три компонента струйного потока – конвергенцию струи, ВК и направление струи – а также влияние струи на правое предсердие. Для компенсации акустического затенения от протезированного стента клапана или дисковых окклюдеров важно получить модифицированные изображения притока ПЖ и подреберья. Многочисленные исследования указывают на значительные недостатки использования только площади цветной допплеровской струи для оценки тяжести ТР.1,210 По возможности следует проводить количественные измерения. Однако количественное определение площади поверхности проксимальной изовеличины как нативного, так и протезного ТР клапана имеет ряд недостатков (например, низкий поток, неправильная форма отверстия, временная вариабельность), и лишь в нескольких исследованиях эта методика была валидирована при заболеваниях нативного или протезного клапана.211,212 Прогрессирующая дилатация камер сердца или изменения размера печеночной вены и ее кровотока во время дальнейшего наблюдения также могут свидетельствовать об изменении функции протезного клапана. Эхокардиографические критерии оценки тяжести ТР приведены в таблице 21. На цветном допплеровском изображении большая конвергенция потока, увеличенная ширина ТК (>0,7 см), ЭПР > 0,4 см2 и объем регургитации > 45 мл – все это указывает на тяжелую ТР. Плотная допплеровская трассировка НВ с треугольной скоростью с ранним пиком, а также повышенной трансклапанной диастолической пиковой скоростью и средним градиентом также указывает на тяжелый ТР. ДИС >3,3 на фоне повышенного трансклапанного градиента и нормального ППД помогает подтвердить наличие значительной ТР. Немногочисленные исследования показали целесообразность проведения 3D цветной допплеровской планиметрии участка ВК как с помощью TTE211, так и ТЭЭ при нативной патологии клапана.213 По сравнению с многопараметрической оценкой выраженной ТР, 3D отсечение площади ТК211,213 и допплеровское отсечение ЭПР почти вдвое превышает проксимальную площадь поверхности изовекторной скорости ЭПР.211 Вопрос о том, можно ли использовать эти методы для оценки протезированных клапанов, требует дальнейшего изучения.
- Роль СМРТ: СМРТ может оценить состояние правого желудочка в условиях ТР благодаря своей способности количественно определять объемы ПЖ и фракцию выброса без геометрических предположений.5 Хотя в настоящее время нет опубликованных данных о протезированных ТР, используемые подходы аналогичны тем, что применяются для нативных ТР. Как правило, количественная оценка объемов регургитации с помощью СМР опирается на фазово-кодированные по скорости фазово-контрастные изображения для измерения прямого потока через легочный клапан с последующим вычитанием этого объема от общего объема удара ЛЖ, измеренного с помощью короткоосевой планиметрии с использованием нескольких дисков. Этот количественный подход продемонстрировал умеренную согласованность с многопараметрическим эхокардиографическим подходом при нативном ТР.214 Недавнее исследование, в котором использовали СМР для оценки результатов при нативном функциональном ТР, показало, что как объем регургитации, так и фракция регургитации ассоциируются с повышенной смертностью после поправки на клинические и визуализационные коварианты, включая фракцию выброса ПЖ.215. Хотя риск прогрессировал с увеличением объема ТР и фракции регургитации, объем ТР 45 мл или фракция регургитации 50% определяли пациентов в страте самого высокого риска смертности. Конкретные пороговые значения CМР для вмешательства при протезировании ТР не установлены.
iii. Роль КТ: Роль КТ при регургитации протезированного ТК подобна роли КТ при протезированном МР. Чрезмерное раскачивание протеза во время сердечного цикла наблюдается при клапанной дегидратации, при этом можно идентифицировать и локализовать значительные ПВУ. Небольшие ПВУ могут быть скрыты из-за металлических артефактов от протезного кольца или дисковых окклюдеров. Роль КТ в настоящее время заключается прежде всего в том, чтобы помочь в планировании транскатетерных вмешательств ТК.216
Ключевые моменты для оценки протезирования ТК
- Комплексная оценка ЗТК требует нескольких плоскостей визуализации, в которых используются 2D и 3D и допплеровская эхокардиография для оценки структуры и функции клапанов, а также размера и функции правых камер сердца. Из-за затенения и маскировки потока в правом предсердии, особенно при механических ТК, скрининг на ТР должен включать модифицированные изображения притока ПЖ и подреберных видов, а также ИК допплеровское исследование кровотока в печеночных венах, где это возможно.
- Из допплерографических записей протезированных ТК следует измерять пиковую скорость, средний градиент, ППД и частоту сердечных сокращений и сообщать о них, когда это возможно. Существует меньше опыта в отношении ЭПО и ДИС ЗТК.
- Несколько факторов могут влиять на средний градиент ТК при отсутствии дисфункции протезированного клапана, включая частоту сердечных сокращений, поток, размер и тип протеза; учитывая эти факторы, мы предлагаем использовать специфические для типа протеза отсекатели для определения стеноза протезированного ТК.
- Необходим многопараметрический эхокардиографический подход для оценки регургитации протезированного ТК, поскольку валидация количественных методов недостаточна.
- СМР может быть полезным для количественной оценки объема и фракции регургитации, однако валидация его использования при протезированной функции клапана отсутствует.
- КТ является полезной для выявления механизмов клапанной дисфункции, локализации значительных ПВУ и необходима при планировании чрескожных вмешательств на ТК.
Рисунок 27 Чреспищеводное эхокардиографическое изображение из глубокого трансгастрального окна на высоте около 60 см у пациента, перенесшего процедуру Росса по поводу инфекционного эндокардита, демонстрирует сердечные структуры, окружающие легочный гомотрансплантат (А). Увеличенные глубокие трансгастральные изображения с цветным допплеровским сканированием демонстрируют ускорение кровотока в гомотрансплантате (В). Изображение с высоты пищевода под углом около 130 обеспечивает четкий обзор листков гомотрансплантата (красные стрелки, С), с ограниченным движением (D) и ускорением потока через листки по данным цветной допплерографии (Е). НВ допплер (F) измеряет пиковый и средний систолический градиенты 52 и 30 мм рт.ст. соответственно. Пациенту выполнили хирургическую замену легочного клапана на протез Sorin; показано 3D-изображение клапана (G).
VI. ОЦЕНКА ПРОТЕЗИРОВАНИЯ КЛАПАНОВ ПРИ ВПС
A. Протезирование клапанов при ВПС
Появление интервенционных транскатетерных подходов к установлению ПКС принесло пользу многим пациентам с ВПС. У детей с клапанными пороками предпочтение отдается восстановлению, а не замене, поскольку НПП неизбежны по мере роста ребенка. Баллонная вальвулопластика является первой линией лечения врожденного клапанного стеноза, и некоторым пациентам перед заменой клапана имплантируют КвК в соответствующую атриовентрикулярную или полулунную позицию с использованием чрескожного доступа.217 Это позволяет пациентам расти до того, как им установят механические клапаны после неудачного ремонта.218,219 Оценка ПКС при ВПС с использованием описанного в этом документе подхода у взрослых в целом является эффективной, хотя существуют определенные ограничения и различия, которые описаны ниже. В таблице 22 перечислены все поражения ВПС, которые могут потребовать хирургического и/или чрескожного вмешательства по поводу ПКС. Использование 2D и 3D эхокардиографии, СМРТ и КТ разграничено в оценке ПКС у подростков и взрослых с ВПС.
Таблица 24 Использование 3D эхокардиографии у пациентов с ВПС*.
| Регион, который интересует | 3D модальность | Информация | Целесообразность |
| Аортальный клапан | СШ/цветная допплерография ТТЗ: PLAX, PSAX, апикальная ТЭЭ: ME 60, 120 | Вид/движение створки протезированного клапана Происхождение регургитации Улучшенное измерение площади ВТЛЖ | Умеренная |
| Митральный клапан | СШ/цветная допплерография: PLAX, PSAX, апикальная ТЭЭ: ME 0, 90, 120 | Вид/движение створки протезированного клапана Возникновение регургитации | Высокая |
| ТК | СШ/цветная допплерография: апикальный, приток ПЖ, субкостальный ТЭЭ: МЭ 0, 40-60, трансжелудочная | Вид/движение створки протезированного клапана Возникновение регургитации | Умеренная |
| Легочный клапан/легочные гомотрансплантаты | СШ/цветная допплерография: ТЭЭ: PSAX ТЭЭ: высоко пищеводная 0-40, транспищеводная | Внешний вид/движение створки протезированного клапана Происхождение регургитации Улучшение измерения площади ВТПЖ | Низкая |
СШ, серошкальная; ME, средостение; PLAX, парастернальный вид по длинной оси; PSAX, парастернальный вид по короткой оси. *Издано по Simpson и соавт. 224
B. Эхокардиография при оценке ПКС, ассоциированных с ВПС
Эхокардиография является основным неинвазивным методом визуализации, который используется для оценки протезированных клапанов у пациентов с ВПС. Она позволяет оценить как функцию клапана, так и гемодинамическое влияние дисфункции клапана на левый и/или правый желудочки. Комплексная эхокардиографическая оценка включает 2D и 3D трансторакальную или чреспищеводную визуализацию с использованием цветного, НВ и ИК допплера.164 Она также может включать исследование с перемешанным физиологическим раствором, препаратами, усиливающими ультразвук, и стресс-эхокардиографию. Одним из самых важных шагов перед визуализацией пациента с ВПС умеренной или большой сложности является понимание потока крови через сердце, чтобы определить, какие изображения необходимы. Это требует понимания оригинальной анатомии сердца и изменений, внесенных хирургическим вмешательством или чрескожным вмешательством. Информация по классификации ВПС доступна в рекомендациях Американского колледжа кардиологии и Американской ассоциации сердца по ВПС у взрослых.217
- ТТЭ: Опубликовано несколько руководств и рекомендаций по ТТЭ у пациентов с ВПС. Они включают общий трансторакальный эхокардиографический протокол Международного общества врожденных пороков сердца у взрослых.220 Также ASE опубликовала рекомендации по мультимодальной визуализации для пациентов с тетрадой Фалло и транспозицией крупных артерий.170,221 Вызовы при визуализации и оценке протезированных клапанов у пациентов с ВПС суммированы в Таблице 23. Трансторакальные эхокардиографические изображения пациентов с ВПС могут быть неоптимальными из-за размеров тела, деформации грудной стенки и многочисленных хирургических вмешательств. Артефакты от протезных материалов и клапанов являются дополнительными препятствиями для получения интерпретированных эхокардиографических изображений. Часто требуются внеосевые и нетрадиционные окна визуализации. В частности, структуры правого сердца могут быть сложными для визуализации из-за их расположения. Например, правосторонние каналы (например, ПЖ-ЛА или ПП-ПЖ) расположены спереди и могут находиться за грудиной. Значительные градиенты в этих проводящих путях могут быть пропущены, если изображение не оптимизировано. Для определения их расположения можно использовать цветное картирование потока.220 Для улучшения визуализации ПП-ПЖ или легочных клапанов можно попробовать использовать ракурсы, которые не часто получают, например, наклоненное кпереди изображение в верхушечном окне. Более высокая частота сердечных сокращений у пациентов детского возраста может вызвать низкую частоту кадров, что можно исправить с помощью эхокардиографии в М-режиме. Если изображения неадекватны, следует рассмотреть возможность проведения ТЭЭ (см. следующий раздел). Кроме того, рекомендуется использование ультразвукового усилителя для улучшения оценки размера и функции камер сердца. Изменения могут указывать на возможную дисфункцию протезированного клапана/проводника и требовать дальнейшей визуализации с помощью СМР или КТ. Кроме качества эхокардиографического изображения, оценка протезированных клапанов у пациентов с ВПС может быть затруднена сосуществованием нескольких уровней обструкции и наличием дополнительных шунтов. Серийные стенозы влияют на применение уравнения непрерывности для определения ЭПО. Например, на измерение градиента давления через клапан в канале ПЖ-ЛА будет влиять наличие стеноза. Стресс-эхокардиография: систола распространяется на правую или левую ЛА. Наличие дополнительных шунтов, как нелеченных, так и остаточных после лечения, будет влиять на градиенты потока и давления, а следовательно, и на расчет ЭПО.
- Стресс-эхокардиография: Использование стресс-эхокардиографии на нативных и протезированных клапанах хорошо известно.60 Современные рекомендации Европейской ассоциации сердечно-сосудистой визуализации и ASE по клиническому использованию стресс-эхокардиографии при неишемических заболеваниях сердца включают описание ее применения у пациентов с ВПС.60 Пациентам с ВПС с протезированными клапанами или клапанными кондуитами можно проводить стресс-эхокардиографию для оценки симптомов, способности к физической нагрузке, дисфункции желудочков и сократительного резерва, а также легочной сосудистой реакции.217,222,223 Важно, что тестирование с физической нагрузкой можно использовать для улучшения ранней диагностики и вмешательства.
iii. ТЭЭ: ТЭЭ преимущественно используется, когда трансторакальная визуализация недостаточна для оценки функции протезированного клапана. Однако она также показана, когда есть беспокойство относительно инфекционного эндокардита протезированного клапана, необходимости повторной оценки клапана после лечения тромбоза или инфекции, или для планирования хирургических или чрескожных вмешательств на клапане. ASE опубликовала руководство по выполнению ТЭЭ у пациентов с ВПС.164 Подобно ТТЭ, некоторые виды чреспищеводной эхокардиографии необходимо модифицировать для тщательной оценки протезированного клапана/проводника у пациентов с ВПС (Рис. 27).
- Трехмерная эхокардиография: У пациентов с хорошими акустическими окнами трехмерная эхокардиография может предоставить ценную анатомическую информацию. Она также может улучшить оценку тяжести клапанной дисфункции и количественную оценку объемов ЛЖ, ПЖ и ударного объема.224 В 2017 году было опубликовано консенсусное заявление экспертов по использованию 3D-эхокардиографии у пациентов с ВПС.224 В таблице 24 подытожена целесообразность ее проведения у пациентов с ВПС. Следует отметить, что пациентам со сложным анатомическим строением, вероятно, понадобится многоканальное сканирование для получения набора данных, который охватывает протез клапана, кондуит и прилегающие структуры, необходимые для ориентации с адекватным пространственным и временным разрешением. Это также может потребоваться для получения высококачественных цветных 3D-изображений.
C. Роль КТ сердца
КТ с 4D визуализацией является полезным дополнительным методом оценки ПКС у пациентов с ВПС. КТ может быть особенно полезной у пациентов с ВПС по следующим причинам: (1) положение ПКС не всегда поддается оценке с помощью традиционных эхокардиографических окон ввиду многочисленных предыдущих хирургических вмешательств, атипичной анатомии или необычного расположения (напр, канал ПП-в-ПЖ при процедуре Bjork); (2) клапаны могут быть размещены внутри каналов у пациентов с ВПС (например, канал ПЖ-в-ЛА), что затрудняет оценку из-за расположения и артефактов, связанных с каналом; и (3) потенциальное наличие множественных последовательных обструкций, что затрудняет допплеровскую оценку. Потенциальные причины дисфункции ПМК у пациентов с ВПС подобны таковым у пациентов без ВПС. Как только повышенный градиент или клапанная регургитация обнаружены с помощью эхокардиографии или клинически заподозрены, можно рассмотреть возможность проведения КТ. Для оценки причины повышенного градиента на механическом протезе клапана может быть достаточно неконтрастной КТ (особенно в контексте почечной дисфункции) с ретроспективным гейтингом, чтобы оценить движение окклюдеров.
Неконтрастная КТ может также выявить наличие перелома стента клапана (например, от транскутанных легочных клапанов) и периклапанной кальцификации, а также помочь дифференцировать залоги от потенциальных ПВУ, которые могут способствовать увеличению трансклапанных градиентов. Если есть подозрение на тромбоз клапана, образование паннуса, вегетации или дисфункцию биопротеза клапана, следует выполнить ретроспективную КТ с контрастированием. Место введения контраста (правая рука, левая рука, нога) должно быть тщательно определено на основе знаний анатомии вен. Конкретные сценарии, в которых КТ сердца является полезной у пациентов с ВПС для оценки ПКС за пределами их обычной локализации, включают оценку клапанных протоков (например, тетрада Фалло) или чрескожного клапана в проточке от ПЖ к ЛА (напр, клапан Melody172), клапан в протоке ПП-в-ПЖ (процедура Bjork), чтобы дифференцировать стеноз края протока от клапанной дисфункции и выявить наличие сопутствующего суб- или надклапанного стеноза (например, стеноза ветви ЛА; Рис. 24).
При этих специфических показаниях, учитывая правостороннюю локализацию этих аномалий, время получения изображения относительно введения контраста должно максимизировать присутствие контраста в правосторонних структурах. С этой целью могут быть полезными трехфазные инъекции.172 Следует выполнить ретроспективное вентилируемое исследование для оценки динамической природы протезированного клапана и подвижности 42 Zoghbi et al Journal of the American Society of Echocardiography январь 2024 стента с клапаном, если это возможно. Оценить регургитацию клапана напрямую невозможно из-за нехватки данных о потоке, однако ретроспективное вентильное исследование может выявить наличие качания клапана. Если расслоение четко выражено, КТ может охарактеризовать его локализацию, длину и ширину, что позволит планировать потенциальные чрескожные процедуры. Кроме того, в контексте заболевания одного клапана можно измерить ударные объемы ПЖ и ЛЖ для количественной оценки объема и фракции регургитации. Важным ограничением КТ является потенциальная возможность возникновения артефактов затвердевания луча или “цветения”, которые влияют на точность диагностики, особенно в контексте нескольких клапанов, стентов, катушек и проводников кардиостимулятора. Их следует тщательно избегать, когда это возможно, используя описанные выше методы.
D. Роль СМРТ
СМР широко используется как для предоперационной, так и для послеоперационной оценки простых и сложных ВПС. Преимуществом СМРТ при ВПС является ее способность (1) визуализировать клапан в плоскостях, которые могут быть сложными для эхокардиографии, например, за грудиной; (2) обеспечить количественную оценку камер; (3) оценить анатомию магистральных сосудов и каналов с помощью 3D магнитно-резонансной ангиографии с контрастированием; и (4) охарактеризовать ткань для комплексной оценки функции клапана.225 В проспективной оценке случаев самым распространенным методом ГКР при ВПС было ЗЛК, за которым следовали замена аортального клапана и гомо- или аутотрансплантат.226 На сегодняшний день существует недостаточно опубликованной литературы, посвященной именно ГКР при ВПС.
Использование СМР в этой популяции экстраполируется из литературы, в первую очередь, в отношении нативных клапанов, которые подобны гомо- или аутотрансплантатам, а также из данных хирургических протезов, как обсуждалось выше.124 Использование как 1,5-, так и 3-Т магнитов СМР является безопасным у пациентов со всеми типами ПКС. Оценивая, какую силу магнита использовать в ВПС, важно учитывать другие вмешательства, которые могли быть проведены пациенту, например, сосудистые пробки, катушки, кардиостимуляторы или дефибрилляторы, которые могут требовать использования магнита 1,5 Т или быть противопоказанными для СМРТ. Для оценки морфологии и движения створок и разграничения протезной и перипротезной регургитации можно использовать различные последовательности, как описано выше (рис. 8), дополняющие эхокардиографию.
Фазово-контрастное картирование скорости может измерять скорость и поток через определенный плоский срез (Рис. 24).124 При выполнении фазового контрастирования, в зависимости от отсутствия сигнала, возникающего при ПКС, оценка может быть размещена на 0,25-0,4 мм ниже по течению от ПКС. Кроме того, усиленная контрастированием тканевая характеристика легочных кондуитов отмечается при стенозе и коррелирует с воспалением и фиброзом кондуита. Четырехмерная потоковая КТ – это более новая модальность, которая позволяет комплексно исследовать поток в сердце и сосудах грудной клетки во всех трех пространственных направлениях. Эта методика позволяет визуализировать поток, количественно оценить поток и расширенные гемодинамические параметры, включая напряжение сдвига стенки и оценку кинетической энергии. В ВПС 4D-потоки изучали у пациентов с d-транспозицией крупных артерий с артериальным переключателем, у которых может развиться нео-АР и надклапанный легочный или аортальный стеноз в области анастомоза.
Исследования показывают увеличение асимметричного потока в передней главной ЛА, лучшую визуализацию надклапанного легочного стеноза и асимметричное напряжение стенки в дистальном отделе восходящей аорты.227 Calkoen и соавт. 228 исследовали пациентов с дефектом атриовентрикулярной перегородки после коррекции, которая может включать хирургическое вмешательство на митральном клапане, и показали способность 4D-потока точно количественно оценивать и визуализировать эксцентрическую регургитацию левого атриовентрикулярного клапана. Эти результаты могут помочь понять осложнения, с которыми эти пациенты могут столкнуться в долгосрочной перспективе.228
Ключевые моменты для оценки протезирования клапанов при ВПС
- Оценка протезированных клапанов при ВПС может потребовать модификации стандартных трансторакальных и чреспищеводных эхокардиографических изображений.
- Для оценки ПКС при ВПС необходимо понимание различных анатомических особенностей ВПС, каналов и гемодинамики.
- Трехмерная эхокардиография может предоставить ценную анатомическую информацию и визуализацию ПКС при ВПС.
- КТ и КМС предоставляют дополнительные средства визуализации ПКС при ВПС.
VII. ВЫВОДЫ И БУДУЩИЕ НАПРАВЛЕНИЯ
Эхокардиография является методом визуализации выбора для начальной оценки и лечения ПКС. Для оценки структуры и функции клапана, а также степени обратного ремоделирования камер сердца после чрескожной или хирургической замены клапана необходим комплексный подход. Цветная и спектральная допплерография играют центральную роль в оценке функции протезированного клапана и связанных с этим осложнений. В общем, оценка функции протезированных клапанов является более сложной, чем нативных клапанов, из-за неоптимальной визуализации структуры протезированного клапана и окклюдерных устройств с помощью TTE и присущей вариабельности гемодинамики клапана и площади отверстия, что наблюдается при широком диапазоне типов и размеров протезированных клапанов. Таким образом, документирование типа и размера установленного клапана или кондуита является первоочередным в оценке протезированных клапанов. Кроме того, серийное сравнение с базовым послеоперационным исследованием имеет важное значение для точной оценки функции клапана. У пациентов с подозрением на дисфункцию протезированного клапана часто необходима расширенная визуализация для определения механизма дисфункции или тяжести регургитации, особенно в механических клапанах. В дополнение к традиционной роли 2D и 3D ТЭЭ в оценке дисфункции клапанов, КТ и СМР стали мощными методами визуализации, которые дополняют эхокардиографию.
КТ предлагает изображения с высоким разрешением с особым преимуществом для механических клапанов, в то время как основным преимуществом СМРТ является количественная оценка выраженности регургитации. Таким образом, роль визуализации значительно расширилась со времени появления первого документа ASE по протезированию клапанов в 2009 году. Выбор расширенного метода визуализации, если он необходим после первичной ТТЭ, должен быть тщательно взвешенным, поскольку каждый метод имеет свои преимущества и ограничения. Этот выбор лучше всего согласовывать с клиническим состоянием пациента, типом и положением протезированного клапана, а также подозреваемым основным состоянием обструкции и/или регургитации. Цели будущих исследований будут включать улучшение автоматизированной количественной оценки выраженности регургитации с помощью цветного и спектрального допплера, увеличение временного разрешения КТ и СМРТ, а также уменьшение артефактов от металлических конструкций, что улучшит визуализацию клапана.
Ссылки на источники
- Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultra- sound: a report from the American Society of Echocardiography’s guide- lines and standards Committee and the Task force on prosthetic valves, developed in conjunction with the American College of Cardiology Car- diovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiog- raphy, a registered branch of the European Society of Cardiology, the Jap- anese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echo- cardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 2009;22:975-1014; quiz 1082-4.
- Lancellotti P, Pibarot P, Chambers J, et al. Recommendations for the im- aging assessment of prosthetic heart valves: a report from the European association of cardiovascular imaging endorsed by the Chinese Society of Echocardiography, the inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardi- ovasc Imaging 2016;17:589-90.
- Zoghbi WA, Asch FM, Bruce C, et al. Guidelines for the evaluation of valvular regurgitation after percutaneous valve repair or replacement: a report from the American society of echocardiography developed in collaboration with the society for cardiovascular angiography and inter- ventions, Japanese Society of Echocardiography, and Society for Cardio- vascular Magnetic Resonance. J Am Soc Echocardiogr 2019;32:431-75.
- Goldstone AB, Chiu P, Baiocchi M, et al. Mechanical or biologic prosthe- ses for aortic-valve and mitral-valve replacement. N Engl J Med 2017; 377:1847-57.
- Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. J Am Coll Cardiol 2021;77: e25-197.
- Alkhouli M, Alqahtani F, Simard T, et al. Predictors of use and outcomes of mechanical valve replacement in the United States (2008-2017). J Am Heart Assoc 2021;10:e019929.
- Eug`ene M, Duchnowski P, Prendergast B, et al. Contemporary manage- ment of severe symptomatic aortic stenosis. J Am Coll Cardiol 2021;78: 2131-43.
- Halkos ME, Puskas JD. Are all bileaflet mechanical valves equal? Curr Opin Cardiol 2009;24:136-41.
- Yang B, Malik A, Farhat L, et al. Influence of age on longevity of a stentless aortic valve. Ann Thorac Surg 2020;110:500-7.
- Windecker S, Okuno T, Unbehaun A, et al. Which patients with aortic ste- nosis should be referred to surgery rather than transcatheter aortic valve implantation? Eur Heart J 2022;43:2729-50.
- Hahn RT, Leipsic J, Douglas PS, et al. Comprehensive echocardiographic assessment of normal transcatheter valve function. JACC Cardiovasc Im- aging 2019;12:25-34.
- Kunadian B, Vijayalakshmi K, Thornley AR, et al. Meta-analysis of valve hemodynamics and left ventricular mass regression for stentless versus stented aortic valves. Ann Thorac Surg 2007;84:73-8.
- Varc-3 Writing C, Genereux P, Piazza N, et al. Valve academic research Consortium 3: updated Endpoint definitions for aortic valve clinical research. J Am Coll Cardiol 2021;77:2717-46.
- Butany J, Collins MJ, Nair V, et al. Morphological findings in explanted Toronto stentless porcine valves. Cardiovasc Pathol 2006;15:41-8.
- Vongpatanasin W, Hillis LD, Lange RA. Prosthetic heart valves. N Engl J Med 1996;335:407-16.
- Barbetseas J, Nagueh SF, Pitsavos C, et al. Differentiating thrombus from pannus formation in obstructed mechanical prosthetic valves: an evalua- tion of clinical, transthoracic and transesophageal echocardiographic pa- rameters. J Am Coll Cardiol 1998;32:1410-7.
- Ueda T, Teshima H, Fukunaga S, et al. Evaluation of prosthetic valve obstruction on electrocardiographically gated multidetector-row computed tomography–identification of subprosthetic pannus in the aortic position. Circ J 2013;77:418-23.
- Habib G, Hoen B, Tornos P, et al. Guidelines on the prevention, diag- nosis, and treatment of infective endocarditis (new version 2009): the Task force on the prevention, diagnosis, and treatment of infec- tive endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and In- fectious Diseases (ESCMID) and the International Society of Chemo- therapy (ISC) for infection and Cancer. Eur Heart J 2009;30: 2369-413.
- Afridi I, Apostolidou MA, Saad RM, et al. Pseudoaneurysms of the mitral- aortic intervalvular fibrosa: dynamic characterization using transesopha- geal echocardiographic and Doppler techniques. J Am Coll Cardiol 1995;25:137-45.
- Kouchoukos NT, Wareing TH, Murphy SF, et al. Sixteen-year experience with aortic root replacement. Results of 172 operations. Ann Surg 1991; 214:308-18. discussion 318-20.
- Summers MR, Leon MB, Smith CR, et al. Prosthetic valve endocarditis after TAVR and ХЗАК: insights from the PARTNER trials. Circulation 2019;140:1984-94.
- Roudaut R, Serri K, Lafitte S. Thrombosis of prosthetic heart valves: diag- nosis and therapeutic considerations. Heart 2007;93:137-42.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Bioprosthetic valve thrombosis versus structural failure: clinical and echocardiographic predictors. J Am Coll Cardiol 2015;66:2285-94.
- Salah HM, Almaddah N, Xu J, et al. Gender differences and outcomes of hypoattenuated leaflet thickening (HALT) following transcatheter aortic valve replacement: a meta-analysis of randomized and cohort studies. Curr Probl Cardiol 2022;48:101155.
- Carlson S, Habib G, Chen T, et al. Multimodality imaging for prosthetic valves evaluation: current understanding and future directions. Prog Car- diovasc Dis 2022;72:66-77.
- Lang RM, Badano LP, Tsang W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiogra- phy. J Am Soc Echocardiogr 2012;25:3-46.
- Baumgartner H, Schima H, Tulzer G, et al. Effect of stenosis geometry on the Doppler-catheter gradient relation in vitro: a manifestation of pressure recovery. J Am Coll Cardiol 1993;21: 1018-25.
- Baumgartner H, Stefenelli T, Niederberger J, et al. “Overestimation” of catheter gradients by Doppler ultrasound in patients with aortic stenosis: a predictable manifestation of pressure recovery. J Am Coll Cardiol 1999;33:1655-61.
- Chafizadeh ER, Zoghbi WA. Doppler echocardiographic assessment of the St. Jude Medical prosthetic valve in the aortic position using the con- tinuity equation. Circulation 1991;83:213-23.
- Muraru D, Cecchetto A, Cucchini U, et al. Intervendor consistency and accuracy of left ventricular volume measurements using three- dimensional echocardiography. J Am Soc Echocardiogr 2018;31: 158-68.e1.
- Kitano T, Nabeshima Y, Otsuji Y, et al. Accuracy of left ventricular vol- umes and ejection fraction measurements by contemporary three- dimensional echocardiography with Semi- and fully automated software: systematic review and meta-analysis of 1,881 Subjects. J Am Soc Echocar- diogr 2019;32:1105-15.e5.
- Hahn RT, Douglas PS, Jaber WA, et al. Doppler velocity index outcomes following surgical or transcatheter aortic valve replacement in the PART- NER trials. JACC Cardiovasc Interv 2021;14:1594-606.
- Olmos L, Salazar G, Barbetseas J, et al. Usefulness of transthoracic echo- cardiography in detecting significant prosthetic mitral valve regurgitation. Am J Cardiol 1999;83:199-205.
- Baumgartner H, Khan S, DeRobertis M, et al. Discrepancies between Doppler and catheter gradients in aortic prosthetic valves in vitro. A manifestation of localized gradients and pressure recovery. Circulation 1990;82:1467-75.
- Heinrich RS, Fontaine AA, Grimes RY, et al. Experimental analysis of fluid mechanical energy losses in aortic valve stenosis: importance of pressure recovery. Ann Biomed Eng 1996;24:685-94.
- Levine RA, Schwammenthal E. Stenosis is in the eye of the observer: impact of pressure recovery on assessing aortic valve area. J Am Coll Car- diol 2003;41:443-5.
- Herrmann HC, Pibarot P, Wu C, et al. Bioprosthetic aortic valve hemody- namics: definitions, outcomes, and evidence gaps: JACC state-of-the-art review. J Am Coll Cardiol 2022;80:527-44.
- Baumgartner H, Khan S, DeRobertis M, et al. Effect of prosthetic aortic valve design on the Doppler-catheter gradient correlation: an in vitro study of normal St. Jude, Medtronic-Hall, Starr-Edwards and Hancock valves. J Am Coll Cardiol 1992;19:324-32.
- Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis- patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol 2000;36:1131-41.
- Pibarot P, Magne J, Leipsic J, et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardi- ovasc Imaging 2019;12:149-62.
- Abbas AE, Ternacle J, Pibarot P, et al. Impact of flow on prosthesis-patient mismatch following transcatheter and surgical aortic valve replacement. Circ Cardiovasc Imaging 2021;14:e012364.
- Dumesnil JG, Honos GN, Lemieux M, et al. Validation and applications of indexed aortic prosthetic valve areas calculated by Doppler echocar- diography. J Am Coll Cardiol 1990;16:637-43.
- Schwammenthal E, Chen C, Benning F, et al. Dynamics of mitral regur- gitant flow and orifice area. Physiologic application of the proximal flow convergence method: clinical data and experimental testing. Circulation 1994;90:307-22.
- Schwammenthal E, Vered Z, Agranat O, et al. Impact of atrioventricular compliance on pulmonary artery pressure in mitral stenosis: an exercise echocardiographic study. Circulation 2000;102:2378-84.
- Zorn GL 3rd, Little SH, Tadros P, et al. Prosthesis-patient mismatch in high-risk patients with severe aortic stenosis: a randomized trial of a self-expanding prosthesis. J Thorac Cardiovasc Surg 2016;151:1014-22. 1023.e1-3.
- Pibarot P, Weissman NJ, Stewart WJ, et al. Incidence and sequelae of prosthesis-patient mismatch in transcatheter versus surgical valve replacement in high-risk patients with severe aortic stenosis: a PARTNER trial cohort–a analysis. J Am Coll Cardiol 2014;64:1323-34.
-
Blais C, Dumesnil JG, Baillot R, et al. Impact of valve prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circu- lation 2003;108:983-8. - Ruel M, Al-Faleh H, Kulik A, et al. Prosthesis-patient mismatch after aortic valve replacement predominantly affects patients with preexisting left ventricular dysfunction: effect on survival, freedom from heart fail- ure, and left ventricular mass regression. J Thorac Cardiovasc Surg 2006;131:1036-44.
- Castro LJ, Arcidi JM Jr., Fisher AL, et al. Routine enlargement of the small aortic root: a preventive strategy to minimize mismatch. Ann Thorac Surg 2002;74:31-6. discussion 36.
- Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart 2006;92:1022-9.
- Pibarot P, Dumesnil JG. Prosthesis-patient mismatch in the mitral posi- tion: old concept, new evidences. J Thorac Cardiovasc Surg 2007;133: 1405-8.
- Bitar JN, Lechin ME, Salazar G, et al. Doppler echocardiographic assess- ment with the continuity equation of St. Jude Medical mechanical pros- theses in the mitral valve position. Am J Cardiol 1995;76:287-93.
- Dumesnil JG, Honos GN, Lemieux M, et al. Validation and applications of mitral prosthetic valvular areas calculated by Doppler echocardiogra- phy. Am J Cardiol 1990;65:1443-8.
- Pibarot P, Herrmann HC, Wu C, et al. Standardized definitions for bio- prosthetic valve dysfunction following aortic or mitral valve replacement: JACC state-of-the-art review. J Am Coll Cardiol 2022;80:545-61.
- Hwang HY, Kim YH, Kim KH, et al. Patient-prosthesis mismatch after mitral valve replacement: a propensity score analysis. Ann Thorac Surg 2016;101:1796-802.
- Tomˇsiˇc A, Arabkhani B, Schoones JW, et al. Prosthesis-patient mismatch after mitral valve replacement: a pooled meta-analysis of Kaplan-Meier- derived individual patient data. J Card Surg 2020;35:3477-85.
- Ionescu A, Fraser AG, Butchart EG. Prevalence and clinical significance of incidental paraprosthetic valvar regurgitation: a prospective study using transoesophageal echocardiography. Heart 2003;89:1316-21.
- Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for nonin- vasive evaluation of native valvular regurgitation: a report from the American society of echocardiography developed in collaboration with the society for cardiovascular magnetic resonance. J Am Soc Echocar- diogr 2017;30:303-71.
- Kinno M, Raissi SR, Olson KA, et al. Three-dimensional echocardiogra- phy in the evaluation and management of paravalvular regurgitation. Echocardiography 2018;35:2056-70.
- Lancellotti P, Pellikka PA, Budts W, et al. The clinical use of stress echo- cardiography in non-ischaemic heart disease: recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr 2017;30:101-38.
- Gentry Iii JL, Phelan D, Desai MY, et al. The role of stress echocardiogra- phy in valvular heart disease: a current appraisal. Cardiology 2017;137: 137-50.
- Nicoara A, Skubas N, Ad N, et al. Guidelines for the use of transesopha- geal echocardiography to assist with surgical decision-making in the oper- ating room: a surgery-based approach: from the American society of echocardiography in collaboration with the Society of Cardiovascular Anesthesiologists and the Society of Thoracic Surgeons. J Am Soc Echo- cardiogr 2020;33:692-734.
- Little SH, Bapat V, Blanke P, et al. Imaging guidance for transcatheter mitral valve intervention on prosthetic valves, rings, and annular calcifica- tion. JACC Cardiovasc Imaging 2021;14:22-40.
- Hahn RT, Nicoara A, Kapadia S, et al. Echocardiographic imaging for transcatheter aortic valve replacement. J Am Soc Echocardiogr 2018; 31:405-33.
- Hahn RT, Kodali S, Tuzcu EM, et al. Echocardiographic imaging of pro- cedural complications during balloon-expandable transcatheter aortic valve replacement. JACC Cardiovasc Imaging 2015;8:288-318.
- Su€ndermann SH, Biaggi P, Gru€nenfelder J, et al. Safety and feasibility of novel technology fusing echocardiography and fluoroscopy images dur- ing MitraClip interventions. EuroIntervention 2014;9:1210-6.
- Hahn RT, Kodali SK. State-of-the-art intra-procedural imaging for the mitral and tricuspid PASCAL Repair System. Eur Heart J Cardiovasc Im- aging 2022;23:e94-110.
- Muraru D, Hahn RT, Soliman OI, et al. 3-Dimensional echocardiography in imaging the tricuspid valve. JACC Cardiovasc Imaging 2019;12:500-15.
- Hahn RT, Kodali S, Fam N, et al. Early multinational experience of trans- catheter tricuspid valve replacement for treating severe tricuspid regurgi- tation. JACC Cardiovasc Interv 2020;13:2482-93.
- Hahn RT, George I, Kodali SK, et al. Early single-site experience with transcatheter tricuspid valve replacement. JACC Cardiovasc Imaging 2019;12:416-29.
- Cianciulli TE, Lax JA, Beck MA, et al. Cinefluoroscopic assessment of me- chanical disc prostheses: its value as a complementary method to echo- cardiography. J Heart Valve Dis 2005;14:664-73.
- Gorlin R, Gorlin SG. Hydraulic formula for calculation of the area of the stenotic mitral valve, other cardiac valves, and central circulatory shunts. I. Am Heart J 1951;41:1-29.
- Kober G, Hilgermann R. Catheter entrapment in a Bjo€urk-Shiley pros- thesis in aortic position. Cathet Cardiovasc Diagn 1987;13:262-5.
- Burstow DJ, Nishimura RA, Bailey KR, et al. Continuous wave Doppler echocardiographic measurement of prosthetic valve gradients: a simulta- neous Doppler-catheter correlative study. Circulation 1989;80:504-14.
- Schoenfeld MH, Palacios IF, Hutter AM, et al. Underestimation of pros- thetic mitral valve areas: role of transseptal catheterization in avoiding unnecessary repeat mitral valve surgery. JAm Coll Cardiol 1985;5: 1387-92.
- Suh YJ, Im DJ, Hong YJ, et al. Absolute-delay multiphase reconstruction reduces prosthetic valve-related and atrial fibrillation-related artifacts at cardiac CT. AJR Am J Roentgenol 2017;208:W160-7.
- Kim JY, Suh YJ, Han K, et al. Diagnostic value of advanced imaging mo- dalities for the detection and differentiation of prosthetic valve obstruc- tion: a systematic review and meta-analysis. JACC Cardiovasc Imaging 2019;12:2182-92.
- Koo HJ, Lee JY, Kim GH, et al. Paravalvular leakage in patients with pros- thetic heart valves: cardiac computed tomography findings and clinical features. Eur Heart J Cardiovasc Imaging 2018;19:1419-27.
- Makkar RR, Blanke P, Leipsic J, et al. Subclinical leaflet thrombosis in transcatheter and surgical bioprosthetic valves: PARTNER 3 cardiac computed tomography substudy. J Am Coll Cardiol 2020;75:3003-15.
- Cartlidge TRG, Doris MK, Sellers SL, et al. Detection and prediction of bioprosthetic aortic valve degeneration. J Am Coll Cardiol 2019;73: 1107-19.
- Jain V, Wang TKM, Bansal A, et al. Diagnostic performance of cardiac computed tomography versus transesophageal echocardiography in infective endocarditis: a contemporary comparative meta-analysis. J Car- diovasc Comput Tomogr 2021;15:313-21.
- Edwards MB, Ordidge RJ, Hand JW, et al. Assessment of magnetic field (4.7 T) induced forces on prosthetic heart valves and annuloplasty rings. J Magn Reson Imaging 2005;22:311-7.
- Shellock FG. Prosthetic heart valves and annuloplasty rings: assessment of magnetic field interactions, heating, and artifacts at 1.5 Tesla. J Cardi- ovasc Magn Reson 2001;3:317-24.
- Shellock FG. Biomedical implants and devices: assessment of magnetic field interactions with a 3.0-Tesla МР system. J Magn Reson Imaging 2002;16:721-32.
- von Knobelsdorff-Brenkenhoff F, Rudolph A, Wassmuth R, et al. Feasi- bility of cardiovascular magnetic resonance to assess the orifice area of aortic bioprostheses. Circ Cardiovasc Imaging 2009;2:397-404. 2 p following 404.
- von Knobelsdorff-Brenkenhoff F, Rudolph A, Wassmuth R, et al. Assess- ment of mitral bioprostheses using cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2010;12:36.
- Maragiannis D, Jackson MS, Autry K, et al. Functional assessment of bio- prosthetic mitral valves by cardiovascular magnetic resonance: an in vitro validation and comparison to Doppler echocardiography. J Cardiovasc Magn Reson 2020;22:55.
- Haberka M, Malczewska M, Pysz P, et al. Cardiovascular magnetic reso- nance and transesophageal echocardiography in patients with prosthetic valve paravalvular leaks: towards an accurate quantification and stratifi- cation. J Cardiovasc Magn Reson 2021;23:31.
- Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC guidelines for the management of infective endocarditis: the Task force for the manage- ment of infective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36:3075-128.
- Roque A, Pizzi MN, Fern´andez-Hidalgo N, et al. Morpho-metabolic post- surgical patterns of non-infected prosthetic heart valves by [18F]FDG PET/CTA: “normality” is a possible diagnosis. Eur Heart J Cardiovasc Im- aging 2020;21:24-33.
- Wahadat AR, Tanis W, Scholtens AM, et al. Normal imaging findings after aortic valve implantation on 18F-Fluorodeoxyglucose positron emission tomography with computed tomography. J Nucl Cardiol 2021;28: 2258-68.
- Hahn RT, Abraham T, Adams MS, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: rec- ommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2013;26:921-64.
- Winter MP, Zbiral M, Kietaibl A, et al. Normal values for Doppler echo- cardiographic assessment of prosthetic valve function after transcatheter aortic valve replacement: a systematic review and meta-analysis. Eur Heart J Cardiovasc Imaging 2018;19:361-8.
- Capodanno D, Petronio AS, Prendergast B, et al. Standardized defini- tions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interventions (EAPCI) endorsed by the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017;38:3382-90.
- Dvir D, Bourguignon T, Otto CM, et al. Standardized definition of struc- tural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation 2018;137:388-99.
- Roslan AB, Naser JA, Nkomo VT, et al. Performance of echocardio- graphic algorithms for assessment of high aortic bioprosthetic valve gra- dients. J Am Soc Echocardiogr 2022;35:682-91.e2.
- Shames S, Koczo A, Hahn R, et al. Flow characteristics of the SAPIEN aortic valve: the importance of recognizing in-stent flow acceleration for the echocardiographic assessment of valve function. J Am Soc Echo- cardiogr 2012;25:603-9.
- Hahn RT, Pibarot P, Stewart WJ, et al. Comparison of transcatheter and surgical aortic valve replacement in severe aortic stenosis: a longitudinal study of echocardiography parameters in cohort A of the PARTNER trial (placement of aortic transcatheter valves). J Am Coll Cardiol 2013;61: 2514-21.
- Pibarot P, Salaun E, Dahou A, et al. Echocardiographic results of trans- catheter versus surgical aortic valve replacement in low-risk patients: the PARTNER 3 trial. Circulation 2020;141:1527-37.
- Duncan A, Moat N, Simonato M, et al. Outcomes following transcatheter aortic valve replacement for degenerative stentless versus stented bio- prostheses. JACC Cardiovasc Interv 2019;12:1256-63.
- Alnasser S, Cheema AN, Simonato M, et al. Matched comparison of self- expanding transcatheter heart valves for the treatment of failed aortic sur- gical bioprosthesis: insights from the valve-in-valve International data reg- istry (VIVID). Circ Cardiovasc Interv 2017;10:e004392.
- Bleiziffer S, Erlebach M, Simonato M, et al. Incidence, predictors and clin- ical outcomes of residual stenosis after aortic valve-in-valve. Heart 2018; 104:828-34.
- Abbas AE, Mando R, Hanzel G, et al. Invasive versus echocardiographic evaluation of transvalvular gradients immediately post-transcatheter aortic valve replacement. Circ Cardiovasc Interv 2019;12:e007973.
- Rodes-Cabau J, Abbas AE, Serra V, et al. Balloon- vs self-expanding valve systems for failed small surgical aortic valve bioprostheses. J Am Coll Car- diol 2022;80:681-93.
- Hatoum H, Hahn RT, Lilly S, et al. Differences in pressure recovery be- tween balloon expandable and self-expandable transcatheter aortic valves. Ann Biomed Eng 2020;48:860-7.
- Hatoum H, Samaee M, Sathananthan J, et al. Comparison of perfor- mance of self-expanding and balloon-expandable transcatheter aortic valves. JTCVS Open 2022;10:128-39.
- Alperi A, Robichaud M, Panagides V, et al. Impact of residual transvalv- ular gradient on clinical outcomes following valve-in-valve transcatheter aortic valve replacement. Int J Cardiol 2022;366:90-6.
- de Freitas Campos Guimaraes L, Urena M, Wijeysundera HC, et al. Long- term outcomes after transcatheter aortic valve-in-valve replacement. Circ Cardiovasc Interv 2018;11:e007038.
- Hahn RT, Webb J, Pibarot P, et al. 5-Year follow-up from the PARTNER 2 aortic valve-in-valve registry for degenerated aortic surgical bio- prostheses. JACC Cardiovasc Interv 2022;15:698-708.
- Otto CM, Kumbhani DJ, Alexander KP, et al. 2017 ACC expert consensus decision pathway for transcatheter aortic valve replacement in the management of adults with aortic stenosis: a report of the Amer- ican College of Cardiology Task force on clinical expert consensus docu- ments. J Am Coll Cardiol 2017;69:1313-46.
- Ribeiro HB, Rodes-Cabau J, Blanke P, et al. Incidence, predictors, and clin- ical outcomes of coronary obstruction following transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves: insights from the VIVID registry. Eur Heart J 2018;39:687-95.
- Blanke P, Weir-McCall JR, Achenbach S, et al. Computed tomography imaging in the context of transcatheter aortic valve implantation (ТИАК)/Transcatheter aortic valve replacement (TAVR): an expert consensus document of the society of cardiovascular computed tomog- raphy. JACC Cardiovasc Imaging 2019;12:1-24.
- Feuchtner GM, Spoeck A, Lessick J, et al. Quantification of aortic regur- gitant fraction and volume with multi-detector computed tomography comparison with echocardiography. Acad Radiol 2011;18:334-42.
- Feuchtner GM, Dichtl W, Friedrich GJ, et al. Multislice computed tomog- raphy for detection of patients with aortic valve stenosis and quantifica- tion of severity. J Am Coll Cardiol 2006;47:1410-7.
- Freeman M, Webb JG, Willson AB, et al. Multidetector CT predictors of prosthesis-patient mismatch in transcatheter aortic valve replacement. J Cardiovasc Comput Tomogr 2013;7:248-55.
- Saleeb SF, Newburger JW, Geva T, et al. Accelerated degeneration of a bovine pericardial bioprosthetic aortic valve in children and young adults. Circulation 2014;130:51-60.
- Pham N, Zaitoun H, Mohammed TL, et al. Complications of aortic valve sur- gery: manifestations at CTand MRimaging. Radiographics 2012;32:1873-92.
- Habets J, Meijer TS, Meijer RC, et al. CT attenuation measurements are valuable to discriminate pledgets used in prosthetic heart valve implanta- tion from paravalvular leakage. Br J Radiol 2012;85:e616-21.
- Feuchtner GM, Stolzmann P, Dichtl W, et al. Multislice computed tomog- raphy in infective endocarditis: comparison with transesophageal echo- cardiography and intraoperative findings. J Am Coll Cardiol 2009;53: 436-44.
- Fagman E, Perrotta S, Bech-Hanssen O, et al. ECG-gated computed to- mography: a new role for patients with suspected aortic prosthetic valve endocarditis. Eur Radiol 2012;22:2407-14.
- Gunduz S, Ozkan M, Kalcik M, et al. Sixty-four-section cardiac computed tomography in mechanical prosthetic heart valve dysfunction: thrombus or pannus. Circ Cardiovasc Imaging 2015;8:e003246.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thick- ening in balloon-expandable transcatheter aortic heart valves. Eur Heart J 2016;37:2263-71.
- McMahon MA, Squirrell CA. Multidetector CT of aortic dissection: a pictorial review. Radiographics 2010;30:445-60.
- Gulsin GS, Singh A, McCann GP. Cardiovascular magnetic resonance in the evaluation of heart valve disease. BMC Med Imaging 2017;17:67.
- von Knobelsdorff-Brenkenhoff F, Dieringer MA, Greiser A, et al. In vitro assessment of heart valve bioprostheses by cardiovascular magnetic reso- nance: four-dimensional mapping of flow patterns and orifice area planimetry. Eur J Cardiothorac Surg 2011;40:736-42.
- Myerson SG. CМР in evaluating valvular heart disease: diagnosis, severity, and outcomes. JACC Cardiovasc Imaging 2021;14:2020-32.
- Leiner T, Bogaert J, Friedrich MG, et al. SCМР Position Paper (2020) on clinical indications for cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2020;22:76.
- Garcia J, Kadem L, Larose E, et al. Comparison between cardiovascular magnetic resonance and transthoracic Doppler echocardiography for the estimation of effective orifice area in aortic stenosis. J Cardiovasc Magn Reson 2011;13:25.
- Maragiannis D, Jackson MS, Flores-Arredondo JH, et al. Functional assessment of bioprosthetic aortic valves by CMR. JACC Cardiovasc Im- aging 2016;9:785-93.
- Ha H, Kvitting JP, Dyverfeldt P, et al. 4D Flow MRI quantification of blood flow patterns, turbulence and pressure drop in normal and stenotic prosthetic heart valves. Magn Reson Imaging 2019;55:118-27.
- Barone-Rochette G, Pierard S, De Meester de Ravenstein C, et al. Prog- nostic significance of LGE by CМР in aortic stenosis patients undergoing valve replacement. J Am Coll Cardiol 2014;64:144-54.
- Musa TA, Treibel TA, Vassiliou VS, et al. Myocardial scar and mortality in severe aortic stenosis. Circulation 2018;138:1935-47.
- Lee JC, Branch KR, Hamilton-Craig C, et al. Evaluation of aortic regurgi- tation with cardiac magnetic resonance imaging: a systematic review. Heart 2018;104:103-10.
- Bolen MA, Popovic ZB, Rajiah P, et al. Cardiac МР assessment of aortic regurgitation: holodiastolic flow reversal in the descending aorta helps stratify severity. Radiology 2011;260:98-104.
- Kammerlander AA, Wiesinger M, Duca F, et al. Diagnostic and prog- nostic utility of cardiac magnetic resonance imaging in aortic regurgita- tion. JACC Cardiovasc Imaging 2019;12:1474-83.
- Papanastasiou CA, Kokkinidis DG, Jonnalagadda AK, et al. Meta-analysis of transthoracic echocardiography versus cardiac magnetic resonance for the assessment of aortic regurgitation after transcatheter aortic valve im- plantation. Am J Cardiol 2019;124:1246-51.
- Krim SR, Vivo RP, Patel A, et al. Direct assessment of normal mechanical mitral valve orifice area by real-time 3D echocardiography. JACC Cardi- ovasc Imaging 2012;5:478-83.
- Whisenant B, Kapadia SR, Eleid MF, et al. One-year outcomes of mitral valve-in-valve using the SAPIEN 3 transcatheter heart valve. JAMA Car- diol 2020;5:1245-52.
- Guerrero M, Vemulapalli S, Xiang Q, et al. Thirty-day outcomes of trans- catheter mitral valve replacement for degenerated mitral bioprostheses (Valve-in-Valve), failed surgical rings (Valve-in-Ring), and native valve with severe mitral annular calcification (Valve-in-Mitral annular calcifica- tion) in the United States: data from the Society of Thoracic Surgeons/ American College of Cardiology/Transcatheter Valve Therapy Registry. Circ Cardiovasc Interv 2020;13:e008425.
- Eleid MF, Cabalka AK, Williams MR, et al. Percutaneous Transvenous transseptal transcatheter valve implantation in failed bioprosthetic mitral valves, ring annuloplasty, and severe mitral annular calcification. JACC Cardiovasc Interv 2016;9:1161-74.
- Muller DWM, Sorajja P, Duncan A, et al. 2-Year outcomes of transcath- eter mitral valve replacement in patients with severe symptomatic mitral regurgitation. J Am Coll Cardiol 2021;78:1847-59.
- Fernandes V, Olmos L, Nagueh SF, et al. Peak early diastolic velocity rather than pressure half-time is the best index of mechanical prosthetic mitral valve function. Am J Cardiol 2002;89:704-10.
- Spencer RJ, Gin KG, Tsang MY, et al. Doppler parameters derived from transthoracic echocardiography accurately detect bioprosthetic mitral valve dysfunction. J Am Soc Echocardiogr 2017;30:966-73.e1.
- Chang S, Suh YJ, Han K, et al. The clinical significance of perivalvular pan- nus in prosthetic mitral valves: can cardiac CT be helpful? Int J Cardiol 2017;249:344-8.
- Tsubota H, Sakaguchi G, Arakaki R, et al. Impact of prosthesis-patient mismatch after mitral valve replacement: a propensity score analysis. Semin Thorac Cardiovasc Surg 2021;33:347-53.
- Cohen GI, Davison MB, Klein AL, et al. A comparison of flow conver- gence with other transthoracic echocardiographic indexes of prosthetic mitral regurgitation. J Am Soc Echocardiogr 1992;5:620-7.
- Konen E, Goitein O, Feinberg MS, et al. The role of ECG-gated MDCT in the evaluation of aortic and mitral mechanical valves: initial experience. AJR Am J Roentgenol 2008;191:26-31.
- Symersky P, Budde RP, de Mol BA, et al. Comparison of multidetector- row computed tomography to echocardiography and fluoroscopy for evaluation of patients with mechanical prosthetic valve obstruction. Am J Cardiol 2009;104:1128-34.
- LaBounty TM, Agarwal PP, Chughtai A, et al. Evaluation of mechanical heart valve size and function with ECG-gated 64-MDCT. AJR Am J Roentgenol 2009;193:W389-96.
- Grunenfelder J, Plass A, Alkadhi H, et al. Evaluation of biological aortic valve prostheses by dual source computer tomography and anatomic measurements for potential transapical valve-in-valve procedure. Interact Cardiovasc Thorac Surg 2008;7:195-9. discussion 199-200.
- Chenot F, Montant P, Goffinet C, et al. Evaluation of anatomic valve opening and leaflet morphology in aortic valve bioprosthesis by using multidetector CT: comparison with transthoracic echocardiography. Radiology 2010;255:377-85.
- LaBounty TM, Agarwal PP, Chughtai A, et al. Hemodynamic and func- tional assessment of mechanical aortic valves using combined echocardi- ography and multidetector computed tomography. J Cardiovasc Comput Tomogr 2009;3:161-7.
- Habets J, Symersky P, Leiner T, et al. Artifact reduction strategies for pros- thetic heart valve CT imaging. Int J Cardiovasc Imaging 2012;28: 2099-108.
- Suh YJ, Hong GR, Han K, et al. Assessment of mitral paravalvular leakage after mitral valve replacement using cardiac computed tomography: comparison with surgical findings. Circ Cardiovasc Imaging 2016; 9:e004153.
- Simprini LA, Afroz A, Cooper MA, et al. Routine cine-CМР for prosthesis-associated mitral regurgitation: a multicenter comparison to echocardiography. J Heart Valve Dis 2014;23:575-82.
- Emani SM. Options for prosthetic pulmonary valve replacement. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2012;15:34-7.
- Bonhoeffer P, Boudjemline Y, Saliba Z, et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet 2000;356:1403-5.
- Ribeiro JM, Teixeira R, Lopes J, et al. Transcatheter versus surgical pulmo- nary valve replacement: a systemic review and meta-analysis. Ann Thorac Surg 2020;110:1751-61.
- Egbe AC, Vallabhajosyula S, Connolly HM. Trends and outcomes of pul- monary valve replacement in tetralogy of Fallot. Int J Cardiol 2020;299: 136-9.
- O’Byrne ML, Glatz AC, Mercer-Rosa L, et al. Trends in pulmonary valve replacement in children and adults with tetralogy of fallot. Am J Cardiol 2015;115:118-24.
- Caldarone CA, McCrindle BW, Van Arsdell GS, et al. Independent fac- tors associated with longevity of prosthetic pulmonary valves and valved conduits. J Thorac Cardiovasc Surg 2000;120:1022-30. discussion 1031.
- Miranda WR, Connolly HM, Bonnichsen CR, et al. Prosthetic pulmonary valve and pulmonary conduit endocarditis: clinical, microbiological and echocardiographic features in adults. Eur Heart J Cardiovasc Imaging 2016;17:936-43.
- Sadeghpour A, Saadatifar H, Kiavar M, et al. Doppler echocardiographic assessment of pulmonary prostheses: a comprehensive assessment including velocity time integral ratio and prosthesis effective orifice area. Congenit Heart Dis 2008;3:415-21.
- Puchalski MD, Lui GK, Miller-Hance WC, et al. Guidelines for perform- ing a comprehensive transesophageal echocardiographic: examination in children and all patients with congenital heart disease: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2019;32:173-215.
- Ahmed MI, Escanuela MG, Crosland WA, et al. Utility of live/real time three-dimensional transesophageal echocardiography in the assessment and percutaneous intervention of bioprosthetic pulmonary valve steno- sis. Echocardiography 2014;31:531-3.
- Ostergaard L, Vejlstrup N, Kober L, et al. Diagnostic potential of intracar- diac echocardiography in patients with suspected prosthetic valve endo- carditis. J Am Soc Echocardiogr 2019;32:1558-64.e3.
- Bouajila S, Chalard A, Dauphin C. Usefulness of intracardiac echocardi- ography for the diagnosis of infective endocarditis following percuta- neous pulmonary valve replacement. Cardiol Young 2017;27:1406-9.
- Sucha D, Symersky P, Tanis W, et al. Multimodality imaging assessment of prosthetic heart valves. Circ Cardiovasc Imaging 2015;8:e003703.
- Nayak KS, Nielsen JF, Bernstein MA, et al. Cardiovascular magnetic reso- nance phase contrast imaging. J Cardiovasc Magn Reson 2015;17:71.
- Valente AM, Cook S, Festa P, et al. Multimodality imaging guidelines for patients with repaired tetralogy of fallot: a report from the American So- ciety of Echocardiography: developed in collaboration with the Society for Cardiovascular Magnetic Resonance and the Society for Pediatric Radiology. J Am Soc Echocardiogr 2014;27:111-41.
- Chung R, Taylor AM. Imaging for preintervention planning: transcatheter pulmonary valve therapy. Circ Cardiovasc Imaging 2014;7:182-9.
- Han BK, Moga FX, Overman D, et al. Diagnostic value of contrast- enhanced multiphase computed tomography for assessment of percu- taneous pulmonary valve obstruction. Ann Thorac Surg 2016;101: e115-6.
- Curran L, Agrawal H, Kallianos K, et al. Computed tomography guided sizing for transcatheter pulmonary valve replacement. Int J Cardiol Heart Vasc 2020;29:100523.
- Dellas C, Kammerer L, Gravenhorst V, et al. Quantification of pulmo- nary regurgitation and prediction of pulmonary valve replacement by echocardiography in patients with congenital heart defects in comparison to cardiac magnetic resonance imaging. Int J Cardiovasc Imaging 2018; 34:607-13.
- Lotz J, Sohns JM. [Imaging technique and current status of valvular heart disease using cardiac MRI]. Radiologe 2013;53:872-9.
- Mercer-Rosa L, Yang W, Kutty S, et al. Quantifying pulmonary regurgita- tion and right ventricular function in surgically repaired tetralogy of Fal- lot: a comparative analysis of echocardiography and magnetic resonance imaging. Circ Cardiovasc Imaging 2012;5:637-43.
- Wang N, Fulcher J, Abeysuriya N, et al. Tricuspid regurgitation is associ- ated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. Eur Heart J 2019;40:476-84.
- Benfari G, Antoine C, Miller WL, et al. Excess mortality associated with functional tricuspid regurgitation complicating heart failure with reduced ejection fraction. Circulation 2019;140:196-206.
- Kilic A, Saha-Chaudhuri P, Rankin JS, et al. Trends and outcomes of tricuspid valve surgery in North America: an analysis of more than 50,000 patients from the Society of Thoracic Surgeons database. Ann Thorac Surg 2013;96:1546-52. discussion 1552.
- Zack CJ, Fender EA, Chandrashekar P, et al. National trends and out- comes in isolated tricuspid valve surgery. J Am Coll Cardiol 2017;70: 2953-60.
- Negm S, Arafat AA, Elatafy EE, et al. Mechanical versus bioprosthetic valve replacement in the tricuspid valve position: a systematic review and meta-analysis. Heart Lung Circ 2021;30:362-71.
- Rizzoli G, Vendramin I, Nesseris G, et al. Biological or mechanical pros- theses in tricuspid position? A meta-analysis of intra-institutional results. Ann Thorac Surg 2004;77:1607-14.
- Godart F, Baruteau AE, Petit J, et al. Transcatheter tricuspid valve implan- tation: a multicentre French study. Arch Cardiovasc Dis 2014;107:583-91.
- Taramasso M, Gavazzoni M, Pozzoli A, et al. Tricuspid regurgitation: pre- dicting the need for intervention, procedural success, and recurrence of disease. JACC Cardiovasc Imaging 2019;12:605-21.
- Aboulhosn J, Cabalka AK, Levi DS, et al. Transcatheter valve-in-ring im- plantation for the treatment of residual or recurrent tricuspid valve dysfunction after prior surgical repair. JACC Cardiovasc Interv 2017; 10:53-63.
- Dreyfus J, Flagiello M, Bazire B, et al. Isolated tricuspid valve surgery: impact of aetiology and clinical presentation on outcomes. Eur Heart J 2020;41:4304-17.
- Rahgozar K, Ho E, Goldberg Y, et al. Transcatheter tricuspid valve repair and replacement: a landscape review of current techniques and devices for the treatment of tricuspid valve regurgitation. Expert Rev Cardiovasc Ther 2021;19:399-411.
- Sanon S, Cabalka AK, Babaliaros V, et al. Transcatheter tricuspid valve-in- valve and valve-in-ring implantation for degenerated surgical prosthesis. JACC Cardiovasc Interv 2019;12:1403-12.
- Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American society of echocardiography. J Am Soc Echocardiogr 2019;32:1-64.
- Yuan L, Cao T, Duan Y, et al. Noninvasive assessment of influence of resistant respiration on blood flow velocities across the cardiac valves in humans–a quantification study by echocardiography. Echocardiogra- phy 2004;21:391-8.
- Connolly HM, Miller FA Jr., Taylor CL, et al. Doppler hemodynamic pro- files of 82 clinically and echocardiographically normal tricuspid valve prostheses. Circulation 1993;88:2722-7.
- Blauwet LA, Danielson GK, Burkhart HM, et al. Comprehensive echo- cardiographic assessment of the hemodynamic parameters of 285 tricuspid valve bioprostheses early after implantation. J Am Soc Echocar- diogr 2010;23:1045-59. 1059.e1-2.
- Hahn R, Saric M, Faletra FF, et al. Recommended standards for the per- formance of transesophageal echocardiographic screening for structural heart intervention: from the American society of echocardiography. J Am Soc Echocardiogr 2022;35:1-76. Erratum in: J Am Soc Echocardiogr. 2022 Apr;35(4):447.
- Hahn RT. State-of-the-Art review of echocardiographic imaging in the evaluation and treatment of functional tricuspid regurgitation. Circ Car- diovasc Imaging 2016;9:e005332.
- Badano LP, Agricola E, Perez de Isla L, et al. Evaluation of the tricuspid valve morphology and function by transthoracic real-time three-dimen- sional echocardiography. Eur J Echocardiogr 2009;10:477-84.
- Hahn RT. Transcathether valve replacement and valve repair: review of procedures and intraprocedural echocardiographic imaging. Circ Res 2016;119:341-56.
- Garatti A, Nano G, Bruschi G, et al. Twenty-five year outcomes of tricuspid valve replacement comparing mechanical and biologic prosthe- ses. Ann Thorac Surg 2012;93:1146-53.
- Ratnatunga CP, Edwards MB, Dore CJ, et al. Tricuspid valve replace- ment: UK Heart Valve Registry mid-term results comparing mechanical and biological prostheses. Ann Thorac Surg 1998;66:1940-7.
- Burri M, Vogt MO, Horer J, et al. Durability of bioprostheses for the tricuspid valve in patients with congenital heart disease. Eur J Cardio- thorac Surg 2016;50:988-93.
- Nakano K, Koyanagi H, Hashimoto A, et al. Tricuspid valve replacement with the bileaflet St. Jude Medical valve prosthesis. J Thorac Cardiovasc Surg 1994;108:888-92.
- Peterffy A, Szentkiralyi I. Mechanical valves in tricuspid position: cause of thrombosis and prevention. Eur J Cardiothorac Surg 2001;19:735-6.
- Blauwet LA, Burkhart HM, Dearani JA, et al. Comprehensive echocar- diographic assessment of mechanical tricuspid valve prostheses based on early post-implantation echocardiographic studies. J Am Soc Echocar- diogr 2011;24:414-24.
- McElhinney DB, Aboulhosn JA, Dvir D, et al. Mid-term valve-related out- comes after transcatheter tricuspid valve-in-valve or valve-in-ring replacement. J Am Coll Cardiol 2019;73:148-57.
- Kobayashi Y, Nagata S, Ohmori F, et al. Serial Doppler echocardio- graphic evaluation of bioprosthetic valves in the tricuspid position. J Am Coll Cardiol 1996;27:1693-7.
- Maragiannis D, Aggeli C, Nagueh SF. Echocardiographic evaluation of tricuspid prosthetic valves: an update. Hellenic J Cardiol 2016;57: 145-51.
- Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Soci- ety of Echocardiography endorsed by the European Association of Echo- cardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685-713. quiz 786-8.
- van Slooten YJ, Freling HG, van Melle JP, et al. Long-term tricuspid valve prosthesis-related complications in patients with congenital heart disease. Eur J Cardiothorac Surg 2014;45:83-9.
- Han BK, Rigsby CK, Leipsic J, et al. Computed tomography imaging in patients with congenital heart disease, Part 2: technical recommenda- tions. An expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT): endorsed by the Society of Pediatric Radiology (SPR) and the North American Society of Cardiac Imaging (NASCI). J Cardiovasc Comput Tomogr 2015;9:493-513.
- Saremi F, Grizzard JD, Kim RJ. Optimizing cardiac МР imaging: practical remedies for artifacts. Radiographics 2008;28:1161-87.
- Hahn RT, Thomas JD, Khalique OK, et al. Imaging assessment of tricuspid regurgitation severity. JACC Cardiovasc Imaging 2019;12: 469-90.
- Dahou A, Ong G, Hamid N, et al. Quantifying tricuspid regurgitation severity: a comparison of proximal isovelocity surface area and novel quantitative Doppler methods. JACC Cardiovasc Imaging 2019;12: 560-2.
- Hahn RT, Meduri CU, Davidson CJ, et al. Early feasibility study of a trans- catheter tricuspid valve annuloplasty: SCOUT trial 30-day results. J Am Coll Cardiol 2017;69:1795-806.
- Utsunomiya H, Harada Y, Susawa H, et al. Comprehensive evaluation of tricuspid regurgitation location and severity using vena contracta analysis: a color Doppler three-dimensional transesophageal echocardiographic study. J Am Soc Echocardiogr 2019;32:1526-37.e2.
- Zhan Y, Senapati A, Vejpongsa P, et al. Comparison of echocardiographic assessment of tricuspid regurgitation against cardiovascular magnetic resonance. JACC Cardiovasc Imaging 2020;13:1461-71.
- Zhan Y, Debs D, Khan MA, et al. Natural history of functional tricuspid regurgitation quantified by cardiovascular magnetic resonance. J Am Coll Cardiol 2020;76:1291-301.
- Pulerwitz TC, Khalique OK, Leb J, et al. Optimizing cardiac CT protocols for comprehensive acquisition prior to percutaneous MV and ТК repair/ replacement. JACC Cardiovasc Imaging 2020;13:836-50.
- Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task force on clinical practice guidelines. Circulation 2019;139:e698-800.
- Choi PS, Sleeper LA, Lu M, et al. Revisiting prosthesis choice in mitral valve replacement in children: Durable alternatives to traditional bio- prostheses. J Thorac Cardiovasc Surg 2021;61:213-25.
- Ibezim C, Sarvestani AL, Knight JH, et al. Outcomes of mechanical mitral valve replacement in children. Ann Thorac Surg 2019;107:143-50.
- Li W, West C, McGhie J, et al. Consensus recommendations for echocar- diography in adults with congenital heart defects from the International Society of Adult Congenital Heart Disease (ISAВПС). Int J Cardiol 2018;272:77-83.
- Cohen MS, Eidem BW, Cetta F, et al. Multimodality imaging guidelines of patients with transposition of the great arteries: a report from the American Society of Echocardiography developed in collaboration with the Society for Cardiovascular Magnetic Resonance and the Society of Cardiovascular Computed Tomography. J Am Soc Echocardiogr 2016;29:571-621.
- Hasan BS, Lunze FI, Chen MH, et al. Effects of transcatheter pulmonary valve replacement on the hemodynamic and ventricular response to ex- ercise in patients with obstructed right ventricle-to-pulmonary artery conduits. JACC Cardiovasc Interv 2014;7:530-42.
- Hasan BS, Lunze FI, McElhinney DB, et al. Exercise stress echocardio- graphic assessment of outflow tract and ventricular function in patients with an obstructed right ventricular-to-pulmonary artery conduit after repair of conotruncal heart defects. Am J Cardiol 2012;110:1527-33.
- Simpson J, Lopez L, Acar P, et al. Three-dimensional echocardiography in congenital heart disease: an expert consensus document from the Eu- ropean association of cardiovascular imaging and the American society of echocardiography. J Am Soc Echocardiogr 2017;30:1-27.
- Fratz S, Chung T, Greil GF, et al. Guidelines and protocols for cardiovas- cular magnetic resonance in children and adults with congenital heart disease: SCМР expert consensus group on congenital heart disease. J Cardiovasc Magn Reson 2013;15:51.
- Freling HG, van Slooten YJ, van Melle JP, et al. Prosthetic valves in adult patients with congenital heart disease: rationale and design of the Dutch PROSTAVA study. Neth Heart J 2012;20:419-24.
- Rizk J. 4D flow MRI applications in congenital heart disease. Eur Radiol 2021;31:1160-74.
- Calkoen EE, Westenberg JJ, Kroft LJ, et al. Characterization and quantifi- cation of dynamic eccentric regurgitation of the left atrioventricular valve after atrioventricular septal defect correction with 4D Flow cardiovascu-lar magnetic resonance and retrospective valve tracking. J Cardiovasc Magn Reson 2015;17:18.
- Duncan A, Davies S, Di Mario C, et al. Valve-in-valve transcatheter aortic valve implantation for failing surgical aortic stentless bioprosthetic valves: a single-center experience. J Thorac Cardiovasc Surg 2015;150:91-8.
- Webb JG, Murdoch DJ, Alu MC, et al. 3-Year outcomes after valve-in-valve transcatheter aortic valve replacement for degenerated bioprostheses: the PARTNER 2 registry. J Am Coll Cardiol 2019;73:2647-55.
- Rajani R, Mukherjee D, Chambers JB. Doppler echocardiography in nor- mally functioning replacement aortic valves: a review of 129 studies. J Heart Valve Dis 2007;16:519-35.
- Rosenhek R, Binder T, Maurer G, et al. Normal values for Doppler echo- cardiographic assessment of heart valve prostheses. J Am Soc Echocar- diogr 2003;16:1116-27.
- Egbe AC, Connolly HM, Miranda WR, et al. Outcomes of bioprosthetic valves in the pulmonary position in adults with congenital heart disease. Ann Thorac Surg 2019;108:1410-5.
- Jalal Z, Valdeolmillos E, Malekzadeh-Milani S, et al. Mid-term outcomes following percutaneous pulmonary valve implantation using the “Folded Melody valve” technique. Circ Cardiovasc Interv 2021;14:e009707.
- Shojaeifard M, Daryanavard A, Karimi Behnagh A, et al. Assessment of normal hemodynamic profile of mechanical pulmonary prosthesis by Doppler echocardiography: a prospective cross-sectional study. Cardio- vasc Ultrasound 2020;18:14.