С момента открытия свободной фетальной ДНК (cell-free fetal DNA, cffDNA) в плазме матери, с 1997 года наблюдается быстрый прогресс в освоении этого метода в качестве источника генетического материала плода для пренатальной диагностики. Большинство свободной фетальной ДНК (cffDNA) является материнской по происхождению, только 10% являются cffDNA плода, которая происходит из плаценты и появляется в материнском кровотоке с 5 недели беременности. Сначала cffDNA были использованы для определения пола плода с помощью аллеля Y-хромосомы, определения фетального резус D (RHD) генотипа у резус-отрицательных матерей и для диагностики некоторых генетических заболеваний (таких как ахондроплазии), которые в большинстве случаев возникают в результате новой мутации.
АВТОРЫ: T. R. Everett, L. S. Chitty
Введение
С момента открытия свободной фетальной ДНК (cell-free fetal DNA, cffDNA) в плазме матери, с 1997 года наблюдается быстрый прогресс в освоении этого метода в качестве источника генетического материала плода для пренатальной диагностики. Большинство свободной фетальной ДНК (cffDNA) является материнской по происхождению, только 10% являются cffDNA плода, которая происходит из плаценты и появляется в материнском кровотоке с 5 недели беременности. Сначала cffDNA были использованы для определения пола плода с помощью аллеля Y-хромосомы, определения фетального резус D (RHD) генотипа у резус-отрицательных матерей и для диагностики некоторых генетических заболеваний (таких как ахондроплазии), которые в большинстве случаев возникают в результате новой мутации. Технологические достижения, связанные с разработкой следующего поколения секвенирования (NGS), привели к точному подсчету последовательностей ДНК, которые связаны с конкретными хромосомами, присутствующими в материнской крови, усовершенствовали развитие неинвазивной пренатальной диагностики (NIPT) для анеуплоидий. Кроме того, количественное определение cffDNA также может быть полезным в раннем выявлении беременностей с риском других неблагоприятных осложнений, таких как преэклампсия и синдром задержки развития плода (СЗРП).
Х-сцепленные расстройства и аномалии развития половых органов
Наиболее раннее клиническое применение cffDNA было для определения пола плода. Это зависит от обнаружения последовательностей, SRY или DYS14 в плазме матери, которые появляются с Y-хромосомы Техника уже включена в стандартную пренатальную диагностику в ряде европейских стран, включая Великобританию, для ведения беременностей с повышенным риском тяжелых генетических нарушений, сцепленных с Х-хромосомой, например, мышечной дистрофии Дюшена. Точное определение пола плода у беременных с риском врожденной гиперплазии коры надпочечников может обеспечить раннее прекращение лечения стероидами, при обнаружении плода мужского пола. Тестирование является единственным надежным методом определения пола плода уже с 7 недель беременности, ложноположительные результаты возможны в случае многоплодной беременности.
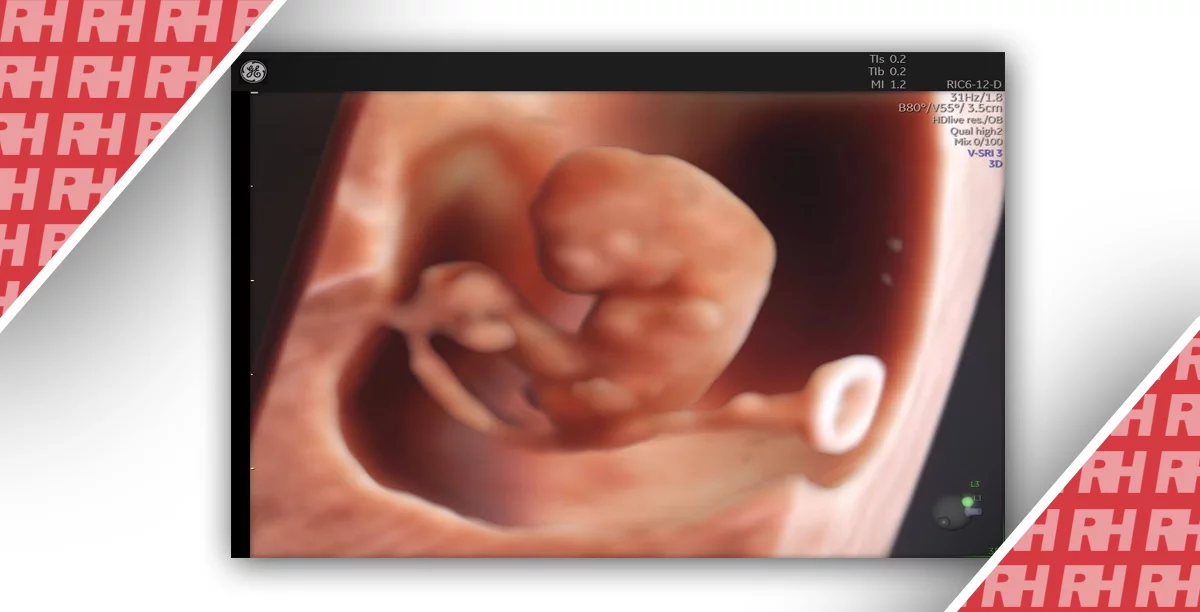
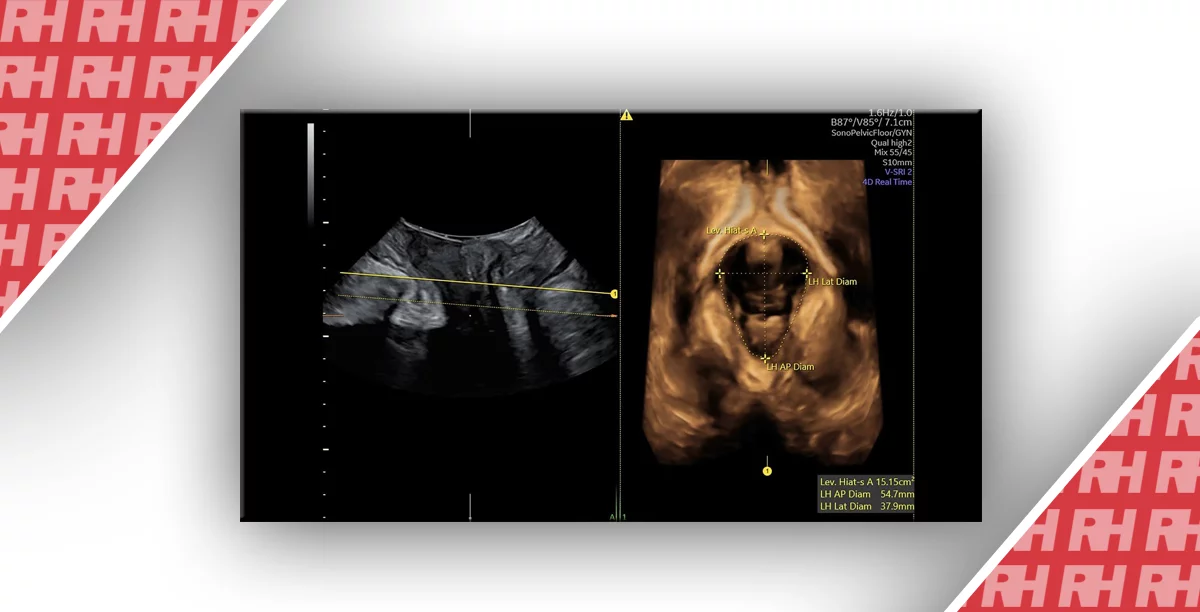
Неоднозначность развития гениталий является редкой находкой на УЗИ, однако даже с появлением усовершенствованных трехмерных методов (3D) визуализации, дифференциация между клиторомегалией у плода женского пола и гипоспадией у мальчиков остается сложной (Рис.1). В тех случаях, когда есть генитальная неопределенность и тестирования cffDNA показывают, что плод мужского пола, наиболее вероятный диагноз гипоспадия, хотя некоторые редкие эндокринные расстройства не могут быть исключены полностью без секвенирования гена рецептора андрогена (Рис.1).
Рис.1 Патология развития половых органов. а) случай гипоспадии у плода мужского пола, подтвержденный cffDNA анализом, b) клиторомегалия, женский пол подтвержден cffDNA.
cffDNA и Rh-D нег
Рис.1 Патология развития половых органов. а) случай гипоспадии у плода мужского пола, подтвержденный cffDNA анализом, b) клиторомегалия, женский пол подтвержден cffDNA.
cffDNA и Rh-D негативная мать
Второе клиническое применение теста cffDNA – определение резус-принадлежности плода у RhD-отрицательных матерей. Как и в случае определения пола плода, это возможно потому, что резус-отрицательная мать не производит никаких копий гена RhD (RHD), и, таким образом определение RHD в материнской крови происходит от плода, который унаследовал ген от отца. За последнее десятилетие фетальное RHD генотипирование у резус-отрицательных женщин со значительными титрами анти-RhD иммуноглобулина было возможно с использованием полимеразной цепной реакции (ПЦР). Такой подход к ведению этих беременных высокого риска приводит к избеганию необходимости инвазивного тестирования, которое требовалось раньше. NIPT обходит необходимость оценки родительского фенотипа, который может не быть известным. Если плод резус положительный, необходимо усиленное наблюдение за возможным развитием анемии или отека плода.
Внедрение высокопроизводительных технологий для массового RHD генотипирования может обеспечить целевое введение анти-D иммуноглобулина. В настоящее время многие страны предлагают дородовую иммунную профилактику для всех резус-отрицательных матерей, на сроке гестации 26-28 недель, что значительно снижает частоту резус-сенсибилизации. Но это приводит к ненужному введению анти-D иммуноглобулина примерно у 38% RhD-отрицательных женщин, которые несут резус-отрицательный плод. Рутинное RHD генотипирование плода может улучшить иммунопрофилактику, ориентированную на женщин с высоким риском, в результате снижается темп аллоиммунизации, а впоследствии и необходимость внутриутробного переливания крови.
Неинвазивное пренатальное тестирование для моногенных расстройств
Использование cffDNA в выявлении моногенных расстройств значительно сложнее технически, чем генотипирование RHD или определение пола плода. В настоящее время используется в клинической практике только для выявления аллелей, которые возникли в момент оплодотворения, например ахондроплазии или заболевания, передающегося по наследству от отца.
Окончательный диагноз ахондроплазии и летальной дисплазии по NIPT был доступен на исследовательской основе с 2007 года и одобрен для использования в обычной клинической практике в Великобритании в 2012 году. NIPT может поставить окончательный диагноз без необходимости инвазивного тестирования, обеспечить дифференциацию между летальной дисплазией и ахондроплазией, обе из которых возникают из-за мутаций в гене рецептора фактора роста фибробластов 3 (FGFR3). Определение разницы между этими двумя состояниями при ультразвуковой пренатальной диагностике может быть сложной задачей, поскольку они имеют много общих черт, таких как выпячивание лобной кости, относительная макроцефалия, короткие конечности и короткие фаланги пальцев, уменьшение грудной клетки. Данные признаки более выражены при летальной дисплазии. NIPT также может предложить более точный диагноз в случае многоплодной беременности с одним нормальным плодом, и НЕ допустить при этом выкидыша нормального плода. Диагностика NIPT осуществляется в 9 недель беременности, то есть раньше, чем инвазивное тестирование, которое не может быть выполнено до 11 недель, и гораздо раньше, чем постановка диагноза на УЗИ.
Использование cffDNA для диагностики моногенных расстройств имеет большой потенциал. В Великобритании метод был одобрен для использования в Национальной службе здравоохранения (NHS) для скрининга мутаций в FGFR3 (ахондроплазии и летальной дисплазии) и FGFR2 (Apert syndrome) генов и исключения распространенных мутаций муковисцидоза. С введением этих безопасных испытаний мы наблюдаем резкое снижение использования инвазивных тестов для выявления моногенных расстройств с последующим снижением послеманипуляционных осложнений.
Cell-free DNA тест для анеуплоидии
Использование тестирования cfDNA для анеуплоидии приводит к радикальным изменениям в практике фетальной медицины.
Для выявления трисомии 21 используется NGS для NIPT, что доступно в частном секторе в более чем 50 странах, с уровнем обнаружения более 99% для трисомии 21 и чуть выше для трисомии 18 и 13 на уровне около 96% и 92% соответственно.
Хотя NIPT является более точным, чем обычный комбинированный скрининг (УЗИ-скрининг, определение РАРР-А и ХГ) в первом триместре беременности, NIPT следует рассматривать как высокочувствительный скрининг, а не окончательный диагноз. Любой положительный результат должен быть подтвержден инвазивным тестированием, в идеале амниоцентезом или, как минимум, кариотипированием на культивируемых ворсинах хориона, чтобы избежать случаев плацентарного мозаицизма, материнских хромосомных перестроек или мозаичности.
Ложные результаты NIPT диагностируются в 5% случаев. Они, как правило, вызваны низкой эмбриональной фракцией cffDNA, чаще всего на ранних сроках беременности, так как количество cffDNA увеличивается с плацентарной массой и сроком гестации, или высоким индексом массы тела матери, когда низкая фетальная фракция была оценена как патология, хотя это произошло на фоне высокого уровня материнской cffDNA, полученной из жировой ткани. В ситуациях, связанных с небольшим плацентарным объемом, например, трисомии 13 и 18 уровень фетальной фракции будет ниже.
NIPT для анеуплоидии теперь доступен широко по всему земному шару, хотя, в настоящее время только в частном секторе. Стоимость тестирования остается высокой, но она уже значительно снизилась, ведутся переговоры о том, как это может быть реализовано в здравоохранении на государственном уровне.
Вывод
В настоящее время NIPT может надежно использоваться только для выявления основных трисомий и хромосомных аномалий, сцепленных с полом. Несмотря на это, ряд компаний начали коммерческие тесты для ограниченного круга микроделеционных синдромов, в том числе Di George (22q-), Wolf-Hirschhorn (4p-), Cri-du-Chat (5p-), Prader-Willi. Эти тесты, в основном, были разработаны с использованием искусственно полученных образцов, однако, обоснованные данные по валидизации, характеризующие чувствительность, специфичность и прогностическую ценность в образцах материнской плазмы еще не опубликованы. Хотя такой подход может повысить выявления патогенных мутаций, существует опасение, что с помощью расширенного NIPT может увеличиться количество ложноположительных результатов.
ативная мать
Второе клиническое применение теста cffDNA – определение резус-принадлежности плода у RhD-отрицательных матерей. Как и в случае определения пола плода, это возможно потому, что резус-отрицательная мать не производит никаких копий гена RhD (RHD), и, таким образом определение RHD в материнской крови происходит от плода, который унаследовал ген от отца. За последнее десятилетие фетальное RHD генотипирование у резус-отрицательных женщин со значительными титрами анти-RhD иммуноглобулина было возможно с использованием полимеразной цепной реакции (ПЦР). Такой подход к ведению этих беременных высокого риска приводит к избеганию необходимости инвазивного тестирования, которое требовалось раньше. NIPT обходит необходимость оценки родительского фенотипа, который может не быть известным. Если плод резус положительный, необходимо усиленное наблюдение за возможным развитием анемии или отека плода.
Внедрение высокопроизводительных технологий для массового RHD генотипирования может обеспечить целевое введение анти-D иммуноглобулина. В настоящее время многие страны предлагают дородовую иммунную профилактику для всех резус-отрицательных матерей, на сроке гестации 26-28 недель, что значительно снижает частоту резус-сенсибилизации. Но это приводит к ненужному введению анти-D иммуноглобулина примерно у 38% RhD-отрицательных женщин, которые несут резус-отрицательный плод. Рутинное RHD генотипирование плода может улучшить иммунопрофилактику, ориентированную на женщин с высоким риском, в результате снижается темп аллоиммунизации, а впоследствии и необходимость внутриутробного переливания крови.
Неинвазивное пренатальное тестирование для моногенных расстройств
Использование cffDNA в выявлении моногенных расстройств значительно сложнее технически, чем генотипирование RHD или определение пола плода. В настоящее время используется в клинической практике только для выявления аллелей, которые возникли в момент оплодотворения, например ахондроплазии или заболевания, передающегося по наследству от отца.
Окончательный диагноз ахондроплазии и летальной дисплазии по NIPT был доступен на исследовательской основе с 2007 года и одобрен для использования в обычной клинической практике в Великобритании в 2012 году. NIPT может поставить окончательный диагноз без необходимости инвазивного тестирования, обеспечить дифференциацию между летальной дисплазией и ахондроплазией, обе из которых возникают из-за мутаций в гене рецептора фактора роста фибробластов 3 (FGFR3). Определение разницы между этими двумя состояниями при ультразвуковой пренатальной диагностике может быть сложной задачей, поскольку они имеют много общих черт, таких как выпячивание лобной кости, относительная макроцефалия, короткие конечности и короткие фаланги пальцев, уменьшение грудной клетки. Данные признаки более выражены при летальной дисплазии. NIPT также может предложить более точный диагноз в случае многоплодной беременности с одним нормальным плодом, и НЕ допустить при этом выкидыша нормального плода. Диагностика NIPT осуществляется в 9 недель беременности, то есть раньше, чем инвазивное тестирование, которое не может быть выполнено до 11 недель, и гораздо раньше, чем постановка диагноза на УЗИ.
Использование cffDNA для диагностики моногенных расстройств имеет большой потенциал. В Великобритании метод был одобрен для использования в Национальной службе здравоохранения (NHS) для скрининга мутаций в FGFR3 (ахондроплазии и летальной дисплазии) и FGFR2 (Apert syndrome) генов и исключения распространенных мутаций муковисцидоза. С введением этих безопасных испытаний мы наблюдаем резкое снижение использования инвазивных тестов для выявления моногенных расстройств с последующим снижением послеманипуляционных осложнений.
Cell-free DNA тест для анеуплоидии
Использование тестирования cfDNA для анеуплоидии приводит к радикальным изменениям в практике фетальной медицины.
Для выявления трисомии 21 используется NGS для NIPT, что доступно в частном секторе в более чем 50 странах, с уровнем обнаружения более 99% для трисомии 21 и чуть выше для трисомии 18 и 13 на уровне около 96% и 92% соответственно.
Хотя NIPT является более точным, чем обычный комбинированный скрининг (УЗИ-скрининг, определение РАРР-А и ХГ) в первом триместре беременности, NIPT следует рассматривать как высокочувствительный скрининг, а не окончательный диагноз. Любой положительный результат должен быть подтвержден инвазивным тестированием, в идеале амниоцентезом или, как минимум, кариотипированием на культивируемых ворсинах хориона, чтобы избежать случаев плацентарного мозаицизма, материнских хромосомных перестроек или мозаичности.
Ложные результаты NIPT диагностируются в 5% случаев. Они, как правило, вызваны низкой эмбриональной фракцией cffDNA, чаще всего на ранних сроках беременности, так как количество cffDNA увеличивается с плацентарной массой и сроком гестации, или высоким индексом массы тела матери, когда низкая фетальная фракция была оценена как патология, хотя это произошло на фоне высокого уровня материнской cffDNA, полученной из жировой ткани. В ситуациях, связанных с небольшим плацентарным объемом, например, трисомии 13 и 18 уровень фетальной фракции будет ниже.
NIPT для анеуплоидии теперь доступен широко по всему земному шару, хотя, в настоящее время только в частном секторе. Стоимость тестирования остается высокой, но она уже значительно снизилась, ведутся переговоры о том, как это может быть реализовано в здравоохранении на государственном уровне.
Вывод
В настоящее время NIPT может надежно использоваться только для выявления основных трисомий и хромосомных аномалий, сцепленных с полом. Несмотря на это, ряд компаний начали коммерческие тесты для ограниченного круга микроделеционных синдромов, в том числе Di George (22q-), Wolf-Hirschhorn (4p-), Cri-du-Chat (5p-), Prader-Willi. Эти тесты, в основном, были разработаны с использованием искусственно полученных образцов, однако, обоснованные данные по валидизации, характеризующие чувствительность, специфичность и прогностическую ценность в образцах материнской плазмы еще не опубликованы. Хотя такой подход может повысить выявления патогенных мутаций, существует опасение, что с помощью расширенного NIPT может увеличиться количество ложноположительных результатов.






14.10.2019
Карпенко Юрій