Paolo Ricci, Elena Maggini, Ester Mancuso, Pietro Lodise, Vito Cantisani, Carlo Catalano
Dipartimento di scienze Radiologiche, Oncologiche ed Anatomo-Patologiche, “Sapienza” Università di Roma, Policlinico Umberto I, Viale del Policlinico, 15500161 Rome, Italy
Резюме. Эластография молочной железы – это новый ультразвуковой метод визуализации для характеристики очаговых поражений молочной железы в дополнение к обычному ультразвуковому исследованию (УЗИ) и маммографии. Эластография позволяет провести неинвазивную оценку жесткости патологического очага. Существует два технических доступа для клинического применения: free-hand ультразвуковая эластография (УЗЭ) и эластография сдвиговой волны (shear wave elastography – SWE). Предварительные результаты этих методов в клинических исследованиях свидетельствуют о том, что эластография значительно улучшает способность ультразвука дифференцировать доброкачественные очаги молочной железы от злокачественных, таким образом уменьшая количество биопсий доброкачественных узлов молочной железы. Эта обзорная статья, основана на углубленном литературном поиске подчеркивает основы эластографии молочной железы, включая основные технические функции, ограничения, ошибки и представляет результаты обширных клинических исследований.
Ультразвуковая диагностическая система с технологией эластографии сдвиговой волны Siemens Acuson S2000. Лучшие предложения от компании RH.
ВВЕДЕНИЕ
Маммография и ультразвуковое исследование (УЗИ) часто применяются при характеристике новообразований молочной железы, они позволяют установить риск малигнизации. Оба метода имеют определенные ограничения. Маммография достаточно часто выдает ложноотрицательные результаты при обследовании плотных молочных желез. УЗИ – высокочувствительный инструмент для обнаружения патологических очагов, но владеет слабой специфичностью. Различные признаки очага могут быть оценены по BI-RADS критериям, которые, к сожалению, выдают значительное количество ложноположительных результатов, что приводит к увеличению количества проведенных биопсий и плохой вероятности обнаружения рака (10-30%).
УЗЭ была внедрена как дополнительный режим визуализации для улучшения характеристики очагов. Этот метод способен оценить жесткость очага путем картирования деформации тканевых элементов, которые поддаются наружной компрессии. Эластичность – это способность ткани восстановить исходный размер и форму после наружной деформации (стресс), а деформация – это уровень изменения в размере или форме после наружной компрессии (стресс). Данные об эластичности записываются в цветном кодировании и накладываются на снимки УЗИ для получения четкой оценки взаимоотношения между деформацией и патологическим очагом.
Эластография – это новый метод, с некоторыми технологическими решениями, и ее роль в клинической практике до сих пор не установлена.
Целью этой работы является систематический обзор недавно опубликованной литературы о диагностических способностях эластографии для того, чтобы установить ее потенциал в дифференцировании добро- и злокачественных новообразований молочной железы.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эластография – это метод для оценки эластичности тканей. Данные получены с помощью эластографии подобные к тем, которые можно получить при пальпации, но эластографическая визуализация более чувствительная и менее субъективная потому, что паренхима визуализируется и может быть проанализирована, используя специальное программное обеспечение. Эластичность – это свойство ткани деформироваться под наружной силой и вернуться к исходному размеру и форме после прекращения действия наружной силы. Деформация обратно пропорциональная жесткости ткани и возобновлению исходного состояния (т.е. время реакции). Как правило, жировая ткань легко деформируется, в то время как фиброзная или раковая ткани возвращаются к исходному состоянию более медленно, чем жировая или мышечная ткани. Эластография молочной железы проводится двумя разными методами: компресионная УЗЭ и эластография сдвиговой волны (shear wave elastography – SWE). Акустическая импульсно-волновая эластография (ARFI) и метод сверхзвуковой визуализации сдвиговой волны (Supersonic shear-wave imaging – SSI) – воплощение SWE технологии.
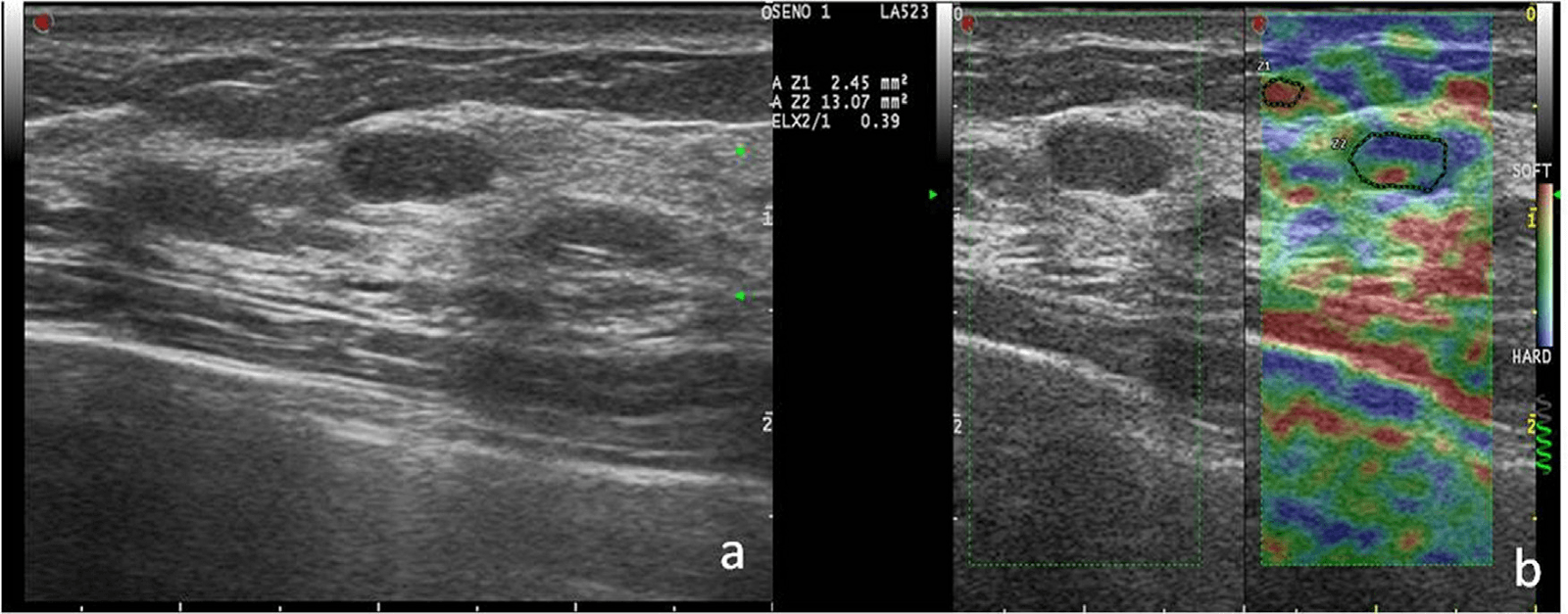
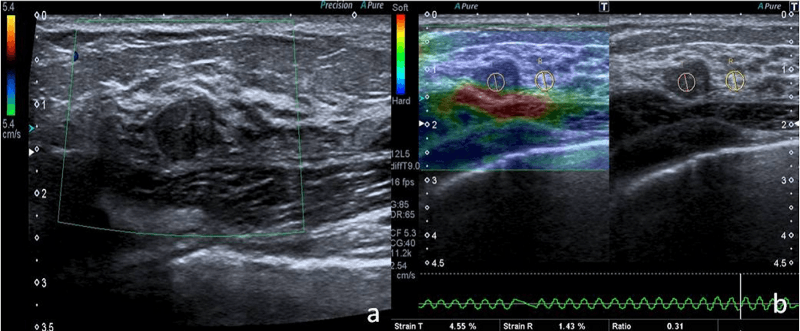
Рис. 1. Гипоэхогенный узел с правильными и хорошо определяемыми краями у 45 летнего пациента (а), с артериальными полюсами по периферии слева. Качественный анализ (b) показывает цветовое картирование с оценкой между 2 и 3 по шкале Уэно-Ито (за счет синей области посередине). Эта картина относится к средне-высокой эластичности. Гистологическое исследование показало доброкачественную фиброаденому.
2.1. Free-hand ультразвуковая эластография
Free-hand УЗЭ или компрессионная эластография (strain elastography) основана на применении компрессионной силы на молочную железу и на измерении эффекта деформации формы, таким образом, обеспечивая информацию о данных жесткости очага по сравнению с окружающими тканями. Компрессия происходит путем нанесения небольшой ручной компрессии/декомпрессии, используя обычный датчик. В качестве альтернативы, деформацию можно определять с помощью дыхательных движений. Эта методика позволяет делать исключительно качественный и полукачественный анализ очага потому, что усилие нанесенное рукой не распознается аппаратурой, таким образом, можно вычислить только способность к деформации (strain ratio), но не абсолютную эластичность.
2.1.1. Качественная оценка при использовании УЗЭ
При качественной оценке ткани молочной железы, эластичность кодируется в цветовое картирование и накладывается на снимки В-режима, (похоже на цветной допплер) (Рис. 1-3).
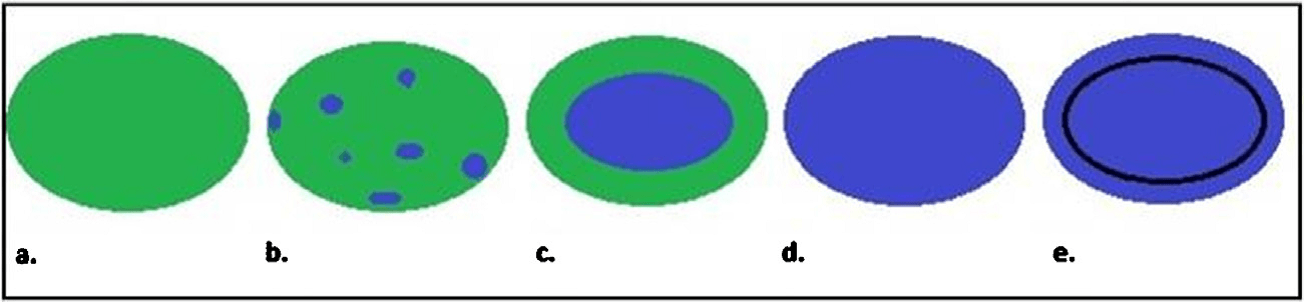
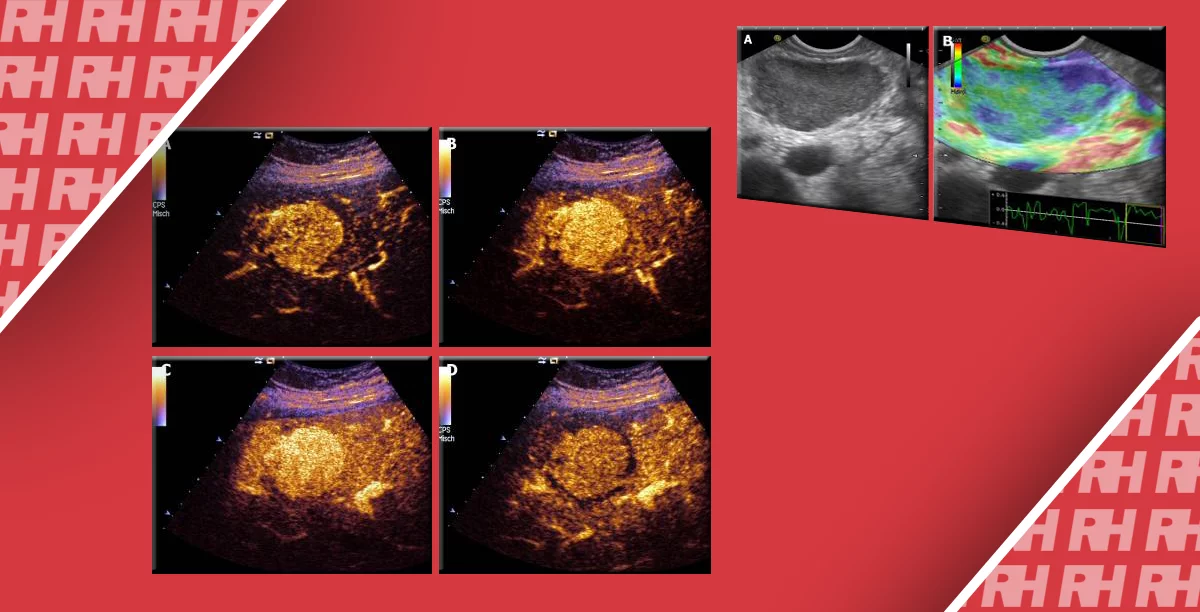
Эластический снимок отображает картину движения ткани, которое происходит в каждой области молочной железы вследствие деформации. Разные цвета в снимках отображают различные уровни эластичности. В одном из первых клинических исследований способности эластографии молочной железы, Itoh et al. предложили пятибальную шкалу для описания эластического поведения очага, обозначая мягкость зеленым цветом, а жесткость – синим. Один балл по шкале – это очаг с мягкой деформацией с полностью зеленой окраской; 2 балла – это очаг с мозаической окраской зеленого, красного и синего; 3 балла – это очаг с синим цветом посередине и зеленым по периферии; 4 балла – это очаг с жесткой деформацией полностью синего цвета без окружающей области; 5 баллов – это очаг с жесткой деформацией, полной синей окраской и с окружающей областью (Рис. 4). В работе Itoh et al., согласно исследованию 111 узлов (59 доброкачественных, 52 злокачественных, с размером <30 мм), если установить пороговое значение между 3 и 4 баллами, УЗЭ имела чувствительность – 86,5%, специфичность – 89,8% и точность – 88,3%. Используя пороговое значение между 4 и 5 за BI‑RADS, УЗИ достигло чувствительности 71,2%, специфичности 96,6% и точности 84,7%.
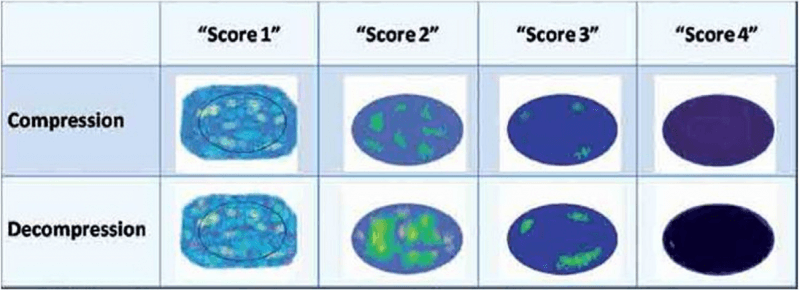
Как сообщили Gong et al., стандартизированная компрессия, оказанная на ткань датчиком, никогда не была установлена в разных работах. Три года спустя в исследованиях Itoh et al., была предложена новая качественная оценка (4-х балльная шкала), при которой использовали снимок очага не только до и во время компрессии, но и после нее – для того, чтобы она была совместимая с системой BI-RADS. Один балл по шкале Флери – очаги с таким же спектром цветов, как в окружающей ткани молочной железы; 2 балла – очаги у которых после декомпрессии было покрыто более 50% очага вариациями цветов мягких тканей; 3 балла – очаги у которых после декомпрессии было покрыто менее 50% очага (от 10% до 50%) вариациями цветов; и 4 балла – очаги без значительной вариации цветов во время компрессии и декомпрессии (Рис. 5).
Авторы сообщили, что положительное прогностическое значение (ППЗ), специфичность и диагностическая точность составляли 76,5%, 95,9% и 94,7% соответственно. Из 228 исследованных очагов, 26 были истинно положительными, 8 – ложноположительными, 190 – истинно отрицательными и 4 – ложноотрицательными. Была связь между гистологическими результатами и тестом Фишера (p<0,05), также был получен отличный показатель площади под ROC-кривой – 0,954 (доверительный диапазон 95%, 0,925-0,982). Тем не менее, эта система оценки не широко применяется, а шкала Уэно-Ито считается справочным источником для эластосонографии молочной железы.
В мультицентровом итальянском исследовании предложено классификацию, которая состоит из пяти баллов: 1 балл для три-стратифицированной картины, характерной для кисты; 2 балла для эластического очага; 3 балла для эластического очага с областями жесткой ткани в пределах очага; 4 балла для очага, который в основном не деформируется; 5 баллов для очага, который не деформируется и окружен жесткой тканью.
Рис. 2. Гипоэхогенный узел с правильными и хорошо определяемыми краями у 25 летнего пациента (а). Качественный анализ (b) показывает цветовую картину 2 балла по шкале Уэно-Ито (мозаика разных цветов: синий, зеленый и красный). Эта картина характерна для средней эластичности. Гистологическое исследование показало доброкачественную фиброаденому.
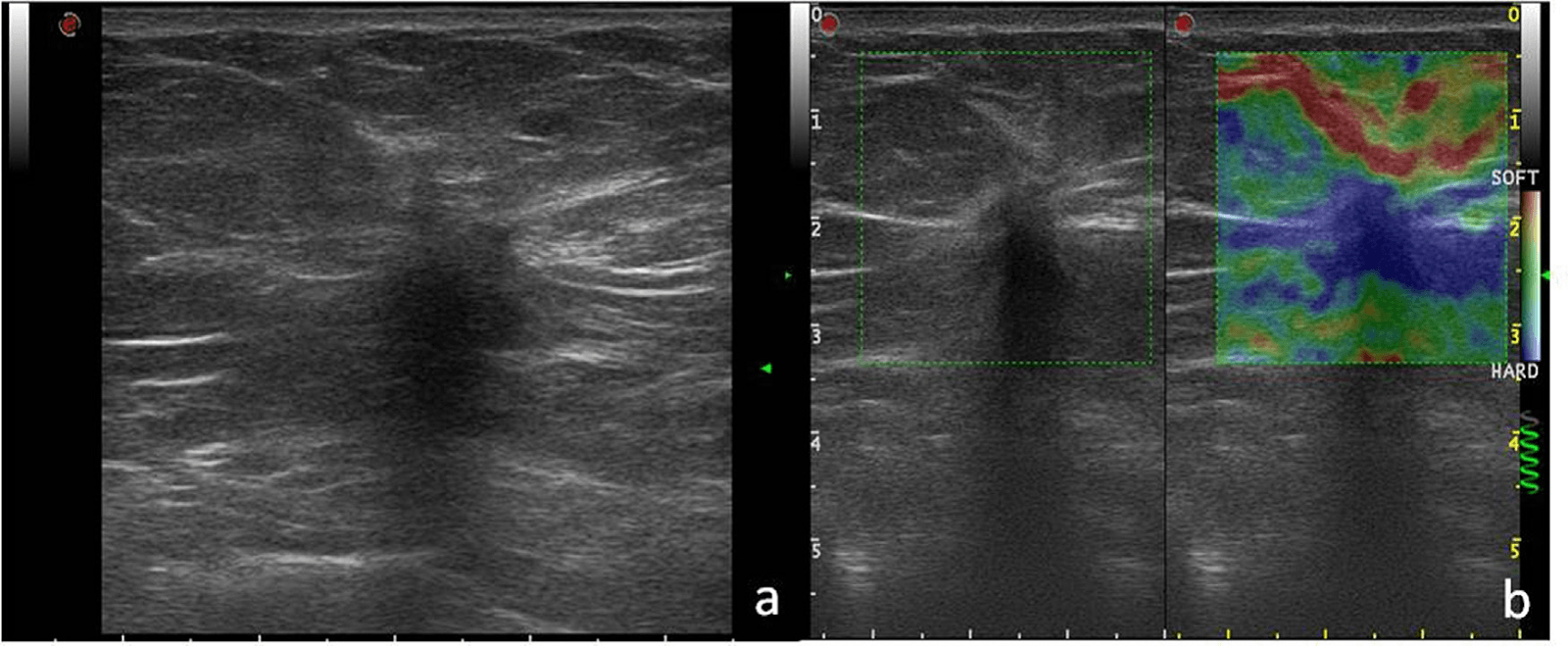
Рис. 3. Гипоэхогенный узел с неправильными краями, микрокальцификатами и сильной задней акустической тенью (а). Качественный анализ (b) показал полностью синюю цветовую картину, 5 баллов по шкале Уэно-Ито. Гистологическое исследование показало инфильтрирующую протоковую карциному.
Учитывая эволюцию качественного анализа, мы наблюдали за прогрессивным возрастанием чувствительности от значения 79% (описано в ранних исследованиях) до 93% (самые последние исследовательские работы). Статистический недостаток качественной эластографии, при исследовании патологических очагов молочной железы, представлен диапазоном значений специфичности между 68% и 79%. Что касается диагностической точности, Raza сообщили о ППЗ до 76%, а отрицательное прогностическое значение (ОПЗ) достигает 96%.
Качественная эластография, как самостоятельное исследование не превосходит УЗИ по диагностической способности.
2.1.2. Полуколичественная оценка УЗЭ
Полуколичественный подход был предложен для того, чтобы получить более объективную и менее оператор-зависимую ручную методику для идентификации добро- и злокачественных очагов путем сравнения разницы эластического поведения между очагом и нормальной окружающей тканью. Эту оценку провели в некоторых работах, используя числовое соотношение (соотношение деформируемости (strain ratio)) между деформацией нормальной ткани и очагом, или разницу размера очага до и после компрессии (соотношении длины (length ratio)).
Соотношение деформируемости вычисляется от исследуемой области (среднестатистическое значение плотности цветных пикселей) к контурам очага, аналогичная исследуемая область устанавливалась вблизи к жировой ткани. Жировая ткань имеет постоянное абсолютное значение независимо от компрессионной нагрузки, особенно если она находится на одной глубине с исследуемым очагом. Соотношение деформируемости отражает относительную жесткость очага (Рис. 6-8).
Соотношение длины вычисляется путем получения максимальной горизонтальной длины очага (измеряется на УЗ снимках). В доброкачественных очагах поперечные диаметры, которые измерены на эластографических снимках, всегда были идентичными или меньшими, по сравнению с диаметрами опухолей на снимках, сделанных в В-режиме, в то время как диаметры злокачественных опухолей были больше на эластографических снимках, чем на снимках сделанных в В-режиме.
Sadigh et al. провели мета-анализ, включая некоторые опубликованные работы, которые оценивали диагностическую способность эластографии, и сообщили данные о соотношении деформируемости или соотношении длины для описания очаговых поражения молочной железы. Из этих оценённых работ, 12 подходили по критериям включения (9 по соотношению деформируемости и 3 по соотношению длины). В 9-ти исследовательских работах, что касались соотношения деформируемости, анализировали 2087 новообразований молочной железы с чувствительностью и специфичностью 88% и 83% соответственно. В 3 работах, что касались соотношения длины, анализ 450 новообразований молочной железы продемонстрировал чувствительность и специфичность 98% и 72% соответственно. Положительные и отрицательные соотношения вероятности составляли 5,57 и 0,14 соответственно.
Рис. 4. Критерии оценки по шкале Itoh et al. для патологических очагов молочной железы. (а) Один балл для гипоэхогенного очага, равномерно окрашенного зеленым цветом. (b) Два балла для гипоэхогенного очага с мозаической картиной синего и зеленого цвета. (с) Три балла для эластичного, с деформацией по периферии, гипоэхогенного очага (зеленый цвет) с синем цветом посредине. (d) Четыре балла для очага с деформацией по периферии (синий цвет) и без деформации во всем гипоэхогенном очаге. (е) Пять баллов при отсутствии деформации во всем гипоэхогенном очаге и в окружающей его ткани (оба синие).
Рис. 5. Новая качественная система классификации предложена Fleury et al. (4-х балльная шкала), для которой используют снимок до компрессии и вовремя декомпрессии. Один балл для очагов с одинаковым спектром цветов с окружающей тканью. Два балла для очагов, у которых после декомпрессии было покрыто более 50% площади вариациями цветов мягких тканей. Три балла для очагов, у которых после декомпрессии было покрыто менее 50% площади вариациями цветов (от 10% до 50%). Четыре балла для очагов без значительной вариации цветов во время компрессии и декомпрессии.
Согласно этим данным, соотношение деформируемости показывает увеличение специфичности метода эластографии. Однако, полуколичественный метод забраковали из-за недостатка стандартизации, поскольку в литературе разные автора описывают разные пороговые значения.
2.2. Эластография сдвиговой волны (SWE)
Сдвиговые волны могут быть незнакомыми для клиницистов, но они распространенные и часто возникают в мягких тканях человека, в которых они проводятся поперечным смещением частиц.
Таким образом, сдвиговые волны обладают подобными свойствами с ультразвуковыми волнами, которые применяют в обычном УЗИ, поскольку они есть механическими волнами и проводятся мягкой тканью. Но они имеют ключевые отличия: поперечные, быстро затухают в тканях, их скорость гораздо медленнее (от 1 до 10 м/с), они не поддерживаются жидкостями низкой вязкости. Скорость сдвиговой волны тесно связана с модулем эластичности Юнга и существует упрощенная формула для конвертации: СS (скорость сдвиговой волны) на Е (модуль Юнга). Сдвиговые волны генерируются любым механическим воздействием и возникают естественным путем при мышечных движениях (произвольные, сердечные т.д.), а также ультразвуковыми системами, которые используют для измерения их скорости.
SWE возможная при применении двух разных систем. В одной маленькая исследуемая область (ИО) (обычно 5 мм х 10 мм) устанавливается в пределах исследуемой ткани, а данные о скорости сдвиговых волн записываются. Этот режим можно считать прицельной SWE. В другой системе, чувствительная ИО обеспечивает визуализацию в полуреальном времени (приблизительно 1 кадр/с) цветового картирования скорости сдвиговой волны, что позволяет делать качественный и количественный анализ (ИО дает точные данные).
Можно выделить два важные преимуществ SWE: система «перемещает» саму ткань и не требуется компрессия датчиком для получения количественных данных (т.к. скорость волны давления, максимальная жесткость, среднестатистическая жесткость, стандартное отклонение, т.д.). На сегодняшний день доступны две технологии сдвиговых волн: акустическая импульсно-волновая эластография (Acoustic radiation force impulse – ARFI) и сверхзвуковая визуализация сдвиговой волны (Supersonic shear imaging – SSI.
2.2.1. Акустическая импульсно волновая эластография (ARFI)
Акустическая импульсно волновая эластография – это новый метод визуализации эластичности, который неинвазивно оценивает эластичность и жесткость тканей. Два метода для ARFI визуализации включают virtual touch визуализацию тканей (virtual touch tissue imaging – VTI) и virtual touch квантификацию тканей (virtual touch tissue quantification – VTQ), которые применяются для определения качественной и количественной жесткости очагов молочной железы.
При измерении VTI, ИО должна устанавливаться в пределах новообразования. Для получения необходимых снимков, датчик нужно приложить с небольшим давлением, чтобы обеспечить плотный контакт с молочной железой.
Рис. 6. Гиперэхогенный очаг с правильными краями и плохой васкуляризацией (а). Соотношение деформируемости, измеренное путем установления двух разных ИО (нормальная ткань и в пределах очага), составляло 0,31 (b). Цитологическое исследование показало доброкачественную фиброаденому.
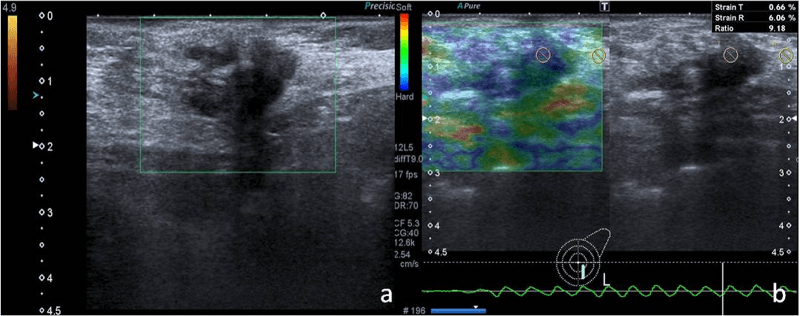
Рис. 7. Выраженный гиперэхогенный очаг с неправильными краями, с задней акустической тенью и плохой васкуляризацией (а). Q-elastography исследование вывело соотношение деформируемости – 9.18 (b). Гистологическое исследование после операции показало инфильтрирующую протоковую карциному.
Этот ARFI метод визуализации деформации тканей предоставляет качественную картину в серой шкале, обозначая относительную эластичность тканей в ИО, которая выбрана исследователем на УЗ снимке. Более светлые участки относятся к более деформированной ткани. При использовании VTQ технологии, независимый механический ультразвуковой луч генерирует перпендикулярные сдвиговые волны, которые локализируются периферийнее установленной ИО. Эти смещения могут индуцировать латеральное проникновение сдвиговой волны, которая фиксируется, используя латерально расположенные ультразвуковые «фиксирующие» лучи. Путем измерения сдвиговой волны, скорость в пределах ткани может быть реконструирована. Скорость проникновения сдвиговой волны прямо пропорциональна квадратному корню эластичности ткани и выражается в м/с. В итоге, чем жестче ткань, тем быстрее проникновение сдвиговой волны. Поэтому, VTQ может количественно описать жесткость ткани. Среднестатистические диапазоны скорости сдвиговой волны колебаються от 4,49 до 8,22 ± 1,27 м/с в злокачественных очагах, и от 2,25 ± 0,59 до 3,25 ± 2,03 в доброкачественных очагах. Пороговое значение составляет 3,065 м/с.
2.2.2. Сверхзвуковая визуализация сдвиговой волны (SSI)
Важный вклад в эластографическую оценку патологических очагов молочной железы внесла технология ARFI – оценка эластичности сдвиговой волны, используя программное обеспечение сверхзвуковой визуализации. Некоторые функции этого метода подобные к ARFI технологии, и недавно были разработаны компанией SuperSonic. Эта компания разработала метод количественной эластографии, используя сверхзвуковую визуализацию сдвиговой волны (SSI).
Сама система индуцирует механические вибрации акустической импульсной волны, что сгенерирована прицельным ультразвуковым лучом. Для захвата проникновения сдвиговых волн применяется очень быстрый (5000 кадров/с) УЗ режим. Эта технология доступна при использовании высокочастотных датчиков. Смещения индуцированные в тканях генерируют сдвиговую волну, которая обеспечивает информацией о локальных вязкоэластичных свойствах ткани.
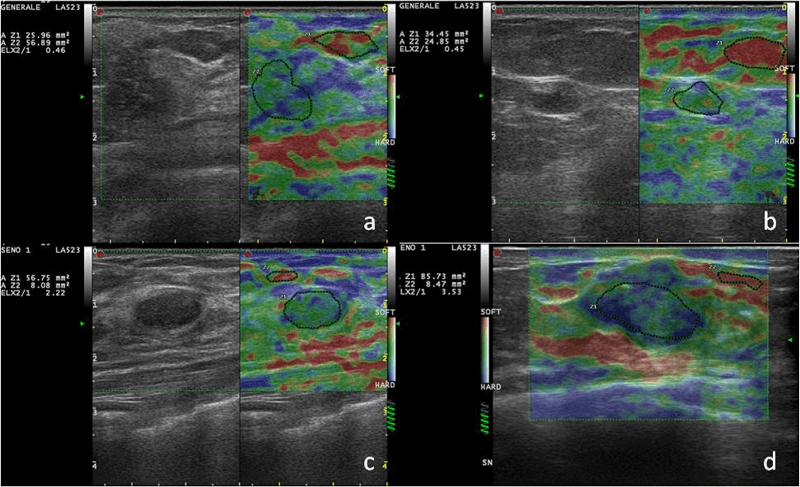
Рис. 8. Разные очаги с разными соотношениями деформируемости (strain ratio) у одного пациента. Фокальный аденоз с соотношением деформируемости 0,46 (а); фиброаденома небольшого размера с соотношением деформируемости 0,45 (b); более большая фиброаденома с соотношением деформируемости 2,22 (с); протоковая инфильтрирующая карцинома с соотношением деформируемости 3,53 (d);
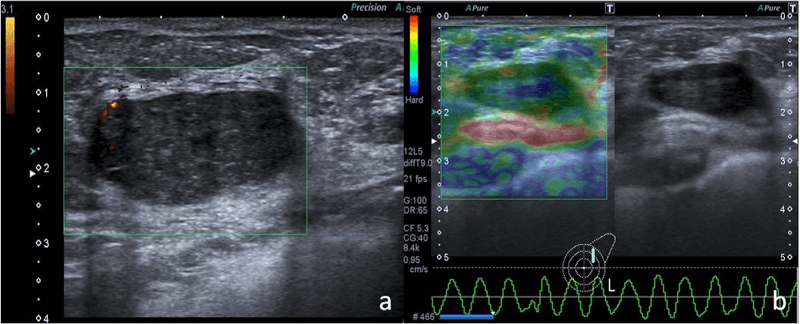
В отличие от метода ARFI, информация о жесткости ткани выражается в кПа. Для наилучшей оценки, снимки отображаются в цветовом картировании, связанным со значениями в кПа (от 0 до 240 кПа). Значения, показаны в клинических исследованиях, варьировали от 42-45 ± 41,1 кПа в доброкачественных очагах и 146,6 ± 40,05 кПа в злокачественных очагах. Некоторые автора предложили среднестатистическое пороговое значение эластичности 50 кПа для дифференциации добро- от злокачественных очагов [33]. Также, визуальная оценка очагов должна быть произведена за четырёхступенчатой системой: картина 1 – гомогенный синий цвет (без изменений); картина 2 – артефакты в форме вертикальных полос; картина 3 – локализированные цветные участки по краям очага; картина 4 – гетерогенные цветные участки в самом очаге. Картины 1 и 2 считаются доброкачественными, а картина 3 и 4 указывают на злокачественность образования.
В одной из последних статей, опубликованная в 2012 году Evans et al., описаны интересные результаты о эластичности с чувствительностью 95%, специфичностью 77%, ППЗ 84%, ОПЗ 91% и точностью 86% (все p>0.05).
КЛИНИЧИСКИЕ ПРИМЕНЕНИЯ
3.1. Доброкачественные поражения молочной железы
Термин «доброкачественные поражения молочной железы» включает гетерогенную группу очагов, которые представляют собой широкий спектр симптомов или те, которые могут быть найдены случайно при микроскопическом исследовании.
Частотность доброкачественных поражений молочной железы возрастает во втором десятилетии жизни и достигает пика в четвертом и пятом десятилетии, в то время как встречаемость злокачественных поражений возрастает после менопаузы, но в менее быстром темпе.
Доброкачественные поражения молочной железы могут быть распространёнными или фокальными.
В первом случае увеличенное количество компонентов эпителиальной и соединительной ткани определяется в виде расширенного ультрасонографического полиморфизма с частыми микрокистозными структурами и дилатацией протоков. Некоторые патологические состояния, т.к. склерозирующий аденоз, могут иметь похожую со злокачественным очагом картину. Эластография дает возможность описать различные компоненты и получить данные о их эластичности, даже если этот метод более подходит для исследования фокальных патологий.
Фокальные доброкачественные поражения выглядят как гипоэхогенные (плотная нодулярная болезнь) или анэхогенные участки, чаще всего с правильной формой и четкими краями. Эти узлы обычно имеют округлую или овальную форму с «широко-низким» видом, что указывает на параллельную ориентацию к стенке грудной клетки. УЗ структура часто гомогенная с большой вариацией эхогенности. Васкуляризация варьирует в зависимости от гистологической природы узла.
Как правило, доброкачественные очаги более твердые, чем нормальная ткань молочной железы, но мягче, чем злокачественные опухоли. Исключениям могут быть такие: доброкачественные очаги как гиалинизированные фиброаденомы и жировой некроз, которые иногда плотные при пальпации и могут привести к ложноположительным результатам при эластографическом исследовании.
Доброкачественные очаги описываются на эластографии как очаги с низкой оценкой по цветовому картированию (1-2 балла), и лучшее пороговое значение для дифференциации добро- от злокачественных новообразований припадает на границу 3-4 балла по классификации цветового картирования, согласно системе оценки Уэно-Ито.
Rizzatto et al. провели многоцентровое исследование в котором 874 очага молочной железы оценивали с помощью УЗЭ (614 доброкачественных, 260 злокачественных) по 5 балльной системе (не по системе Ито). Обнаруженная высокая специфичность в доброкачественном очаге с ОПЗ 98% в группе в общем и 100% для очагов < 5 мм.
Согласно обзорной статье Sadigh et al., в которой оценивались исследовательские работы 2010-2011 годов, пороговое значение колебалось от 0,5 до 4,5. В этих роботах при оценке эластичности устанавливали более точные значения соотношения деформируемости, чем для соотношения длины (Рис. 8а).
Опыт в исследовании квантификации тканей очагов молочной железы с помощью ARFI технологии явно недостаточный, поскольку опубликовано всего лишь несколько статей. В недавно опубликованной работе Tozaki et al. установили пороговое значение 3,59 м/с, а Bai et al. предложили 3,065 м/с. По данным Tozaki et al., среднестатистическая скорость в 76,5% злокачественных очагов была выше, чем у доброкачественных (4,49 м/с по сравнению с 2,68 м/с). В 23,5 % злокачественных очагов, измерение скорости сдвига было невозможным.
Bai et al. обнаружили для доброкачественных очагов меньшие значения, чем пороговые – от 2,25 ± 0,59 м/с (среднестатистическое ± стандартное отклонение). Подозрительные очаги на УЗИ, которые потом оказывались доброкачественными имели среднестатистическое ARFI значение 2,93 м/с с диапазоном 1,09-6,33 (p<0.0001).
Недавно опубликованное многоцентровое исследование, показало, что при SWE наиболее высокой специфичностью владели доброкачественные очаги, не влияя на чувствительность. Была обнаружена связь со значением модуля Юнга Еmax ≤ 80 кПа, представленная в синий цветовой картине. Для злокачественных очагов наиболее часто встречалось значение Еmax ≥ 160 кПа с гетерогенной цветовой картиной.
Сложные кисты, фиброаденомы, жировой некроз и радиальные рубцы часто ассоциируются с многослойной эластографической цветовой картиной [39,40]. Это, скорее всего, артефакт цветового распределения по причине недостатка эхо, что влияет на деформируемость и часто стает причиной ошибок в измерении.
На эластографии, кисты обычно выглядят как твердые малодеформируемые очаги, часто с синей цветовой картиной и с высоким соотношением деформируемости, из-за низкой способности к сжатию.
Эластографические свойства фиброаденом спорные. Некоторые исследования сообщают про существенную разницу фиброзных компонентов от окружающей паренхимы, в то же время другие автора описывали фиброаденомы как сложные для оценки с помощью цветового картирования, потому что они имеют похожую с молочной железой эластичность . Диапазон соотношения деформируемости (strain ratio) описанный большинством авторов для этого специфического типа очага составлял приблизительно 2,1 ± 0,8. Фиброаденомы с большим фибротическим компонентом и плохой целлюлярностью могли иметь подозрительную цветовую картину, но во всех случаях соотношение деформируемости было ниже, чем для злокачественных форм очагов (Рис. 8b и c).
Жировой некроз является исходом травматизма, и часто выглядит как гиперэхогенная полоска с негомогенной формацией фиброза.
Эволюция в сторону склероза может вызвать спорные случаи при разборе дифференциального диагноза. Также, очаг с радиальным склерозированием вызывает архитектонические искажения железы с импозантной фиброзной реакцией окружающей ткани молочной железы, которая иногда дегенерирует или скрывает признаки опухоли (Рис. 8d).
Радиальный рубец со злокачественными новообразованиям в большинстве случаев невозможно легко дифференцировать и на эластографии, поскольку присутствует высокая деформируемость по сравнению с нормальной тканью. С другой стороны, жировой некроз остается тяжелой для диагностики патологией, подтвердить доброкачественность которой можно только путем гистологического исследования.
3.2. Злокачественные поражения молочной железы
Рак молочной железы обычно представляет собой фокальный очаг с элементами злокачественности, такими как: акустическая тень, спикулы, зазубренные края, гиперэхогенный венец с десмопластической реакцией вокруг очага, кальцификаты, распространяющейся по ходу протоков и усиленная в значительной степени васкуляризация. Рак также имеет неспецифические признаки, такие как неравномерная архитектоника и отек железы. В частности, среди таких очагов, папиллярная карцинома представляется как смешанная, с жидким компонентом и плотной проекцией. Инвазивный процесс может проявляться как гиперэхогенная «корона» с спикулированными участками инвазии в окружающие ткани. Диффузная форма характерная для карцином с воспалительными компонентами, в которых кожа утолщенная и гиперэхогенная с общей альтерацией жировой ткани и присутствием анэхогенных прожилок, как результат лимфостаза.
Жесткость опухоли является характерной чертой внеклеточного матрикса, которая модулируется коллагеновым кросс-линкингом (cross-linking). Злокачественные очаги менее уязвимые к деформации давлением, чем нормальная ткань молочной железы и имеют более сложный эластический модуль, что сходится с результатами исследования Krouskop et al. Более мягкие очаги, включая медуллярные, муцинозные, папиллярные, кистозные и некоторые некротические инфильтрирующие протоковые карциномы, встречаются реже.
Иногда дискордантные случаи злокачественных очагов оказываются колликвационным некрозом, геморрагией или наличием саркоматозных компонентов, которые часто возникают в очагах больших размеров или в очень маленьких опухолях, и влияют на эластичность.
Giuseppetti et al. (в их исследовании 91 узел: 27 доброкачественных, 64 злокачественных) установили, что гистологическая форма играет важную роль: протоковые формы могут иметь разные картины эластичности из-за фиброгиалинового компонента и стадии неоплазмы (маленькие протоковые неоплазмы чаще имеют меньший фиброзный компонент), а на эластичность лобулярных форм влияют особенности патологических характеристик, таких как плохая целлюлярная когезия, минимальный гиалиновый фиброз и умеренная термопластическая реакция (особенно в маленьких очагах). Это исследование продемонстрировало УЗЭ с чувствительностью и специфичностью 79% и 89% соответственно для дифференциальной диагностики добро- и злокачественных узлов.
Эластография в основном применяется при исследовании очагов с невыясненной этиологией по классификации BI-RADS 3 и 4, но не меняет медицинский протокол в случаях очагов BI-RADS 1, 2 и 5.
Среднестатистическая оценка эластичности по цветовому картированию была значительно выше для злокачественных очагов, чем для доброкачественных (p<0.001) [8], которые обычно представлены синими участками на цветовой картине.
Zhi et al. сравнивали УЗИ, УЗЭ и маммографию для оценки узлов в плотных молочных железах. Это исследование включало 296 очагов (209 доброкачественных, 87 злокачественных) оцененных по шкале Уэно-Ито. УЗЭ достигла наиболее высокой специфичности (95.7%) и самой низкой вероятности ложноположительного результата (4,3%) по сравнению с другими методами. Большинство ложноотрицательных результатов возникли при обследовании инвазивных протоковых карцином и опухолей с большим участком центрального некроза. Сочетание УЗИ и УЗЭ увеличило чувствительность (89,7%), точность (93,3%), специфичность (95,7%), ППЗ (89,7%) и снизило вероятность ложноотрицательного результата (9,2%).
Полуколичественное исследование показывает злокачественный очаг, включая протоковые раки, как узел с высокими соотношениями деформируемости (пороговое значение между 2 и 3,52) и длины (пороговое значение между 1 и 1,1).
Kumm et al. объединили эластографическую оценку и соотношение деформируемости для описания очага молочной железы низкого риска для того, чтобы уменьшить надобность биопсии. Они исследовали 310 очагов (223 доброкачественные, 87 злокачественные) и получили чувствительность 76% и 79%, специфичность 81% и 76%, ОПЗ – 90% для обоих методов. Эти значения были ниже, чем описанные в других исследованиях, что свидетельствует о слабой надежности соотношения деформируемости.
Yerli et al. в исследовании 78 очагов (62 доброкачественные, 16 злокачественные) оценили комбинацию эластографической оценки и соотношения деформируемости для дифференциальной диагностики добро- и злокачественных очагов. УЗИ достигло чувствительности и специфичности 80% и 95%, эластографическая оценка – 87,5% и 72,6%, соотношение деформируемости с пороговым значением 3,52 – 80% и 93% соответственно. Авторы сделали вывод, что соотношение деформируемости не улучшает точность эластографической оценки.
Используя ARFI метод, злокачественные новообразования имели более высокие значения, чем доброкачественные очаги (Bai et al.) при значении скорости в диапазоне 5,96 ± 2,96 м/с.
Meng et al., с помощью ARFI визуализации, оценили 92 очага молочной железы, для сравнения соотношения площади (визуализация деформируемости) и скорости сдвиговой волны [53]. Среднестатистическое соотношение площади и среднестатистическая скорость волны для доброкачественных очагов отличается от значений, полученных для злокачественных очагов (1,08 ± 0,21 м/с по сравнению с 1,99 ± 0,63 м/с и 3,25 ± 2,03 м/с и 8,22 ± 1,27 м/с соответственно). Использование ARFI и УЗИ являет собой достойную комбинацию для описания узлов молочной железы.
При исследовании сдвиговых волн для злокачественных очагов (Athanasiou et al. 2010 год), среднестатистическое значение эластичности составляло 146,6 кПа ± 40,05 (p<0.001), а для доброкачественных узлов – 45,3 кПа ± 41,1 (p<0.001). Сложные кисты дифференцировались от плотных очагов со значением эластичности 0 кПа. SWE показала высокую специфичность по сравнению с УЗИ (96% по сравнению с 63%), в то время как чувствительность была такой же, как и при измерении другими методами (95% и 96%).
ОГРАНИЧЕНИЯ
Эластосонография молочной железы имеет некоторые ограничения, в основном из-за структуральных аспектов самой молочной железы и узлов, но также ограничения связаны с методикой эластосонографии.
К ограничениям относятся: разница выражения компонентов железы в пределах исследуемой популяции; отсутствие капсулы, которая может сдерживать компрессию тканей; характеристики и высокая вариабельность очагов (часто признаки добро- или злокачественности могут не совпадать с характеристиками эластичности (киста, некроз, т.д.)).
Адекватная и стандартизированная компрессия также является важным фактором, который может повлиять на оценку эластичности, особенно при free-hand исследовании. Как правило, датчик должен слегка прикасаться к коже в начале исследования, потому что давление и деформируемость не пропорциональные за пределами определенной степени компрессии.
Также, оба подхода free hand УЗИ и измерение сдвиговой волны связаны с вариабельностью результатов среди разных исследователей по отношению к выполнению и интерпретации эластосонографических данных. Не существует консенсуса касательно лучшей методики и классификации для определения клинического применения. Как и на УЗИ, на эластосонографию влияет зависимость от умений исследователя, поскольку для обеспечения повторяемого результата, необходимо иметь опыт. В основном, радиологи, выполнявшие исследования, имели доступ к клинической информации.
Результаты в современной литературе свидетельствуют о том, что требуется лучшая стандартизация, особенно для компрессионной эластографии. Например, вариабельность между опытными и неопытными исследователями может ограничивать вероятность верного результата. Yoon et al. сообщили об их исследовании 65 пробиопсированных очагов. УЗ и эластографические снимки биопсированного очага были получены и перспективно проанализированы тремя радиологами с индивидуальным сканированием в реальном времени до биопсии. Каждый радиолог фиксировал и записывал заключительные BI-RADS УЗ оценки, используя УЗИ и комбинацию УЗИ/эластография, соотношение жировой ткани/очаговой ткани, оценку эластичности. Согласованность среди исследователей не улучшалась с применением комбинации УЗИ и эластографии (к=0,25), по сравнению с УЗИ (к=0,37). Согласованность среди исследователей по данным эластографии в реальном времени была значительной, как для соотношения жировой ткани/очаговой ткани (оценка внутриклассового коэффициента корреляции, 0,25), так и для оценки эластичности (к=0,28). Умеренная согласованность (к=0,46) наблюдалось при использовании статической эластографии. Авторы установили, что есть значительная вариабельность заключений среди исследователей, а эластография в реальном времени показала полную согласованность.
Оценка для поверхностных очагов была более точной, чем для глубоких, учитывая размер молочной железы [13, 58], в то время как близость очага к области ареолы/соска утрудняла обеспечение оптимального качества изображения. Требуется более углубленное исследование, поскольку ни в одном исследовании не было описано индивидуальной глубины очага каждого пациента от поверхности молочной железы, размера очага и возможность его пальпации. Даже оценка для квантификации типичных статических компрессий влияет на диагностическую ценность этого режима, в случае если применение сдвиговых волн обязательное, а также потому, что захват сдвиговых волн может не получиться. Наконец, всего несколько работ описывали корреляцию между гистологическими признаками и эластографическими картинами, поэтому диагностическая и клиническая способность эластосонографии при исследовании разных видов очагов не до конца разъяснена.
ПЕРСПЕКТИВНЫЕ РАЗРАБОТКИ
В современной литературе различные исследовательские работы пишут о вспомогательной роли эластографии в дифференциации добро- и злокачественных новообразований молочной железы любого размера. На самом деле, общепринято начинать обследование пациента с высококачественного УЗИ в В-режиме, а потом применять эластографию при наличии клинических показаний.
Более того, некоторые авторы утверждают о ценности компрессионной эластографии для улучшения точности оценки по шкале BI-RADS. Этот метод особенно уместен для уточнения BI-RADS оценки (поднимает или понижает), соответственно избегая или направляя на биопсию.
Недавно, некоторые авторы сообщили о том, что не существует явной разницы между 5-ти балльной шкалой и методом соотношения деформируемости (strain ratio), представляя эти два подхода как дополняющие друг друга. Они также пишут, что в клинической практике качественная оценка более практичная, но менее объективная. Для очагов, оценённых по 5-ти балльной шкале, соотношение деформируемости может уменьшить субъективную зависимость от исследователей.
Видимо сдвиговые волны или ARFI, которые могут квантифицировать объективное значение жесткости очага, уместны для описания плотных очаговых поражений молочной железы более точно.
В дальнейшим, тщательно разработанные и адекватно проведенные исследования нужны для оценки диагностической способности комбинации УЗИ и эластографии, а также для определения самого подходящего порогового значения деформируемости или скорости в разных системах, и наконец, для того чтобы оценить возможность применения этих методов для разных размеров очагов и глубин от поверхности молочной железы.