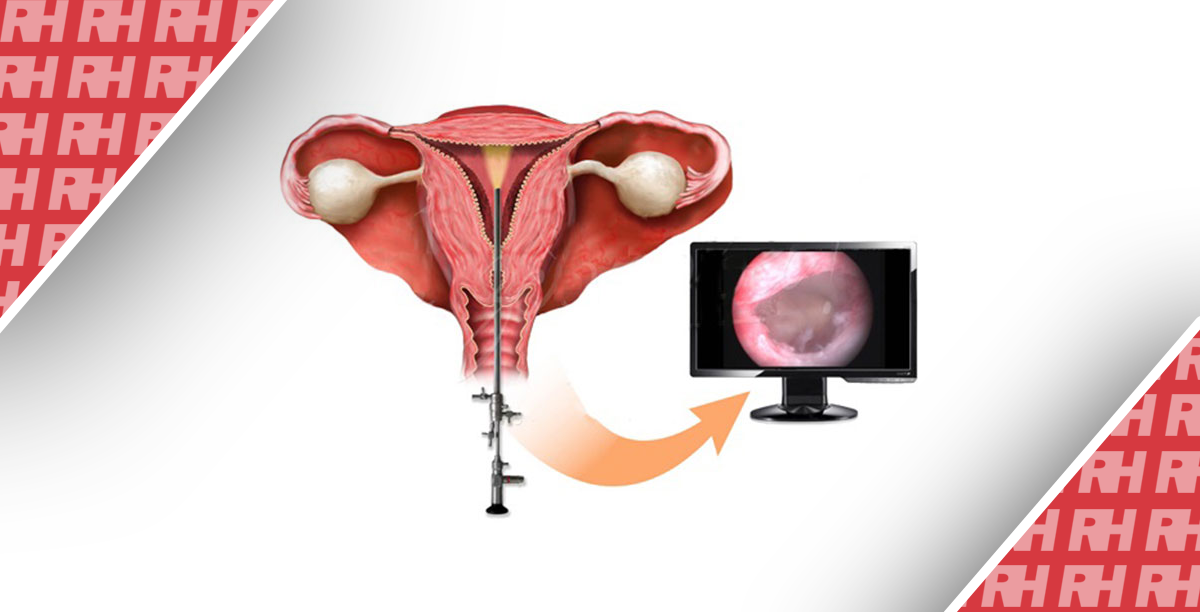
Резюме
Предусловия: Гистероскопия на сегодняшний день является золотым стандартом диагностики и лечения внутриматочных патологий. Недавний технологический прогресс сделал возможным интеграцию диагностического и операционного времени, что привело к подходу “увидеть и вылечить”. Технология диодного лазера становится одной из самых инновационных и интригующих методик в этом контексте.
Методы: Был проведен всесторонний поиск литературы в основных базах данных. Только оригинальные исследования, сообщающие о лечении внутриматочных патологий с помощью диодного лазера, были приемлемы для включения в этот систематический обзор (идентификатор PROSPERO: CRD42023485452).
Результаты: В качественный анализ было включено восемь исследований, в которых участвовали 474 пациентки, которым проводили лазерную гистероскопическую хирургию. Восемьдесят три пациентки имели аномалии женских половых путей, 63 – подслизистые лейомиомы, 327 – полипы эндометрия, а одна пациентка имела рубцовую беременность. За исключением лейомиом, методика лечения которых уже включала два хирургических вмешательства в начале, только семь пациенток нуждались во втором хирургическом вмешательстве. Совокупная частота интраоперационных и послеоперационных осложнений составила 2,7% и 0,6% соответственно.
Выводы: Применение диодного лазера во время гистероскопии по принципу “увидеть и вылечить” представляется безопасным и эффективным методом. Однако, для консолидации имеющихся в литературе доказательств необходимы дополнительные исследования с большими размерами выборок и усовершенствованным дизайном.
Ключевые слова: диодный лазер; гистероскопия; гистероскопическая хирургия; полипы эндометрия; фибромиома; гистероскопия; перегородчатая матка
1. Вступление
1.1. Предусловия
Лазеры являются альтернативным электрохирургии источником энергии, который приобретает все больший интерес в гинекологической хирургии [1,2,3,4]. В гинекологии используют несколько типов лазеров: Nd-Yag лазер, аргоновый лазер, CO2 лазер и новейший диодный лазер [5,6]. Для того, чтобы лазер был пригодным для эндоскопического использования, он должен иметь четыре характеристики: способность к чистому резанию, хороший гемостатический эффект, поверхностное проникновение в ткани и высвобождение через оптические волокна. Однако некоторые из имеющихся на сегодняшний день лазеров имеют определенные недостатки: CO2-лазер не может быть доставлен с помощью волокон, а только с помощью шарнирных зеркальных кронштейнов, а Nd-YAG-лазер, из-за своей низкой длины волны, поглощающей воду, имеет более высокий риск глубокого проникновения в ткани, чем другие лазеры.
Диод – это электронный лазер, состоящий из двух очень тусклых полупроводниковых материалов. Микропроцессор регулирует поток электрического тока через диод для генерации лазерного луча. После генерации луч передается через оптическую систему в оптическое волокно, которое выступает в качестве носителя света, переносимого к месту работы. Длина генерируемой волны может варьироваться от 980 до 1470 нм. Благодаря этим длинам волн диодный лазер достигает высокого одновременного поглощения гемоглобином и водой, обеспечивая гемостатические свойства и, таким образом, предлагая высокие возможности абляции и вапоризации [7,8]. Диодный лазер обеспечивает значительно лучший гемостаз, чем менее современный CO2-лазер, а его тепловое проникновение ниже, чем у Nd-YAG-лазера, что позволяет выполнять точную и безопасную процедуру [9,10,11,12]. Его использование может быть распространено на лапароскопическую или гистероскопическую гинекологическую хирургию.
Исторически гистероскопия была задумана как диагностическая процедура, предназначенная для непосредственного доступа в полость матки и визуализации ее содержимого. Спустя годы после ее внедрения она считается золотым стандартом диагностики и лечения внутриматочных патологий, таких как полипы эндометрия, подслизистые миомы, аномалии развития матки или послеоперационные последствия, такие как внутриматочные синехии или истмоцеле [13,14,15,16,17,18].
Разработка гистероскопов с функциями, которые все больше приспособлены к особенностям цервикального канала, не только облегчила переход процедур из операционной в амбулаторную клинику, но и помогла уменьшить дискомфорт пациентки, благодаря чему эта методика все больше ценится и используется во всем мире [19,20]. Этот сдвиг также позволил объединить диагностическое и операционное время, что дало начало современному подходу “увидеть и вылечить”, который имеет ощутимые преимущества с точки зрения уменьшения количества выполняемых процедур и повышения общей удовлетворенности пациенток [21,22,23,24].
В настоящее время наличие инструментов для лечения внутриматочных заболеваний, как в стационарных, так и в амбулаторных условиях, является более чем широким, синтезируя новейшие электронные технологии до возможности их миниатюризации, чтобы сделать их пригодными для этого типа эндоскопической хирургии [25,26]. Лазерные технологии были адаптированы и интегрированы в гистероскопию путем экспериментов с различными типами лазеров, такими как Nd-Yag лазер [27,28,29,30], калий-титанил-фосфатный (КТФ) лазер [31] или аргоновый лазер [32]. В последнее время использование диодных лазеров в гистероскопии возросло в различных операционных условиях [33].
1.2. Цель
Целью этого систематического обзора было оценить использование диодного лазера для гистероскопии “увидеть и вылечить” в лечении внутриматочной патологии.
2. Методы
2.1. Критерии приемлемости
Только оригинальные исследования (ретроспективные или проспективные), в которых сообщалось о лечении патологий матки и эндометрия с помощью диодного лазера, считались приемлемыми для включения в этот систематический обзор. Мы включили как исследования с участием пациенток, желающих иметь потомство, так и исследования с участием пациенток в менопаузе. Из-за нехватки квалифицированных обзоров, связанных с основной темой нашей работы, отчеты о случаях или серии случаев с менее чем 10 пациентками также были признаны подходящими для включения в качественный анализ, чтобы заполнить этот пробел.
Были исключены исследования, в которых описывалась только используемая технология, но не сообщалось о результатах по патологии, а также исследования, в которых описывалась только методика процедуры (описывалась пошаговая процедура).
Аналогично, исследования других типов лазеров или неанглоязычные исследования не считались приемлемыми для включения в этот систематический обзор.
2.2. Источники информации
Этот систематический обзор (идентификатор PROSPERO: CRD42023485452) был проведен в соответствии с руководством Предпочтительных элементов отчетности для систематических обзоров и мета-анализов (PRISMA) [34] и валидирован сетью Стандартов улучшения качества и прозрачности исследований по охране здоровья (EQUATOR) и Кокрановским руководством по систематическим обзорам [35].
Для поиска исследований, описывающих хирургические процедуры при патологиях матки и эндометрия с использованием диодных лазеров, были использованы базы данных MEDLINE, EMBASE, Global Health, Кокрановская библиотека (Кокрановская база данных систематических обзоров, Кокрановский центральный реестр контролируемых исследований, Кокрановский реестр методологий), База данных оценки медицинских технологий, Web of Science и Научно-исследовательский реестр (ClinicalTrial.gov).
2.3. Стратегия поиска
Для каждой базы данных были использованы следующие медицинские предметные рубрики (MeSH) и ключевые поисковые термины: “Гистероскопия” (уникальный идентификатор MeSH: D015907), “Гистероскопическая хирургия” (уникальный идентификатор MeSH: D015907), “Диодный лазер” и “Лейомиома” (уникальный идентификатор MeSH: D007889), “Аномалии развития матки” (уникальный идентификатор MeSH: C562565), “Полипы эндометрия” (уникальный идентификатор MeSH: D011127), “Синехии матки” (уникальный идентификатор MeSH: D006175) и “Истмоцеле”. Мы отобрали статьи, написанные на английском языке с момента основания каждой базы данных до 30 ноября 2023 года.
2.4. Выбор исследования
Названия и/или рефераты исследований, полученные с помощью поисковой стратегии, были проверены независимо двумя авторами обзора (A.E. и A.S.L.) для выявления исследований, которые соответствовали критериям включения. Полные тексты этих потенциально подходящих статей были получены и независимо оценены на соответствие критериям включения двумя другими членами обзорной группы (A.D. и G.B.). Также был проведен ручной поиск ссылок на включенные исследования, чтобы предотвратить пропуск релевантных исследований. Любые разногласия между рецензентами относительно приемлемости статей решались путем обсуждения с третьим (внешним) соавтором. Все авторы одобрили окончательный отбор.
2.5. Извлечение данных
Два автора (A.E. и A.D.) независимо извлекали данные из статей об особенностях исследования, характеристиках включенных популяций, хирургических процедурах, осложнениях и результатах/выходных данных, используя предварительно пилотируемую стандартную форму для обеспечения согласованности. Один автор (A.S.L.) пересмотрел весь процесс извлечения данных.
2.6. Оценка риска предвзятости
Два рецензента (A.E. и A.D.) независимо оценивали риск предвзятости в исследованиях, включенных в этот систематический обзор, используя модифицированную версию шкалы Ньюкасла-Оттавы (NOS) [36]. Качество исследований оценивалось в следующих пяти различных областях: “дизайн исследования и репрезентативность выборки”, “техника отбора”, “описание гистероскопической техники”, “качество описания популяции” и “неполные данные о результатах”. Любые разногласия между рецензентами были решены третьим рецензентом (G.B.).
2.7. Измерение результатов и обобщение данных
Основной целью этого исследования было оценить эффективность, безопасность и целесообразность применения диодного лазера для лечения внутриутробной патологии, как описано ниже.
- “Эффективность”: эффективность измерялась по показателю успешности процедур, который определялся отсутствием остаточных поражений в конце процедуры и/или во время следующего визита.
- “Выполнимость”: выполнимость оценивалась как количество процедур, выполненных за один хирургический этап, без перерывов из-за хирургических проблем или жалоб пациентов.
- “Безопасность”: безопасность определялась по частоте интраоперационных и послеоперационных осложнений.
Количественный анализ не был возможным из-за неоднородности данных (включая различные условия и хирургические процедуры). Мы предоставили описательный синтез результатов в отдельных разделах на основе типа патологии, которая была удалена или скорректирована гистероскопически: полипы, лейомиомы, аномалии женских половых путей и беременность с рубцом после кесарева сечения.
Два автора (A.E., A.S.L.) оценили доказательную базу относительно полезности диодных лазеров для каждой патологии, используя уровни доказательности Оксфордского центра доказательной медицины 2011 года (OCEBM) [37].
3. Результаты
3.1. Выбор исследования
Процесс отбора исследований отражен на Рисунке 1. После оценки полных текстов, всего восемь работ [9,10,11,38,39,40,41,42], которые соответствовали вышеупомянутым критериям включения, были включены в этот систематический обзор.
Рисунок 1. Блок-схема осмотра в PRISMA.
3.2. Характеристики исследования
Основные характеристики включенных исследований приведены в Таблице 1. Только одно ретроспективное исследование включало проспективное наблюдение [11]. Остальные семь исследований были проспективными и включали одно рандомизированное контролируемое исследование (РКИ) [9], три пилотных исследования [38,39,40], одно многоцентровое проспективное проспективное когортное исследование [10], одно проспективное когортное исследование [42] и один отчет о случае [41]. Из них четыре исследования были проведены в Италии [39,40,41,42], три – в Испании [9,10,38]и одно – в Израиле [11].
Таблица 1. Характеристика включенных исследований.
| Автор | Год | Тип | Основной результат | Страна | Пациент(n) | Возраст (средний) | Контрольная группа | Характеристика участников | Вмешательства | Регистрация |
| Haimovic и соавт.
[38] |
2013 | Пилотное | Оценить целесообразность новой двухэтапной методики офисной гистероскопической резекции субмукозной миомы | Испания | 43 | 36.7 | Нету | Пациентки репродуктивного возраста с симптоматическими поражениями, диагностированными сонографически как одиночная миома G1 или G2 ≤ 4,0 см | Двухэтапная гистероскопическая процедура: подготовка частично интрамуральных миом путем разреза слизистой оболочки эндометрия и псевдокапсулы, покрывающей миому, на первом этапе, и иссечение миомы диодным лазером через 4 недели. | Нету |
| Lara-Domínguez и соавт. [9] | 2015 | Рандомизированное контролируемое исследование | Сравнить резекцию полипов эндометрия биполярным электродом Versapoint и диодным лазером | Испания | 102 | 51.5 | Да | Пациентки с полипами эндометрия, одиночными или множественными | Гистероскопическая полипэктомия диодным лазером | Идентификатор клинического исследования: NCT02126397 |
| Nappi и соавт.
[39] |
2016 | Пилотное | Оценить целесообразность и безопасность офисной гистероскопической метропластики с использованием диодного лазера с длиной волны 980 нм | Италия | 18 | 32.7 | Нету | Пациентки с сонографически диагностированными полипами эндометрия ≤ 2,5 см | Гистероскопическая полипэктомия диодным лазером | Нету |
| Nappi и соавт.
[40] |
2016 | Пилотное | Оценить целесообразность и эффективность гистероскопической полипэктомии эндометрия с использованием новой двухволновой лазерной системы | Италия | 300 | 54 | Нету | Пациентки с перегородкой матки V-b или класса U2a в соответствии с рекомендациями ASRM и классификации ESHRE-ESGE | Гистероскопическая метропластика диодным лазером после 14-дневной подготовки эндометрия 5 мг в сутки номегестрола ацетата | Нету |
| Esteban Manchado и соавт.
[10] |
2020 | Многоцентровое проспективное когортное исследование | Исследовать эффективность и безопасность офисной гистероскопической метропластики диодным лазером для лечения перегородки матки | Испания | 41 | 34.2 | Нету | Женщины с диагнозом V-b или класса U2a перегородки матки в соответствии с рекомендациями ASRM и классификации ESHRE-ESGE, а также с первичным бесплодием или повторным невынашиванием беременности в анамнезе | Гистероскопическая метропластика диодным лазером | Нету |
| Sorrentino и соавт.
[41] |
2021 | Отчет о случае | Сообщить о случае беременности с рубцом после кесарева сечения, вылеченной комбинированной эмболизацией маточной артерии и гистероскопической лазерной хирургией. | Италия | 1 | 40 | Нету | 40-летняя женщина с беременностью после кесарева сечения | Ангиографическая эмболизация маточных артерий с последующей гистероскопической диодной лазерной резекцией | Нету |
| Bilgory и соавт.
[11] |
2021 | Ретроспективное когортное исследование | Изучить эффективность и безопасность гистероскопической метропластики диодным лазером при дизморфной матке и ее влияние на репродуктивные результаты | Израиль | 25 | 35.4 | Нету | Бесплодная женщина с Т- или Y-образной формой матки и бесплодием | Гистероскопическая метропластика диодным лазером | Нету |
| Vitale и соавт.
[42] |
2023 | Проспективное когортное исследование | Оценить целесообразность и эффективность гистероскопической абляции субмукозной миомы матки с использованием диодного лазера в офисе | Италия | 20 | 39.1 | Нету | Пациентки с по крайней мере одной симптоматической миомой матки 0-2 класса по классификации FIGO размером ≤ 7 см. | Лазерная вапоризация ядра фибромиомы | Идентификатор клинического исследования: NCT05604001 |
ASRM: Американское общество репродуктивной медицины; ESHRE: Европейское общество репродукции человека и эмбриологии, ESGE: Европейское общество гинекологической эндоскопии; FIGO: Международная федерация гинекологии и акушерства.
3.3. Риск предвзятости включенных исследований
Среди восьми включенных исследований семь имели низкий риск предвзятости в трех или более сферах [9,10,11,38,39,40,42], и только одно исследование было оценено как имеющее высокий риск предвзятости [41].
3.4. Обобщение результатов
Среди включенных исследований три оценивали использование диодного лазера для лечения аномалий женских половых путей [10,11,39], два – для лечения лейомиомы матки [38,42], два – для лечения полипов эндометрия [9,40] и одно – для лечения беременности с рубцом после кесарева сечения [41]. Как отмечалось ранее, мы обсуждали результаты отдельно по типу патологии матки, которую лечили в различных исследованиях, включенных в обзор.
3.4.1. Аномалии женских половых путей
Врожденные пороки развития женских половых путей отклоняются от нормальной анатомии вследствие нарушения эмбрионального развития мюллеровых протоков [43]. Тип и степень анатомических искривлений связаны с проблемами со здоровьем и репродуктивной функцией и могут вызывать повторные выкидыши и бесплодие [44]. По этим причинам они являются распространенным показанием для проведения гистероскопии [45].
Три исследования оценивали коррекцию аномалий женских половых путей с помощью диодного лазера во время гистероскопической метропластики [10,11,39] и были включены в данный анализ. В двух из них основной целью была оценка эффективности и целесообразности гистероскопической метропластики диодным лазером при перегородке матки [10,39], в то время как в другом исследовании лазерная технология применялась для коррекции дисморфической матки [10].
В хронологическом порядке первой публикацией было пилотное исследование Nappi и соавт. [39]. Было включено 18 пациенток с перегородками матки V-b класса по классификации Американского общества репродуктивной медицины (ASRM) [46] или с перегородками матки класса U2a по классификации Европейского общества репродукции человека и эмбриологии (ESHRE)-Европейского общества гинекологической эндоскопии (ESGE) [47]. Из них 11 пациенток страдали повторной потерей беременности (ППБ), а семеро – первичным бесплодием. Все процедуры проводились двумя операторами с помощью гистероскопа Бетокки диаметром 5 мм с вагиноскопическим доступом в амбулаторных условиях. Через рабочий канал гистероскопа диаметром 5 Fr вводили полифибру и далее подключали к лазерному устройству с длиной волны 980 нм, настроенному на 20 Вт мощности в непрерывном режиме. Интраоперационная боль оценивалась с помощью визуально-аналоговой шкалы (ВАШ) от 0 до 10 баллов. Время операции составило 13,16 ± 1,33 мин, а частота интраоперационной боли – 3,05 ± 0,72. Все процедуры были выполнены успешно, интраоперационных и послеоперационных осложнений не возникло. Контрольная гистероскопия была проведена всем пациенткам через 2 месяца после гистероскопической метропластики, и не было диагностировано внутриматочных спаек или рецидива перегородки. Все пациентки проходили послеоперационное наблюдение в течение 6-30 месяцев, оценивались репродуктивные результаты. Частота клинических беременностей составила 63,6% (7/11) в группе ППБ и 71,4% (5/7) в группе бесплодия. У одной пациентки из группы бесплодия произошел самопроизвольный аборт (14,3%), и в итоге произошло шесть живорожденных детей.
Похожие результаты, хотя и с большей потребностью в повторной операции (n = 0 против n = 7), получили Esteban Manchado и соавт. [10].
Наконец, ретроспективное когортное исследование с проспективным наблюдением [11] было включено в этот систематический обзор. Двадцать пять пациенток с дисморфическими матками перенесли гистероскопическую метропластику вагиноскопическим доступом под общей анестезией. Средний возраст составил 35,4 ± 5,4 года. Все пациентки имели диагноз бесплодие, ППБ или повторную неудачу имплантации (ПНИ). После трехмерного (3D) ультразвукового исследования (УЗИ) у 15 пациенток была диагностирована Т-образная матка (класс U1a по классификации ESHRE-ESGE) [47], а у 10 пациенток – Y-образную матку, которая является подтипом Т-образной матки по данным нескольких авторов [48]. Все процедуры выполнял один и тот же хирург с помощью гистероскопа Бетокки диаметром 5 мм. Конический 1000-микронный зонд вводился в операционный канал 5 Fr и подключался к диодному лазерному устройству с длиной волны 1470 нм, установленному на 15 Вт для проведения процедур. Средняя продолжительность процедуры составляла 25 ± 7 мин. Никаких интраоперационных или послеоперационных осложнений не возникло. Среди 25 пролеченных пациенток 15 впоследствии прошли процедуру экстракорпорального оплодотворения (ЭКО). Произошло девять клинических беременностей (60%) и два выкидыша (13,3%); среди девяти клинических беременностей авторы сообщают о семи из них с рождением живых детей или продолжающейся беременностью. Дополнительные данные о характеристиках включенных исследований приведены в Таблице 2.
Таблица 2. Обзор исследований, оценивающих использование диодного лазера в гистероскопической метропластике для коррекции аномалий женских половых путей.
| Nappi и соавт. [39] | Manchado и соавт. [10] | Bilgory и соавт. [11] | |
| Пациенты (n) | 18 | 40 | 25 |
| Средний возраст (лет) | 32.66 ± 2.74 | 34.2 ± 5.278 | 35.4 ± 5.4 |
| ИМТ (кг/м2) | 21.58 ± 1.63 | н.у. | 25.4 ± 5.4 |
| Симптомы | |||
| Бесплодие (%) | 38.9 | 37.5 | н.у. |
| ППБ (%) | 61.1 | 62.5 | н.у. |
| ПНИ (%) | н.у. | н.у. | н.у. |
| Аномалия женских половых путей | |||
| Вид аномалии матки | Перегородчатая матка | Перегородчатая матка | Дизморфная матка (Т-образная и Y-образная) |
| Класс ASRM/ESHRE | Vb–U2a | Va–U2b | U1a |
| Предоперационное обследование | |||
| Предоперационная 3D-УЗИ (%) | 100 | 100 | 100 |
| Хирургическое вмешательство | |||
| Среднее операционное время (мин) | 13.16 ± 1.33 | – Первый шаг: 12.74 ± 3.552
– Второй шаг: 9.85 ± 1.345 |
25 ± 7 |
| Хирург (n) | 2 | н.у. | 1 |
| Средний показатель ВАШ | 3.05 ± 0.72 | 2.225 ± 0.5768 (1 to 5) | н.у. |
| Интраоперационные осложнения (n) | 0 | 0 | 0 |
| Послеоперационные осложнения (n) | 0 | 1 | 0 |
| Адгезии (n) | 0 | 1 | 0 |
| Потребность во втором хирургическом шаге (n) | 0 | 7 | 0 |
| Дальнейшие действия | 1 | 0 | |
| Среднее время наблюдения (месяцы) | 6–30 | 24 | 11.5 ± 9.2 |
| Послеоперационная контрольная гистероскопия (%) | 100 | 100 | 100 |
| Репродуктивные последствия | |||
| Клинический показатель беременности до операции (%) | н.у. | н.у. | 33.3 |
| Клиническая частота наступления беременности после операции (%) | – Первичная группа бесплодия: 71.4
– ППБ группа: 63.6 |
78.9 | 60 |
| Частота выкидышей до операции (%) | н.у. | н.у. | 40 |
| Частота выкидышей после операции (%) | – Первичная группа бесплодия: 14.28
– ППБ группа: 0 |
20 | 13.3 |
| Коэффициент живорождаемости до операции (%) | н.у. | н.у. | 0 |
| Коэффициент живорождаемости после операции (%) | – Первичная группа бесплодия: 42.9
– ППБ группа : 27.3 |
63.2 | 46.7 |
ИМТ: индекс массы тела; ППБ: повторная потеря беременности; ПНИ: повторная неудача имплантации; ASRM: Американское общество репродуктивной медицины; ESHRE: Европейское общество репродукции человека и эмбриологии; 3D-УЗИ: трехмерное УЗИ; ВАШ: визуально-аналоговая шкала; н. у.: не указано.
Качество доказательств: Доказательства безопасности, эффективности и надежности диодного лазера для коррекции аномалий женских половых путей были классифицированы как уровень 3.
3.4.2. Лейомиомы матки
Лейомиомы матки – это доброкачественные моноклональные гладкомышечные клеточные опухоли миометрия [49], которые являются самой распространенной патологией женских половых путей [50]. Хотя большинство миом протекают бессимптомно, некоторые из них, в зависимости от локализации, размера и количества, могут быть причиной тазовых болей, аномальных маточных кровотечений, а также состояний субфертильности и бесплодия [51,52]. Два исследования изучали применение диодного лазера для лечения лейомиомы матки [38,42].
Первым, в хронологическом порядке, было пилотное исследование Haimovic и соавт. [38], яЦелью исследования было оценить жизнеспособность нового двухэтапного подхода к офисной гистероскопической резекции субмукозных миом. В исследование было последовательно включено 43 женщины с диагнозом одиночной, симптоматической миомы G1 или G2 по классификации ESGE 2005 года [53] и размером менее 4 см. Все пациентки были репродуктивного возраста. Перед операцией всем пациенткам было проведено трансвагинальное ультразвуковое исследование для оценки локализации, размера и типа субмукозной миомы. Все процедуры выполнял один и тот же оператор с помощью гистероскопа Бетокки диаметром 4 мм. В общем, методика включала модифицированный вариант подхода OPPIuM, описанный группой Бетокки [54], с существенными модификациями, такими как использование диодного лазера вместо традиционного биполярного, а также выполнение обоих хирургических этапов в амбулаторных условиях, когда пациентка бодрствует, и без использования анестезии. Полная энуклеация была успешно выполнена у 80,9% (17/21) пациентов с миомами G1 и 77,3% (17/22) пациентов с миомами G2 (p = 1.000). В целом двухэтапную миомэктомию успешно выполнили 34 пациенткам, что составляет 79,1% от общей когорты. Медиана (интерквартильный размах, ИКР) продолжительности первого этапа составляла 16 мин, тогда как второй этап требовал медианы времени 24 мин. Средние баллы по ВАШ для первого и второго офисных гистероскопических этапов составляли 2,49 ± 0,83 и 3,07 ± 1,01 соответственно. Пациентки в среднем оценили удовлетворенность на 3,51 ± 1,06 балла, причем 75% сообщили, что уровень удовлетворенности равен или превышает 3 балла. Пациентки не наблюдались для оценки репродуктивных результатов.
Второе исследование было проспективным когортным [42] с участием 20 пациенток с диагнозом одиночной симптоматической миомы размером менее 7 см в соответствии с 0-2 степени по классификации FIGO PALM-COEIN [55], которым выполняли гистероскопическую лазерную абляцию (ГЛА) опухоли. Все пациентки были фертильными, имели желание иметь потомство и страдали от сильных менструальных кровотечений. У семидесяти процентов пациенток была диагностирована миома G1 по классификации FIGO, тогда как у остальных 30% была диагностирована миома G2. ГЛА проводили с помощью гистероскопа Бетокки диаметром 3,8 мм путем вагиноскопии в амбулаторных условиях без применения анестезии. Диодное лазерное устройство с длиной волны 1470 нм, настроенное на энергию 15 Вт, было подключено к зонду, который вводился в рабочий канал гистероскопа. После подтверждения правильного положения кончика зонда в центре фибромиомы, было применено непрерывное циркулярное излучение, а края фибромиомы коагулированы. Процедуру завершали, когда хирург наблюдал достаточную коагуляцию фибромиомы. Средняя продолжительность операции составляла 7,0 ± 2,1 мин. Средняя продолжительность интраоперационной боли по ВАШ у всех пациенток составляла 2,9 ± 2,0. Восемьдесят восемь процентов пациенток (18/20) показали заметное улучшение менструального кровотечения через 2 месяца после операции (p = 0,001). Всем пациенткам проводилось наблюдение с помощью 3D-УЗИ через 2 месяца после процедуры, и среднее уменьшение объема фибромиомы через 2 месяца после процедуры составило 36%. Репродуктивные результаты после операции в дальнейшем не оценивались. В Таблице 3 приведена дополнительная информация о включенных исследованиях.
Таблица 3. Обзор исследований, оценивающих использование диодного лазера для лечения лейомиомы матки.
| Haimovic и соавт. [38] | Vitale и соавт. [42] | |
| Пациенты (n) | 43 | 20 |
| Средний возраст (лет) | 36.7 ± 4.6 | 39.1 ± 4.7 |
| ИМТ (кг/м2) | н.у. | 21.4 ± 1.6 |
| Фертильный возраст | 100 | 100 |
| Средняя рождаемость | 0.79 ± 0.94 | н.у. |
| Симптомы | ||
| Аномальное менструальное кровотечение (%) | 44.2 | 90 |
| Тазовая боль (%) | 11.6 | 60 |
| Бесплодие (%) | 44.2 | н.у. |
| Повышенная частота мочеиспускания (%) | н.у. | 30 |
| Основные симптомы (%) | н.у. | 70 |
| Предоперационное обследование | ||
| Предоперационное 3D-УЗИ (%) | 100 | 100 |
| Характеристики миом | ||
| ESGE/FIGO класс G1 (%) | 48.8 | 70 |
| ESGE/FIGO класс G2 (%) | 51.2 | 30 |
| Средний размер | 21.7 ± 7.3 | |
| Локализация миом | ||
| Передняя стенка | 46.5 | н.у. |
| Задняя стенка | 30.2 | н.у. |
| Дно | 16.3 | н.у. |
| Боковые стенки | 7.0 | н.у. |
| Хирургическое вмешательство | ||
| Использованная техника | Двухэтапная гистероскопическая резекция | Гистероскопическая лазерная абляция |
| Среднее операционное время (мин) | –
Первый шаг: 16 (ИКР) – Второй шаг: 16 (ИКР) |
н.у. |
| Хирург (n) | 1 | 1 |
| Среднее значение ВАШ | –
Первый шаг: 2.49 ± 0.83 – Второй шаг: 3.07 ± 1.01 |
2.9 ± 2.0 |
| Интраоперационные осложнения (n) | 0 | 0 |
| Послеоперационные осложнения (n) | 0 | 0 |
| Потребность во втором хирургическом шаге (n) | 0 | 0 |
| Дальнейшие действия | ||
| Послеоперационное наблюдение | н.у. | 3D-УЗИ |
| Репродуктивные результаты | н.у. | н.у. |
ИМТ: индекс массы тела; 3D-УЗИ: трехмерное УЗИ; ESGE: Европейское общество гинекологической эндоскопии; FIGO: Международная федерация гинекологии и акушерства; ВАШ: визуальная аналоговая шкала; н.у.: не указано.
Качество доказательств: Доказательства безопасности, эффективности и надежности диодного лазера для лечения лейомиом были классифицированы как уровень 3.
3.4.3. Полипы эндометрия
Полипы эндометрия – это локализованные опухоли слизистой оболочки эндометрия [56]. Являясь частой причиной аномальных маточных кровотечений [55] и даже бесплодия [57,58], они являются распространенным показанием для гистероскопии [1]. Два исследования оценивали возможность использования энергии диодного лазера для гистероскопического удаления полипов эндометрия [9,40].
Среди них первым было РКИ Lara-Domínguez [9], в котором 102 пациентки с подозрением на УЗИ на полипы эндометрия матки были рандомизированы для проведения полипэктомии биполярным электродом (Versapoint) или диодным лазером. В группе Versapoint гистероскопическая полипэктомия проводилась с помощью гистероскопа Бетокки диаметром 5 мм вагиноскопическим доступом без анестезии. Биполярный электрод вводился через операционный канал инструмента 5 Fr. С другой стороны, в группе диодного лазера процедуру выполняли через 6 мм гистероскоп с операционным каналом 7 Fr, через который вводили полимерное волокно, подключенное к лазерному устройству с длиной волны 980 нм. Интраоперационные показатели ВАШ оценивали у всех пациенток в обеих группах. Полная успешная трансекция полипа была достигнута в 96,1% в группе Versapoint и в 92,0% в группе полипэктомии диодным лазером. Среднее время, необходимое для резекции полипа с использованием диодного лазера, было значительно короче, чем для резекции полипа с использованием методики Versapoint (245,96 ± 181,9 с против 329,56 ± 245,0 с соответственно; р = 0,01). Кроме того, не было выявлено различий в уровне интраоперационной боли (оценка по ВАШ 4,4 ± 2,9 против 4,4 ± 2,9, р = 0,91), оцененной по шкале ВАШ или обычной шкале боли от 0 до 10 баллов. Всем пациенткам была назначена повторная гистероскопия через 3 месяца после первой гистероскопии. Одиннадцать пациенток были потеряны для наблюдения по разным причинам. Во время второго гистероскопического исследования рецидив полипа в том же месте произошел у 15 пациенток (32,6%) в группе Versapoint. В противоположность этому, в группе диодного лазера рецидив полипа был отмечен только у одной пациентки (2,2%) (р = 0,001). Перед второй гистероскопией пациенткам было предложено заполнить анкеты относительно степени удовлетворения процедурой, влияния процедуры на качество их жизни, а также относительно того, рекомендовали бы они эту процедуру другим пациенткам. Процент “очень довольных” и “очень рекомендуют” пациентов был значительно выше в группе диодного лазера, чем в группе Versapoint.
Второе исследование было пилотным [40] и включало 300 женщин с подозрением на полипы эндометрия по данным УЗИ. В общей сложности 225 пациенткам, которые соответствовали критериям включения, была проведена гистероскопическая полипэктомия с помощью гистероскопа Бетокки диаметром 4 мм. Использовались два разных типа волокон: “голое” волокно с шарообразным наконечником 1000 мкм и “голое” волокно с коническим наконечником 715 мкм, соединенные с двухволновой лазерной системой для генерации лазера 980 + 1470 нм через диодный полупроводниковый канал. Придерживаясь подхода “увидеть и вылечить”, 97,3% пациентов перенесли успешную лазерную полипэктомию. Оценка по ВАШ и продолжительность процедуры положительно коррелировали с размером полипа, причем более высокие оценки по ВАШ и более длительное время процедуры ассоциировались с более крупными полипами. Дополнительная информация о включенных исследованиях представлена в Таблице 4.
Таблица 4. Обзор исследований, оценивающих использование диодного лазера для лечения полипов эндометрия.
| Lara-Domínguez и соавт. [9] | Nappi и соавт. [40] | |
| Пациенты (n) | 102 | 225 |
| Средний возраст (лет) | – Группа диодного лазера: 49.1 ± 10.3
– Группа Versapoint: 53.9 ± 10.2 |
54 ± 12.6 |
| ИМТ (кг/м2) | – Группа диодного лазера: 49.1 ± 10.3
– Группа Versapoint: 53.9 ± 10.2 |
26.55 ± 4.23 |
| Фертильный возраст (%) | 41.2 | 38.7 |
| В менопаузе (%) | 58.8 | 61.3 |
| Средняя рождаемость | – Группа диодного лазера: 2.1 ± 1.1
– Группа Versapoint: 2.0 ± 1.0 |
2.11 ± 1.71 |
| Симптомы | ||
| Бессимптомные (%) | – Группа диодного лазера: 46
– Группа Versapoint: 44.2 |
н.у. |
| Гиперменорея (%) | – Группа диодного лазера: 14.0
– Группа Versapoint: 7.7 |
н.у. |
| Метроррагия(%) | – Группа диодного лазера: 40.0
– Группа Versapoint: 48.1 |
н.у. |
| Предоперационное обследование | ||
| Предоперационное УЗИ (%) | 100 | 100 |
| Характеристики полипов | ||
| Средний размер (мм) | 21.7 ± 7.3 | н.у. |
| Размер 0-1 см (n) | н.у. | 94 |
| Размер 1-2,5 см (n) | н.у. | 131 |
| Локализация полипов (n) | 27 | |
| Передняя стенка | н.у. | 63 |
| Задняя стенка | н.у. | 28 |
| Дно | н.у. | 87 |
| Боковая стенка | н.у. | 3 |
| Перешеек | н.у. | 17 |
| Зев | н.у. | 27 |
| Хирургическое вмешательство | ||
| Среднее операционное время (мин) | – Группа диодного лазера: 245.96 ± 181.9
– Группа Versapoint: 329.56 ± 245.0 |
– Женщины репродуктивного возраста, размер полипа 1-2,5 см: 13 ± 0.90
– Женщины в менопаузе, размер полипа 0-1 см: 9 ± 0.45 |
| Хирург (n) | 2 | н.у. |
| Среднее значение ВАШ | – Группа диодного лазера: 4.4 ± 2.9
– Группа Versapoint: 4.4 ± 2.9 |
Женщины репродуктивного возраста:
– 0–1 cm 1.773 ± 2.39 – 1–2.5 cm 2.054 ± 1.494 Женщины в менопаузе: – 0–1 cm 1.622 ± 1.803 – 1–2.5 cm 1.703 ± 2.271 |
| Интраоперационные осложнения (n) | 3 | 6 |
| Вазовагальный синдром/непереносимость (n) | 3 | 6 |
| Неполная резекция полипа | – Группа диодного лазера: 4
– Группа Versapoint: 2 |
0 |
| Послеоперационные осложнения (n) | 1 | 0 |
| Воспалительные заболевания органов малого таза (n) | 1 | 0 |
| Дальнейшие действия | ||
| Послеоперационное наблюдение (%) | Гистероскопия: 89.2% | УЗИ: 100% |
| Рецидив полипа (%) | – Группа диодного лазера: 2.2
– Группа Versapoint: 32.6 |
0 |
| Очень довольны процедурой (%) | – Группа диодного лазера: 62.2
– Группа Versapoint: 39.1 |
н.у. |
| Настоятельно рекомендуют процедуру (%) | – Группа диодного лазера: 71.1
– Группа Versapoint: 28.3 |
н.у. |
| Репродуктивные результаты | н.у. | н.у. |
ИМТ: индекс массы тела; ВАШ: визуальная аналоговая шкала; н.у.: не указано.
Качество доказательств: Мы нашли доказательства надлежащего качества (уровень 2), подтверждающие эффективность, целесообразность и безопасность использования диодных лазеров для амбулаторной полипэктомии эндометрия.
3.4.4. Беременность с рубцом от кесарева сечения
Беременность в рубце после кесарева сечения (БКС) является одной из самых редких форм внутриутробной беременности [59,60] и возникает, когда имплантат располагается в рубце после предыдущего кесарева сечения. Лишь в одной статье описано использование диодного лазера для лечения БКС.
Sorrentino и соавт. [41] описали лечение БКС с помощью комбинированного двухэтапного радиологического и эндоскопического гинекологического подхода. 40-летняя женщина с одними предыдущими вагинальными родами и двумя предыдущими кесаревыми сечениями с 5,5-недельной аменореей поступила в отделение акушерства и гинекологии с внезапным началом незначительного вагинального кровотечения, сопровождавшегося легкими спазмами внизу живота. Трансвагинальное УЗИ выявило БКС. Первым этапом лечения была эмболизация маточных артерий путем канюляции правой бедренной артерии и последующего введения желатиновой гемостатической губки в обе маточные артерии. На следующий день после радиологической процедуры пациентке провели оперативную гистероскопию с помощью гистероскопа Бетокки диаметром 3,8 мм через вагиноскопию без анестезии. Двухволновое лазерное устройство с длиной волны 980 нм и 1470 нм было подключено к коническому световоду, с помощью которого было выполнено лазерное удаление внематочной беременности. Пациентка имела обычное послеоперационное восстановление и была выписана через 3 дня. Через 4 недели наблюдения пациентка находилась в хорошем состоянии и была бессимптомной.
Качество доказательств: Доказательства безопасности, эффективности и надежности диодных лазеров для лечения БКС были классифицированы как уровень 5.
4. Обсуждение
В 1981 году Милтон Голдрат представил то, что можно считать первой гистероскопической абляцией эндометрия с использованием Nd:YAG лазера [61]. После этой новаторской процедуры лазерная вапоризация получила глобальное признание. К сожалению, ее интеграции в гинекологическую хирургию препятствует высокая стоимость, ограниченная доступность и сложный процесс обучения [5]. Несмотря на эти ограничения, лазерная технология развивалась с заметными преимуществами [1,2,3,4].
Лазерная технология, где LASER означает “Усиление света путем стимулированного излучения”, работает путем усиления определенной длины волны света, генерируя пучок фотонов. Когда лазерный луч контактирует с органической тканью, он вызывает молекулярные колебания, что приводит к разрыву химических связей и выделению тепла [5,8]. Это обеспечивает точное резание, контролируемое испарение тканей, регулируемую мощность проникновения, высокую кровоостанавливающую способность и безопасность, и все это достигается без необходимости анестезии.
Важным преимуществом этой технологии является отсутствие электрических помех. Хирурги предпочитают лазерные технологии биполярной энергии из-за того, что последняя ассоциируется с термическим повреждением, воздействуя как на образец для гистопатологического исследования, так и на близлежащие здоровые ткани [62,63]. В последние годы успешно применяются различные лазеры, включая аргоновый, криптоновый, Nd:YAG и диодные лазеры. Однако Nd:YAG лазер выделяется как наиболее широко применяемый в гистероскопических процедурах [64].
Эволюция гистероскопии от ее зарождения как инструмента первичной диагностики до статуса золотого стандарта диагностики и лечения внутриматочных патологий представляет собой увлекательное путешествие в гинекологической практике [65]. Интеграция гистероскопов, адаптированных к форме и конфигурации цервикального канала, не только способствовала переходу от операционных к амбулаторным клиникам, но и значительно повысила комфорт пациенток [66,67,68]. Эта эволюция привела к появлению современного подхода “увидеть и вылечить”, при котором диагностические и оперативные процедуры эффективно сочетаются, что приводит к уменьшению количества вмешательств и повышению общего уровня удовлетворенности пациенток [69]. Подход “увидеть и вылечить” нельзя отделить от адекватного обучения диагностической гистероскопии; диагностическая гистероскопия должна быть критически важной для будущих эндоскопистов, чтобы они понимали, можно ли устранить патологию, с которой они столкнулись, в амбулаторных условиях, или следует отложить лечение, чтобы решить ее в оперативных условиях [70,71,72,73]. В этом контексте диодные лазерные технологии являются мощным инструментом в руках эксперта-эндоскописта для лечения широкого спектра эндополостных заболеваний, как было показано в предыдущих исследованиях.
Этот новый тип лазера, мощностью 15 Вт и длиной волны 1470 нм, работает только в контакте с дисперсионным теплом 0,5-1 мм, с минимальным повреждением окружающих тканей [10,11] и, как показал данный качественный анализ, он уже безопасно и успешно применяется в лечении внутриутробных патологий.
Благодаря применению в гистероскопической метропластике лазерная технология продемонстрировала хорошую безопасность и надежность, а также многообещающие результаты с точки зрения репродуктивных последствий [10,11,39]. Будущие исследования с контрольной группой, желательно с применением рандомизированного хирургического подхода между двумя группами, необходимы для оценки фактического влияния диодных лазеров на бесплодие и репродуктивные результаты у пострадавших пациенток по сравнению с традиционными хирургическими методами. Haimovic и соавт. [38] продемонстрировали целесообразность использования лазерной энергии в сочетании с двухэтапным подходом, который был впервые применен группой Бетокки [54] для лечения миом FIGO G1-2. Это подчеркивает новые возможности для его перспективного применения в лечении миомы матки. Будущие исследования должны оценить, можно ли распространить применение диодных лазеров на миомы FIGO G3, поскольку их реклассификация в подслизистые миомы матки [74] также должна сделать гистероскопическое лечение золотым стандартом лечения [75,76,77,78]. Более того, Vitale и соавт. [42] описали совершенно другой подход, в котором диодный лазер использовался для коагуляции и термоабляции ядра фибромиомы, что дало благоприятные результаты. Внедрение и распространение лазерных технологий среди хирургов может способствовать увеличению процента пациенток, которые получают лечение фибромиомы по принципу “увидеть и вылечить” в амбулаторных условиях. Этот подход имеет потенциал уменьшить очереди и расходы больниц, одновременно уменьшая дискомфорт пациенток и потребность в анестезирующих препаратах. С этой точки зрения, использование диодного лазера в гистероскопии является одним из самых инновационных малоинвазивных методов лечения миомы матки, который можно сравнить с другими методами, такими как высокоинтенсивный сфокусированный ультразвук, микроволны и радиочастотная абляция [79,80,81,82]. Тем не менее, этот подход находит плодотворную почву, как ни один другой подход в лечении полипов эндометрия. Lara-Domínguez и соавт. провели РКИ [9] со строгой методологией и гистероскопическим наблюдением после лечения. Результаты исследования свидетельствуют, что, несмотря на одинаковый уровень интраоперационной боли, диодные лазеры при гистероскопической полипэктомии эндометрия могут даже превосходить традиционную биполярную энергию по продолжительности процедуры, частоте рецидивов и удовлетворенности пациенток. Кроме того, эта методика находит широкое применение в контексте “увидеть и вылечить”, как показано в серии исследований Nappi и соавт. [40], где более 200 пациенток были пролечены с использованием такого же подхода, с отличными результатами хирургического вмешательства и низкими показателями по ВАШ. Наконец, хотя это и не подтверждено солидной литературой, еще одним малоинвазивным методом, который все чаще перемещает гистероскопическую хирургию из операционной в амбулаторные условия, является мини-резектоскоп. Мини-резектоскоп является широко используемым инструментом в гистероскопическом лечении внутриматочной патологии, а его миниатюризация, казалось бы, приносит с собой все преимущества обычного резектоскопа, вместе с процедурой, которая является более быстрой и хорошо переносится пациенткой и, таким образом, проводится без помощи анестезии в большинстве случаев [83,84,85,86,87,88,89]. Учитывая все более широкое использование лазерной и мини-резектоскопической технологии в гистероскопии “увидеть и вылечить”, будущие исследования должны быть проведены с целью проверки преимущества одной технологии над другой с точки зрения эффективности и безопасности.
Насколько нам известно, это первый систематический обзор, который исследует эффективность, безопасность и целесообразность лечения внутриматочной патологии с помощью диодного лазера.
Несмотря на использование диодного лазера опытными гинекологическими эндоскопистами во всем мире, собранная доказательная база ограничена: на сегодняшний день опубликовано лишь восемь исследований. Хотя удалось отметить низкий уровень интра- и послеоперационных осложнений (2,7% и 0,6%), а также низкую потребность в повторном вмешательстве (1,7%, за исключением пациенток с миомой, которым изначально планировали два хирургических этапа), не удалось получить достаточной информации для оценки репродуктивных результатов для пациенток, желающих иметь потомство.
Кроме того, в литературе также отсутствуют сообщения о “пошаговых описаниях процедур” в соответствии с лечащейся патологией. Хотя они не способствуют накоплению доказательной базы, они могут быть очень полезными для читателя как с научной, так и с клинической точки зрения.
Наконец, важно признать, что уровень доказательности значительно варьировался в зависимости от патологии, которую лечили, от 2 до 5.
5. Заключения
Диодные лазерные технологии можно считать безопасным и эффективным методом гистероскопического лечения внутриматочной патологии по принципу “увидеть и вылечить” в амбулаторных условиях, что уменьшает время ожидания и расходы, повышает комфорт пациентки и минимизирует потребность в анестезии. В сфере малоинвазивных методов лечения заболеваний матки диодные лазеры в гистероскопии стоят в одном ряду с другими инновационными технологиями и создают предпосылки для возможного широкого применения в будущем. Будущие исследования должны проводиться с большими размерами выборок и усовершенствованным дизайном, чтобы консолидировать доказательства, имеющиеся в настоящее время в литературе.
Ссылки на источники
- Raz, N.; Feinmesser, L.; Moore, O.; Haimovich, S. Endometrial Polyps: Diagnosis and Treatment Options–a Review of Literature. Minim. Invasive Ther. Allied Technol. 2021, 30, 278–287. [CrossRef]
- Krispin, E.; Nassr, A.A.; Espinoza, J.; Donepudi, R.; Sun, R.C.; Sanz-Cortes, M.; Mostafaei, S.; Belfort, M.A.; Shamshirsaz, A.A. Outcomes of Laparoscopy-Assisted Fetoscopic Laser Photocoagulation for Twin-Twin Transfusion Syndrome: An Established Alternative for Inaccessible Anterior Placenta. Prenat. Diagn. 2021, 41, 1582–1588. [CrossRef]
- Adamyan, L.; Kasyan, V.; Pivazyan, L.; Isaeva, S.; Avetisyan, J. Laser Vaporization Compared with Other Surgical Techniques in Women with Ovarian Endometrioma: A Systematic Review and Meta-Analysis. Arch. Gynecol. Obstet. 2023, 308, 413–425. [CrossRef] [PubMed]
- Mosseri, J.; Hocquemiller, R.; Mergui, J.-L.; Uzan, C.; Canlorbe, G. Laser Conization for Cervical Intraepithelial Neoplasia: Effectiveness and Obstetric Outcomes. J. Gynecol. Obstet. Hum. Reprod. 2022, 51, 102341. [CrossRef] [PubMed]
- ESGE Special Interest Group ‘Innovations’ Working Group. Lasers in Gynaecology–Are They Still Obsolete? Review of Past, Present and Future Applications. Facts Views Vis. Obgyn 2020, 12, 63–66.
- Law, K.S.K.; Abbott, J.A.; Lyons, S.D. Energy Sources for Gynecologic Laparoscopic Surgery: A Review of the Literature. Obstet. Gynecol. Surv. 2014, 69, 763–776. [CrossRef] [PubMed]
- Jung, Y.; Baik, G.H.; Ko, W.J.; Ko, B.M.; Kim, S.H.; Jang, J.S.; Jang, J.-Y.; Lee, W.-S.; Cho, Y.K.; Lim, S.G.; et al. Diode Laser-Can It Replace the Electrical Current Used in Endoscopic Submucosal Dissection? Clin. Endosc. 2021, 54, 555–562. [CrossRef]
- Nappi, L.; Sorrentino, F.; Angioni, S.; Pontis, A.; Greco, P. The Use of Laser in Hysteroscopic Surgery. Minerva Ginecol. 2016, 68, 722–726.
- Lara-Domínguez, M.D.; Arjona-Berral, J.E.; Dios-Palomares, R.; Castelo-Branco, C. Outpatient Hysteroscopic Polypectomy: Bipolar Energy System (Versapoint®) versus Diode Laser–Randomized Clinical Trial. Gynecol. Endocrinol. 2016, 32, 196–200. [CrossRef]
- Esteban Manchado, B.; Lopez-Yarto, M.; Fernandez-Parra, J.; Rodriguez-Oliver, A.; Gonzalez-Paredes, A.; Laganà, A.S.; Garzon, S.; Haimovich, S. Office Hysteroscopic Metroplasty with Diode Laser for Septate Uterus: A Multicenter Cohort Study. Minim. Invasive Ther. Allied Technol. 2022, 31, 441–447. [CrossRef]
- Bilgory, A.; Shalom-Paz, E.; Atzmon, Y.; Aslih, N.; Shibli, Y.; Estrada, D.; Haimovich, S. Diode Laser Hysteroscopic Metroplasty for Dysmorphic Uterus: A Pilot Study. Reprod. Sci. 2022, 29, 506–512. [CrossRef]
- Zywicka, B.; Rybak, Z.; Janeczek, M.; Czerski, A.; Bujok, J.; Szymonowicz, M.; Dobrzy´nski, M.; Korczy´nski, M.; ˙ Swiderski, J. ´ Comparison of A 1940 Nm Thulium-Doped Fiber Laser and A 1470 Nm Diode Laser for Cutting Efficacy and Hemostasis in A Pig Model of Spleen Surgery. Materials 2020, 13, 1167. [CrossRef]
- Bakour, S.H.; Jones, S.E.; O’Donovan, P. Ambulatory Hysteroscopy: Evidence-Based Guide to Diagnosis and Therapy. Best Pract. Res. Clin. Obstet. Gynaecol. 2006, 20, 953–975. [CrossRef]
- Revel, A.; Shushan, A. Investigation of the Infertile Couple: Hysteroscopy with Endometrial Biopsy Is the Gold Standard Investigation for Abnormal Uterine Bleeding. Hum. Reprod. 2002, 17, 1947–1949. [CrossRef] [PubMed]
- Tanos, V.; Berry, K.E.; Seikkula, J.; Abi Raad, E.; Stavroulis, A.; Sleiman, Z.; Campo, R.; Gordts, S. The Management of Polyps in Female Reproductive Organs. Int. J. Surg. 2017, 43, 7–16. [CrossRef] [PubMed] Diagnostics 2024, 14, 327 16 of 18
- Loddo, A.; Djokovic, D.; Drizi, A.; De Vree, B.P.; Sedrati, A.; van Herendael, B.J. Hysteroscopic Myomectomy: The Guidelines of the International Society for Gynecologic Endoscopy (ISGE). Eur. J. Obstet. Gynecol. Reprod. Biol. 2022, 268, 121–128. [CrossRef] [PubMed]
- Practice Committee of the American Society for Reproductive Medicine. Practice Committee of the American Society for Reproductive Medicine Uterine Septum: A Guideline. Fertil. Steril. 2016, 106, 530–540. [CrossRef]
- Capmas, P.; Pourcelot, A.-G.; Giral, E.; Fedida, D.; Fernandez, H. Office Hysteroscopy: A Report of 2402 Cases. J. Gynecol. Obstet. Biol. Reprod. 2016, 45, 445–450. [CrossRef]
- Salazar, C.A.; Isaacson, K.B. Office Operative Hysteroscopy: An Update. J. Minim. Invasive Gynecol. 2018, 25, 199–208. [CrossRef] [PubMed]
- Di Spiezio Sardo, A.; Giampaolino, P.; Manzi, A.; De Angelis, M.C.; Zizolfi, B.; Alonso, L.; Carugno, J. The Invisible External Cervical Os. Tips and Tricks to Overcome This Challenge during In-Office Hysteroscopy. J. Minim. Invasive Gynecol. 2021, 28, 172–173. [CrossRef]
- Wortman, M. “See-and-Treat” Hysteroscopy in the Management of Endometrial Polyps. Surg. Technol. Int. 2016, 28, 177–184. [PubMed]
- Gulumser, C.; Narvekar, N.; Pathak, M.; Palmer, E.; Parker, S.; Saridogan, E. See-and-Treat Outpatient Hysteroscopy: An Analysis of 1109 Examinations. Reprod. Biomed. Online 2010, 20, 423–429. [CrossRef] [PubMed]
- Gambadauro, P.; Martínez-Maestre, M.A.; Torrejón, R. When Is See-and-Treat Hysteroscopic Polypectomy Successful? Eur. J. Obstet. Gynecol. Reprod. Biol. 2014, 178, 70–73. [CrossRef] [PubMed]
- Saridogan, E.; Tilden, D.; Sykes, D.; Davis, N.; Subramanian, D. Cost-Analysis Comparison of Outpatient See-and-Treat Hysteroscopy Service with Other Hysteroscopy Service Models. J. Minim. Invasive Gynecol. 2010, 17, 518–525. [CrossRef] [PubMed]
- Neveu, M.-E.; Debras, E.; Niro, J.; Fernandez, H.; Panel, P. Standardizing Hysteroscopy Teaching: Development of a Curriculum Using the Delphi Method. Surg. Endosc. 2017, 31, 5389–5398. [CrossRef]
- Vilà Famada, A.; Cos Plans, R.; Costa Canals, L.; Rojas Torrijos, M.; Rodríguez Vicente, A.; Bainac Albadalejo, A. Outcomes of Surgical Hysteroscopy: 25 Years of Observational Study. J. Obstet. Gynaecol. 2022, 42, 1365–1369. [CrossRef]
- Donnez, J.; Gillerot, S.; Bourgonjon, D.; Clerckx, F.; Nisolle, M. Neodymium: YAG Laser Hysteroscopy in Large Submucous Fibroids. Fertil. Steril. 1990, 54, 999–1003. [CrossRef]
- Choe, J.K.; Baggish, M.S. Hysteroscopic Treatment of Septate Uterus with Neodymium-YAG Laser. Fertil. Steril. 1992, 57, 81–84. [CrossRef]
- Jourdain, O.; Dabysing, F.; Harle, T.; Lajus, C.; Roux, D.; Dallay, D. Management of Septate Uterus by Flexible Hysteroscopy and Nd:YAG Laser. Int. J. Gynaecol. Obstet. 1998, 63, 159–162. [CrossRef]
- Köchli, O.R. Endometrial Ablation in the Year 2000–Do We Have More Methods than Indications? Contrib. Gynecol. Obstet. 2000, 20, 91–120. [CrossRef] [PubMed]
- Chapman, R. New Therapeutic Technique for Treatment of Uterine Leiomyomas Using Laser-Induced Interstitial Thermotherapy (LITT) by a Minimally Invasive Method. Lasers Surg. Med. 1998, 22, 171–178. [CrossRef]
- Fedele, L.; Arcaini, L.; Parazzini, F.; Vercellini, P.; Di Nola, G. Reproductive Prognosis after Hysteroscopic Metroplasty in 102 Women: Life-Table Analysis. Fertil. Steril. 1993, 59, 768–772. [CrossRef] [PubMed]
- Vitale, S.G.; Mikuš, M.; De Angelis, M.C.; Carugno, J.; Riemma, G.; Franuši´c, L.; Cerovac, A.; D’alterio, M.N.; Nappi, L.; Angioni, S. Diode Laser Use in Hysteroscopic Surgery: Current Status and Future Perspectives. Minim. Invasive Ther. Allied Technol. 2023, 32, 275–284. [CrossRef]
- Moher, D.; Liberati, A.; Tetzlaff, J.; Altman, D.G.; PRISMA Group. Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Med. 2009, 6, e1000097. [CrossRef] [PubMed]
- Cumpston, M.; Li, T.; Page, M.J.; Chandler, J.; Welch, V.A.; Higgins, J.P.; Thomas, J. Updated Guidance for Trusted Systematic Reviews: A New Edition of the Cochrane Handbook for Systematic Reviews of Interventions. Cochrane Database Syst. Rev. 2019, 10, ED000142. [CrossRef] [PubMed]
- Stang, A. Critical Evaluation of the Newcastle-Ottawa Scale for the Assessment of the Quality of Nonrandomized Studies in Meta-Analyses. Eur. J. Epidemiol. 2010, 25, 603–605. [CrossRef]
- Home–2020. Available online: https://www.cebm.net/ (accessed on 5 October 2023).
- Haimovich, S.; Mancebo, G.; Alameda, F.; Agramunt, S.; Solé-Sedeno, J.M.; Hernández, J.L.; Carreras, R. Feasibility of a New Two-Step Procedure for Office Hysteroscopic Resection of Submucous Myomas: Results of a Pilot Study. Eur. J. Obstet. Gynecol. Reprod. Biol. 2013, 168, 191–194. [CrossRef]
- Nappi, L.; Pontis, A.; Sorrentino, F.; Greco, P.; Angioni, S. Hysteroscopic Metroplasty for the Septate Uterus with Diode Laser: A Pilot Study. Eur. J. Obstet. Gynecol. Reprod. Biol. 2016, 206, 32–35. [CrossRef]
- Nappi, L.; Sorrentino, F.; Angioni, S.; Pontis, A.; Litta, P.; Greco, P. Feasibility of Hysteroscopic Endometrial Polypectomy Using a New Dual Wavelengths Laser System (DWLS): Preliminary Results of a Pilot Study. Arch. Gynecol. Obstet. 2017, 295, 3–7. [CrossRef]
- Sorrentino, F.; De Feo, V.; Stabile, G.; Tinelli, R.; D’Alterio, M.N.; Ricci, G.; Angioni, S.; Nappi, L. Cesarean Scar Pregnancy Treated by Artery Embolization Combined with Diode Laser: A Novel Approach for a Rare Disease. Medicina 2021, 57, 411. [CrossRef] Diagnostics 2024, 14, 327 17 of 18
- Vitale, S.G.; Moore, O.; Riemma, G.; Carugno, J.; Yarto, M.L.; Haimovich, S. Hysteroscopic Laser Ablation of Symptomatic Uterine Fibroids: Insights from a Prospective Study. Climacteric 2023, 26, 497–502. [CrossRef] [PubMed]
- Chan, Y.Y.; Jayaprakasan, K.; Zamora, J.; Thornton, J.G.; Raine-Fenning, N.; Coomarasamy, A. The Prevalence of Congenital Uterine Anomalies in Unselected and High-Risk Populations: A Systematic Review. Hum. Reprod. Update 2011, 17, 761–771. [CrossRef] [PubMed]
- Abrao, M.S.; Muzii, L.; Marana, R. Anatomical Causes of Female Infertility and Their Management. Int. J. Gynaecol. Obstet. 2013, 123 (Suppl. S2), S18–S24. [CrossRef]
- Brucker, S.Y.; Rall, K.; Campo, R.; Oppelt, P.; Isaacson, K. Treatment of Congenital Malformations. Semin. Reprod. Med. 2011, 29, 101–112. [CrossRef] [PubMed]
- Adhesions, A.D. The American Fertility Society Classifications of Adnexal Adhesions, Distal Tubal Occlusion, Tubal Occlusion Secondary to Tubal Ligation, Tubal Pregnancies, Müllerian Anomalies and Intrauterine Adhesions. Fertil. Steril. 1988, 49, 944–955. [CrossRef]
- Grimbizis, G.F.; Gordts, S.; Di Spiezio Sardo, A.; Brucker, S.; De Angelis, C.; Gergolet, M.; Li, T.-C.; Tanos, V.; Brölmann, H.; Gianaroli, L.; et al. The ESHRE/ESGE Consensus on the Classification of Female Genital Tract Congenital Anomalies. Hum. Reprod. 2013, 28, 2032–2044. [CrossRef] [PubMed]
- Alonso Pacheco, L.; Laganà, A.S.; Ghezzi, F.; Haimovich, S.; Azumendi Gómez, P.; Carugno, J. Subtypes of T-Shaped Uterus. Fertil. Steril. 2019, 112, 399–400. [CrossRef]
- Stewart, E.A. Uterine Fibroids. Lancet 2001, 357, 293–298. [CrossRef]
- Parker, W.H. Etiology, Symptomatology, and Diagnosis of Uterine Myomas. Fertil. Steril. 2007, 87, 725–736. [CrossRef]
- Lethaby, A.; Vollenhoven, B. Fibroids (Uterine Myomatosis, Leiomyomas). BMJ Clin. Evid. 2015, 2015, 0814.
- Bachmann, G.A.; Bahouth, L.A.; Amalraj, P.; Mhamunkar, V.; Hoes, K.; Ananth, C.V. Uterine Fibroids: Correlations of Anemia and Pain to Fibroid Location and Uterine Weight. J. Reprod. Med. 2011, 56, 463–466.
- Lasmar, R.B.; Barrozo, P.R.M.; Dias, R.; Oliveira, M.A.P. de Submucous Myomas: A New Presurgical Classification to Evaluate the Viability of Hysteroscopic Surgical Treatment–Preliminary Report. J. Minim. Invasive Gynecol. 2005, 12, 308–311. [CrossRef]
- Cicinelli, E.; Mitsopoulos, V.; Fascilla, F.D.; Sioutis, D.; Bettocchi, S. The OPPIuM Technique: Office Hysteroscopic Technique for the Preparation of Partially Intramural Leiomyomas. Minerva Ginecol. 2016, 68, 328–333. [PubMed]
- Munro, M.G.; Critchley, H.O.D.; Broder, M.S.; Fraser, I.S. FIGO Working Group on Menstrual Disorders FIGO Classification System (PALM-COEIN) for Causes of Abnormal Uterine Bleeding in Nongravid Women of Reproductive Age. Int. J. Gynaecol. Obstet. 2011, 113, 3–13. [CrossRef] [PubMed]
- Jiang, J. Endometrial Polyps. Am. J. Obstet. Gynecol. 2022, 226, 734–735. [CrossRef] [PubMed]
- Munro, M.G. Uterine Polyps, Adenomyosis, Leiomyomas, and Endometrial Receptivity. Fertil. Steril. 2019, 111, 629–640. [CrossRef]
- Rackow, B.W.; Jorgensen, E.; Taylor, H.S. Endometrial Polyps Affect Uterine Receptivity. Fertil. Steril. 2011, 95, 2690–2692. [CrossRef] [PubMed]
- Bowman, Z.S.; Smith, K.R.; Silver, R.M. Cesarean Delivery and Risk for Subsequent Ectopic Pregnancy. Am. J. Perinatol. 2015, 32, 815–820. [CrossRef]
- Po, L.; Thomas, J.; Mills, K.; Zakhari, A.; Tulandi, T.; Shuman, M.; Page, A. Guideline No. 414: Management of Pregnancy of Unknown Location and Tubal and Nontubal Ectopic Pregnancies. J. Obstet. Gynaecol. Can. 2021, 43, 614–630.e1. [CrossRef]
- Wortman, M. Endometrial Ablation: Past, Present, and Future Part II. Surg. Technol. Int. 2018, 33, 161–177.
- Abi Antoun, M.; Etrusco, A.; Chiantera, V.; Laganà, A.S.; Feghali, E.; Khazzaka, A.; Stabile, G.; Della Corte, L.; Dellino, M.; Sleiman, Z. Outcomes of Conventional and Advanced Energy Devices in Laparoscopic Surgery: A Systematic Review. Minim. Invasive Ther. Allied Technol. 2024, 1–12. [CrossRef] [PubMed]
- Chene, G.; Chauvy, L.; Buenerd, A.; Moret, S.; Nadaud, B.; Beaufils, E.; Le Bail-Carval, K.; Chabert, P.; Mellier, G.; Lamblin, G. In Vivo Confocal Laser Endomicroscopy during Laparoscopy for Gynecological Surgery: A Promising Tool. J. Gynecol. Obstet. Hum. Reprod. 2017, 46, 565–569. [CrossRef]
- Donnez, J.; Squifflet, J.; Polet, R.; Nisolle, M. Laparoscopic Myolysis. Hum. Reprod. Update 2000, 6, 609–613. [CrossRef] [PubMed]
- Mairos, J.; Di Martino, P. Office Hysteroscopy. An Operative Gold Standard Technique and an Important Contribution to Patient Safety. Gynecol. Surg. 2016, 13, 111–114. [CrossRef] [PubMed]
- Moore, J.F.; Carugno, J. Hysteroscopy. In StatPearls; StatPearls Publishing: Treasure Island, FL, USA, 2023.
- Ahmad, G.; Saluja, S.; O’Flynn, H.; Sorrentino, A.; Leach, D.; Watson, A. Pain Relief for Outpatient Hysteroscopy. Cochrane Database Syst. Rev. 2017, CD007710. [CrossRef]
- Hadisaputra, W.; Hani, C.A.S.; Putri, N.A. Patient Safety in Hysteroscopic Procedure. Gynecol. Minim. Invasive Ther. 2022, 11, 145–149. [CrossRef]
- Garuti, G.; Cellani, F.; Colonnelli, M.; Grossi, F.; Luerti, M. Outpatient Hysteroscopic Polypectomy in 237 Patients: Feasibility of a One-Stop “See-and-Treat” Procedure. J. Am. Assoc. Gynecol. Laparosc. 2004, 11, 500–504. [CrossRef]
- Gambadauro, P.; Milenkovic, M.; Hadlaczky, G. Simulation for Training and Assessment in Hysteroscopy: A Systematic Review. J. Minim. Invasive Gynecol. 2018, 25, 963–973. [CrossRef]
- Chatzipapas, I.; Kathopoulis, N.; Protopapas, A.; Loutradis, D. Hysteroscopy for Training Residents Using Uterine PostHysterectomy Specimens with a Mobile Hysteroscope. Facts Views Vis. Obgyn 2020, 12, 43–46. Diagnostics 2024, 14, 327 18 of 18
- Michel, L.; Chudnoff, S. Gynecology Resident Experience with Office Hysteroscopy Training. JSLS 2023, 27, e2023.00009. [CrossRef]
- Mazzon, I.; Etrusco, A.; Laganà, A.S.; Chiantera, V.; Di Angelo Antonio, S.; Tosto, V.; Gerli, S.; Favilli, A. Training in Diagnostic Hysteroscopy: The “Arbor Vitae” Method. Medicina 2023, 59, 1019. [CrossRef]
- Munro, M.G.; Critchley, H.O.D.; Fraser, I.S. FIGO Menstrual Disorders Committee The Two FIGO Systems for Normal and Abnormal Uterine Bleeding Symptoms and Classification of Causes of Abnormal Uterine Bleeding in the Reproductive Years: 2018 Revisions. Int. J. Gynaecol. Obstet. 2018, 143, 393–408. [CrossRef]
- Etrusco, A.; Laganà, A.S.; Chiantera, V.; Vitagliano, A.; Cicinelli, E.; Mikuš, M.; Šprem Goldštajn, M.; Ferrari, F.; Uccella, S.; Garzon, S.; et al. Feasibility and Surgical Outcomes of Hysteroscopic Myomectomy of FIGO Type 3 Myoma: A Systematic Review. J. Clin. Med. 2023, 12, 4953. [CrossRef]
- Favilli, A.; Etrusco, A.; Chiantera, V.; Laganà, A.S.; Cicinelli, E.; Gerli, S.; Vitagliano, A. Impact of FIGO Type 3 Uterine Fibroids on in Vitro Fertilization Outcomes: A Systematic Review and Meta-Analysis. Int. J. Gynaecol. Obstet. 2023, 163, 528–539. [CrossRef]
- Capmas, P.; Voulgaropoulos, A.; Legendre, G.; Pourcelot, A.-G.; Fernandez, H. Hysteroscopic Resection of Type 3 Myoma: A New Challenge? Eur. J. Obstet. Gynecol. Reprod. Biol. 2016, 205, 165–169. [CrossRef]
- Favilli, A.; Mazzon, I.; Etrusco, A.; Dellino, M.; Laganà, A.S.; Tinelli, A.; Chiantera, V.; Cicinelli, E.; Gerli, S.; Vitagliano, A. The Challenge of FIGO Type 3 Leiomyomas and Infertility: Exploring Therapeutic Alternatives amidst Limited Scientific Certainties. Int. J. Gynaecol. Obstet. 2023. ahead of print. [CrossRef]
- Ahmadzade, M.; Rouientan, H.; Golzarian, J.; Akhlaghpoor, S. An Evaluation of Ultrasound-Guided Percutaneous Microwave Ablation for the Treatment of Symptomatic Uterine Fibroids. J. Vasc. Interv. Radiol. 2023, 35, 45–50. [CrossRef] [PubMed]
- Fasciani, A.; Turtulici, G.; Pedullà, A.; Sirito, R. Uterine Myoma Position-Based Radiofrequency Ablation (UMP-b RFA): 36 Months Follow-up Clinical Outcomes. Eur. J. Obstet. Gynecol. Reprod. Biol. 2023, 281, 23–28. [CrossRef] [PubMed]
- Mahmoud, M.Z.; Alkhorayef, M.; Alzimami, K.S.; Aljuhani, M.S.; Sulieman, A. High-Intensity Focused Ultrasound (HIFU) in Uterine Fibroid Treatment: Review Study. Pol. J. Radiol. 2014, 79, 384–390. [CrossRef] [PubMed]
- Slotman, D.J.; Bartels, L.W.; Zijlstra, A.; Verpalen, I.M.; van Osch, J.A.C.; Nijholt, I.M.; Heijman, E.; van ’t Veer-Ten Kate, M.; de Boer, E.; van den Hoed, R.D.; et al. Diffusion-Weighted MRI with Deep Learning for Visualizing Treatment Results of MR-Guided HIFU Ablation of Uterine Fibroids. Eur. Radiol. 2023, 33, 4178–4188. [CrossRef] [PubMed]
- Casadio, P.; Gubbini, G.; Franchini, M.; Morra, C.; Talamo, M.R.; Magnarelli, G.; Paradisi, R.; Florio, P.; Seracchioli, R. Comparison of Hysteroscopic Cesarean Scar Defect Repair with 26 Fr Resectoscope and 16 Fr Mini-Resectoscope: A Prospective Pilot Study. J. Minim. Invasive Gynecol. 2021, 28, 314–319. [CrossRef]
- Papalampros, P.; Gambadauro, P.; Papadopoulos, N.; Polyzos, D.; Chapman, L.; Magos, A. The Mini-Resectoscope: A New Instrument for Office Hysteroscopic Surgery. Acta Obstet. Gynecol. Scand. 2009, 88, 227–230. [CrossRef]
- Ricciardi, R.; Lanzone, A.; Tagliaferri, V.; Di Florio, C.; Ricciardi, L.; Selvaggi, L.; Guido, M. Using a 16-French Resectoscope as an Alternative Device in the Treatment of Uterine Lesions: A Randomized Controlled Trial. Obstet. Gynecol. 2012, 120, 160–165. [CrossRef]
- Roy, K.K.; Lingampally, A.; Kansal, Y.; Bharti, J.; Kumar, S.; Vanamail, P.; Singhal, S.; Meena, J. A Pilot Study Comparing Hysteroscopic Adhesiolysis by Conventional Resectoscope Versus Mini-Resectoscope. Oman Med. J. 2017, 32, 492–498. [CrossRef] [PubMed]
- Roy, K.K.; Anusha, S.M.; Rai, R.; Das, A.; Zangmo, R.; Singhal, S. A Prospective Randomized Comparative Clinical Trial of Hysteroscopic Septal Resection Using Conventional Resectoscope Versus Mini-Resectoscope. J. Hum. Reprod. Sci. 2021, 14, 61–67. [CrossRef] [PubMed]
- Dealberti, D.; Riboni, F.; Prigione, S.; Pisani, C.; Rovetta, E.; Montella, F.; Garuti, G. New Mini-Resectoscope: Analysis of Preliminary Quality Results in Outpatient Hysteroscopic Polypectomy. Arch. Gynecol. Obstet. 2013, 288, 349–353. [CrossRef] [PubMed]
- Dealberti, D.; Riboni, F.; Cosma, S.; Pisani, C.; Montella, F.; Saitta, S.; Calagna, G.; Di Spiezio Sardo, A. Feasibility and Acceptability of Office-Based Polypectomy With a 16F Mini-Resectoscope: A Multicenter Clinical Study. J. Minim. Invasive Gynecol. 2016, 23, 418–424. [CrossRef]