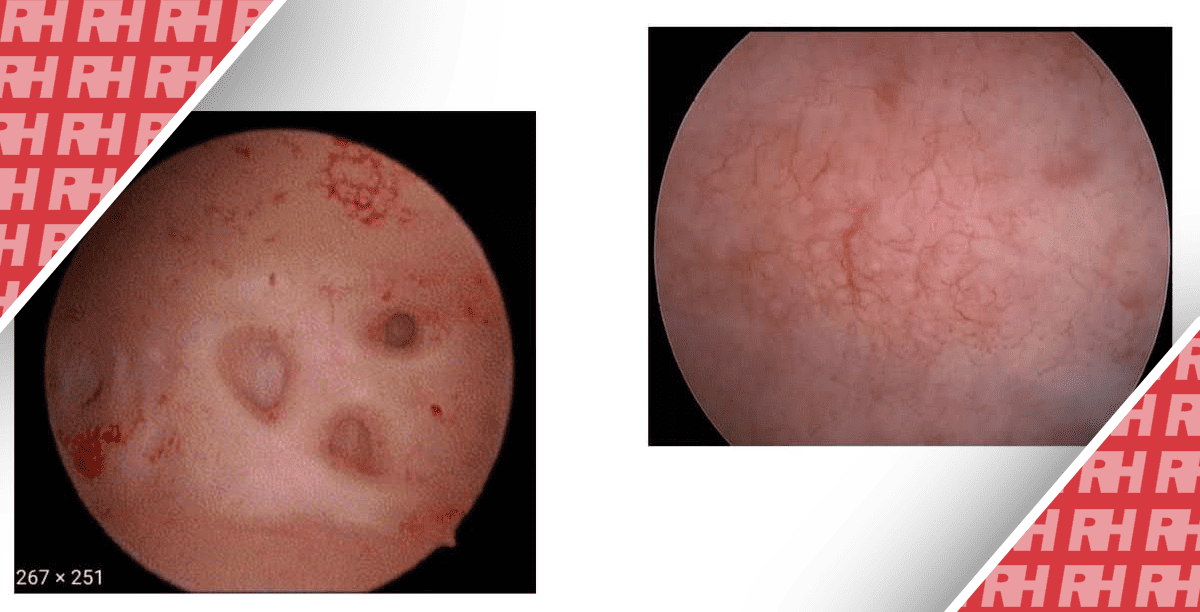
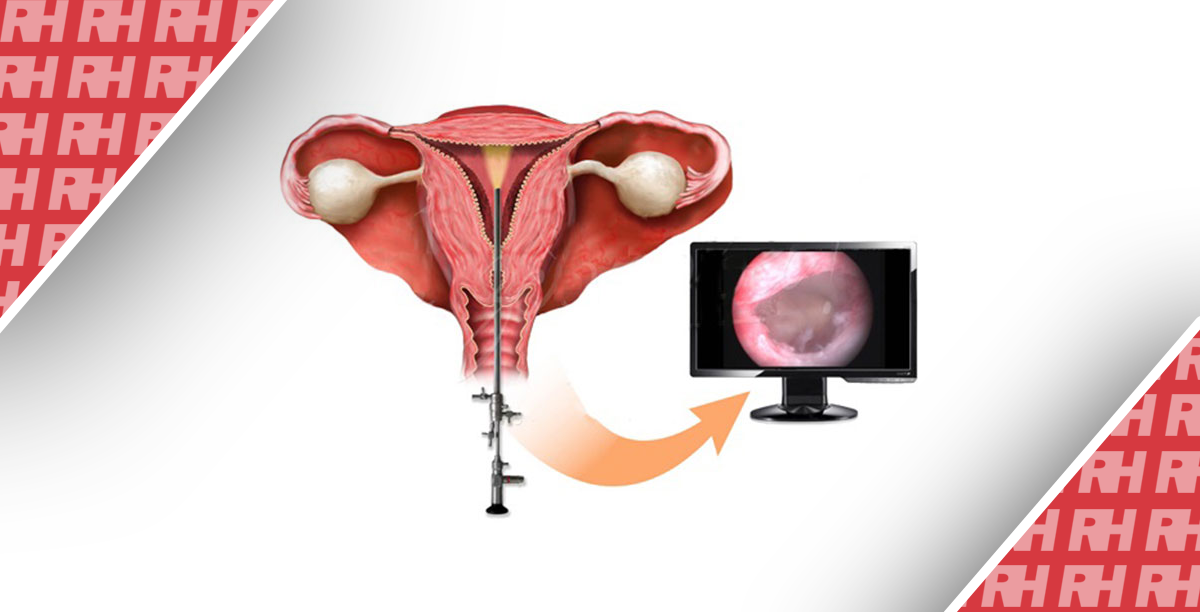
Резюме
Это руководство содержит обновленные рекомендации для гинекологов, выполняющих биопсию эндометрия (БЭ) в гинекологической клинической практике.
Рекомендации разработаны международным комитетом экспертов-гинекологов в соответствии с AGREE Reporting Guideline.
Адекватный забор тканей является обязательным при проведении БЭ. Слепые методы не должны быть методом первого выбора у пациенток с подозрением на злокачественную опухоль эндометрия. Гистероскопия является методом прицельной биопсии с самой высокой диагностической точностью и экономической эффективностью. Методы слепой аспирации не являются надежными для диагностики полипов эндометрия. В условиях ограниченных ресурсов и при отсутствии возможности проведения гистероскопии в условиях кабинета врача, слепые методы могут быть использованы для ЭБ. Гистероскопическая панч биопсия позволяет собрать лишь ограниченное количество эндометриальной ткани. У женщин репродуктивного возраста следует рассматривать технику грасп биопсии как первый выбор, а при гипотрофическом или атрофическом эндометрии следует отдавать предпочтение биполярной электродной чип-биопсии. БЭ необходима для окончательного диагноза хронического эндометрита. Нет единого мнения относительно того, какую границу толщины эндометрия следует использовать для рекомендации проведения БЭ у бессимптомных женщин в постменопаузе. БЭ следует предлагать молодым женщинам с аномальными маточными кровотечениями и факторами риска развития карциномы эндометрия. Патология эндометрия должна быть исключена с помощью БЭ у женщин без ожирения с неподтвержденной гиперэстрогенией. Гистероскопия с БЭ полезна у пациенток с аномальными кровотечениями даже без сонографических признаков патологии. БЭ имеет высокую чувствительность для выявления внутриматочных патологий. У женщин в постменопаузе с маточными кровотечениями рекомендуется проведение БЭ. Женщинам с сонографической толщиной эндометрия > 4 мм, принимающим тамоксифен, следует проводить гистероскопическую БЭ.
Ключевые слова
Гистероскопия Практические рекомендации Эндометрий Биопсия эндометрия Биопсия эндометрия
1. Вступление
Биопсия эндометрия (БЭ) – распространенная гинекологическая процедура, которая часто выполняется в клинической практике. Существует несколько видов оборудования и методик для проведения БЭ. В последние годы забор образцов эндометрия в офисе заменил необходимость диагностического выскабливания или оперативной гистероскопии – процедур, которые обычно проводятся в операционной с пациенткой под общей анестезией[1].
Существует много различных клинических сценариев, требующих БЭ, например, пациентки с утолщенным эндометрием или аномальным маточным кровотечением (АМК)[1,2]. Хотя БЭ является очень безопасной и эффективной процедурой для выявления рака эндометрия (РЭ) или атипичной гиперплазии (АГ), БЭ может привести к ложноотрицательному результату, пропуску диагноза, что в основном связано с техникой биопсии, нерепрезентативным отбором образцов и вариабельной патологоанатомической интерпретацией[3].
Целью этого клинического руководства является обобщение наиболее релевантных имеющихся научных данных о методах и показаниях к проведению БЭ.
1.1. Выявление и оценка данных
Это практическое руководство было подготовлено с использованием следующей методологии поиска: электронные базы данных, включая MEDLINE, EMBASE, Global Health, Кокрановскую библиотеку (Кокрановская база данных систематических обзоров, Кокрановский центральный реестр контролируемых исследований, Кокрановский методологический реестр), базу данных оценки медицинских технологий и Web of Science, исследовательские реестры (такие как www. clinicaltrials.gov) с момента создания до июня 2022 года; мы использовали универсальный медицинский Тезаурус (MeSH) “Эндометрий” (уникальный идентификатор MeSH: D004717) в сочетании с термином “Биопсия” (уникальный идентификатор MeSH: D001706). Поиск исследования не ограничивался английским языком, а распространялся на испанский, китайский, французский, итальянский и португальский языки. Авторы, свободно владеющие другими языками (испанским, китайским, французским, итальянским и португальским), оценивали соответствующие публикации на иностранном языке и предоставляли соответствующую информацию после перевода на английский. Списки литературы всех идентифицированных работ были проверены для выявления исследований, не охваченных электронным поиском. Все исследования были оценены на предмет методологической строгости и классифицированы в соответствии с классификационной системой Целевой группы по вопросам профилактических услуг США (Таблица 1). Названия и/или рефераты исследований, полученные с помощью поисковой стратегии, были проанализированы 2 авторами независимо друг от друга для выявления исследований, которые соответствуют целям этого руководства. Полные тексты статей, которые отвечали критериям отбора, были получены и независимо оценены на соответствие критериям отбора другими 2 членами авторского коллектива. Любые разногласия между ними относительно приемлемости отобранных статей решались путем обсуждения с третьим (внешним) соавтором. Два автора независимо друг от друга извлекали данные из статей об особенностях исследования и включенных в него популяциях, типе вмешательства и результатах. Любые разногласия были выявлены и решены путем обсуждения (при необходимости с третьим внешним соавтором).
Таблица 1: Оценка данных для практического руководства.
| Доказательства были проанализированы и оценены на предмет качества по критериям, определенным Рабочей группой по вопросам профилактических услуг США (U.S. Preventive Services Task Force) |
| – I доказательства, полученные по меньшей мере из одного должным образом спланированного рандомизированного контролируемого исследования. |
| – II-1 Доказательства, полученные из хорошо спланированных контролируемых исследований без рандомизации. |
| – II-2 Доказательства, полученные из хорошо спланированных когортных аналитических исследований или исследований типа “случай-контроль”, желательно из нескольких центров или исследовательских групп. |
| – II-3 Доказательства, полученные из нескольких временных рядов с вмешательством или без него. Впечатляющие результаты в неконтролируемых экспериментах также могут рассматриваться как этот тип доказательств. |
| – III Выводы компетентных экспертов, основанные на клиническом опыте, описательных исследованиях или отчетах экспертных комитетов. |
| На основе самого высокого уровня доказательности, обнаруженного в данных, предоставляются рекомендации, которые классифицируются по следующим категориям: |
| – Уровень А: Рекомендации основываются на достоверных и последовательных научных данных. |
| – Уровень B: Рекомендации базируются на ограниченных или противоречивых научных данных. |
| – Уровень C: Рекомендации основываются преимущественно на консенсусе и мнении экспертов. |
1.2. Привлечение заинтересованных сторон и возможность применения
Ці рекомендації ґрунтуються на професійній думці і покликані допомогти гінекологам у лікуванні пересічних пацієнток. Їх не слід розглядати як жорсткі та швидкі правила, і вони не призначені для того, щоб замінити клінічне судження.
Рекомендації ґрунтуються на найкращих доступних наукових даних, коли це можливо, і на консенсусі групи експертів, коли такі дані недоступні. Вони, ймовірно, можуть змінюватися в міру того, як ми дізнаємося більше про стан.
В подготовке этого руководства принимали участие специалисты по гинекологическому ультразвуковому исследованию (УЗИ), гистероскопии, бесплодию и онкологической терапии патологии эндометрия, в соответствии со стандартами AGREE Reporting Guideline [4]. Три внешних рецензента, два гинеколога и гинекологический гистопатолог, случайно выбранные с помощью компьютерной рандомизации из списка из 200 экспертов, имеющих опыт в вышеупомянутых областях, подробно оценили эти практические рекомендации в двух раундах пересмотра перед публикацией.
1.3. Показания к биопсии эндометрия
Ежегодно многие женщины обращаются к гинекологам с симптомами, указывающими на необходимость БЭ. Ежегодно в США диагностируют РЭ примерно у 65 000 женщин. Среди наиболее частых показаний к БЭ в клинической практике – бесплодие и субфертильность, оценка состояния полости матки перед применением вспомогательных репродуктивных технологий (ВРТ), обследование пациенток в пременопаузе и постменопаузе с АМК и другие [5]. Этиология АМК классифицируется в соответствии с классификацией PALM-COEIN, разработанной Munro с соавторами [6 ] и принятой Международной федерацией гинекологии и акушерства (FIGO). Классифицируя аномальные маточные кровотечения по потенциальной причине, эта система различает полипы, аденомиоз, лейомиому, злокачественную опухоль и гиперплазию, коагулопатию, овуляторную дисфункцию, эндометриальные, ятрогенные и еще не классифицированные причины. Структурные причины аномальных маточных кровотечений объединены в разделе PALM-COEIN под аббревиатурой “PALM”. И наоборот, неструктурные, гормональные или системные причины АМК обозначены аббревиатурой “COEIN“[1,2].
Перед проведением БЭ в анамнез следует собрать вопросы о характере менструального кровотечения (частота, продолжительность, регулярность и количество), наличие боли, семейный анамнез АМК или сопутствующие нарушения кровотечения, прием лекарств или растительных препаратов, которые могут влиять на кровотечение в целом, например, женьшень, гинкго, применение гормональных контрацептивов, нестероидных противовоспалительных препаратов, производных варфарина или гепарина. Тщательный анализ характера кровотечения будет одним из важнейших компонентов истории болезни. Например, рак или даже гиперплазия вряд ли могут быть причиной циклических менструальных кровотечений[1,2].
Независимо от клинического сценария, РЭ может быть выполнена несколькими способами [7].
1.4. Методы биопсии эндометрия
Было проведено много исследований, которые оценивали различные техники выполнения БЭ. Taraboanta и соавт. провели ретроспективное поперечное исследование 1677 образцов гистерэктомии с диагнозом “атипичная гиперплазия/эндометриоидная интраэпителиальная неоплазия ” (АГ/ЭИН) или РЭ, оценивая те из них, у которых предыдущая биопсия эндометрия была отрицательной. Из этих случаев с отрицательной биопсией эндометрия перед гистерэктомией 172 были классифицированы как неадекватные/недостаточные, поскольку ткань эндометрия отсутствовала или имела доброкачественный диагноз. Важным ограничением этого исследования было то, что не было определено процедуру, которая была использована для взятия образцов эндометрия. При отрицательном результате биопсии эндометрия вероятность послетестового диагноза РЭ или АГ/ЭИН в образце, взятом во время гистерэктомии, составляла 0,74%. Результаты этого исследования свидетельствуют о важности адекватного забора образцов эндометрия[8,9].
Когда-то D&C был признан золотым стандартом для взятия образцов эндометрия[10]. Сначала D&C считался точным методом определения стадии рака эндометрия[11]. Позже было установлено, что предоперационный диагноз рака эндометрия 1-й степени по FIGO совпадает с БЭ в 85% случаев. Однако в 8,7% случаев во время гистерэктомии была выявлена более высокая степень рака[12]. Piatek et al. оценили ретроспективный когортный анализ с учетом всех пациенток, которым была проведена биопсия эндометрия с использованием Pipelle® и D&C. Целью этого исследования было определить частоту неудачного взятия образцов эндометрия и факторы, влияющие на качество образцов, полученных для гистологического исследования. Из 895 выполненных процедур забора образцов эндометрия 339 пациенткам была проведена биопсия Pipelle®, а 556 – D&C. Неадекватные образцы были обнаружены в 60 и 88 случаях соответственно. Исследование показало, что ни один из этих двух методов не гарантирует адекватного отбора образцов[13]. Utida et al. провели перекрестное исследование для сравнения эффективности гистологических образцов эндометрия, собранных с помощью аспирации Pipelle® и гистероскопической биопсии. Основной целью этого исследования было оценить соответствие между этими двумя методами взятия образцов эндометрия. В частности, приоритетом была гистологическая диагностика злокачественных опухолей, а затем оценивалось сравнение стоимости обоих методов. В исследовании приняли участие 45 женщин (старше 35 лет с АМК или постменопаузальными кровотечениями), которым проводили БЭ как с помощью гистероскопии, так и с помощью Pipelle®. Интересно, что БЭ, полученные с помощью Pipelle®, имели высокую точность для РЭ (100% совпадение между двумя процедурами), но более низкую точность для диагностики полипов. Важно отметить, что биопсии с помощью Pipelle® стоили в 27 раз дешевле, чем гистероскопические биопсии[14]. Очень важным аспектом этого исследования является то, что оно подчеркивает важность выполнения БЭ под прямой визуализацией[15]. Однако такие выводы были ограничены уменьшенным размером выборки исследования.
На сегодняшний день слепое взятие образцов эндометрия не считается эффективным для диагностики очаговых поражений полости матки, таких как полипы или субмукозная миома[16].
Забор образцов эндометрия также может быть выполнен с помощью ультразвукового исследования (УЗИ). Однако УЗИ имеет более низкую способность выявлять поражения эндометрия по сравнению с гистероскопией[17,18]. Действительно, проспективное исследование, проведенное Reznak и соавт., показало, что аномальные результаты УЗИ должны быть подтверждены гистероскопической визуализацией с прицельной биопсией и гистологическим исследованием, чтобы избежать низкой точности[19].
Cheng и соавт. провели ретроспективное когортное исследование, в котором оценивали использование биопсийного захвата Lin’s для биопсии эндометрия. Захват для биопсии Lin’s – это устройство, специально разработанное для работы в сочетании с гибким гистероскопом для выполнения внутриматочной биопсии под трансабдоминальным ультразвуковым наведением. Этот метод прицельной биопсии позволяет проводить биопсию эндометрия в офисных условиях. Они выполнили 126 прицельных биопсий эндометрия, достигнув высокого уровня диагностики (92,1%, в 116 случаях диагноз был подтвержден гистологически) и адекватного качества ткани (77,8%, в 98 случаях был получен оптимальный объем образца)[20].
Bryant и соавт. провели ретроспективный анализ 141 гистерэктомии, выполненной у пациенток с предоперационным или случайным диагнозом АГ/ЭИН. Полученные ими данные свидетельствуют о ценности селективного, а не полного забора образцов для выявления АГ/ЭИН и РЭ, показывая, что селективный подход может быть чрезвычайно полезным для диагностики[21].
Что касается техники офисной гистероскопии БЭ, то различные исследования предоставили результаты по использованию оперативных щипцов, которые вводятся через операционный канал гистероскопа размером 5 Fr[22]. Стандартная техника выполнения гистероскопической управляемой БЭ была предложена в 2002 году Bettocchi и др. Коротко, щипцы с открытыми губками располагают к эндометрию. Губки продвигаются в ткань на 0,5-1 см. После того, как большая часть слизистой оболочки будет тангенциально отделена, губки смыкаются и весь гистероскоп вынимается из полости матки, не втягивая кончик инструмента обратно в канал. Этот метод позволяет собрать большее количество ткани[23].
Одним из последних преимуществ метода БЭ является возможность исследования опухолевого материала, содержащегося в биологических жидкостях. Жидкостная биопсия также предоставляет преимущества для мониторинга прогрессирования рака и ответа на терапию. Диагностическая процедура состоит из биопсии эндометрия, которую получают путем минимально инвазивной аспирации из полости матки с помощью Pipelle®. Аномальные клетки, присутствующие в аспирате, анализируются[24]. Hirai и соавт. провели многоцентровое исследование, в котором сравнивали клиническую эффективность жидкостной цитологии эндометрия с использованием SurePath™ с классической аспирационной биопсией ткани эндометрия. Они предположили, что жидкостная цитология эндометрия не уступает аспирационной биопсии ткани эндометрия в выявлении рака эндометрия[25].
1.5. Рекомендуемые руководства по биопсии эндометрия
Опираясь на имеющиеся доказательства, мы предлагаем следующие рекомендации:
При выполнении БЭ (уровень А) обязательным является соответствующий отбор образцов.
При выполнении диагностической гистероскопии и БЭ, БЭ следует проводить после гистероскопической процедуры (уровень С).
D&C и Pipelle® не должны быть методом первого выбора для проведения БЭ у пациенток с подозрением на злокачественную опухоль эндометрия (уровень В).
Использование VA, Pipelle® для проведения БЭ в амбулаторных условиях не является эффективным и имеет недостаточную чувствительность при диагностике полипов эндометрия (уровень С).
Гистероскопия в пределах кабинета врача является методом прицельной биопсии с самой высокой диагностической точностью (уровень А).
Жидкостная биопсия является перспективным методом выявления маркеров эндометрия (уровень В).
Аспирационные методы не являются надежными для диагностики полипов эндометрия (уровень А).
В условиях ограниченных ресурсов и отсутствия возможности проведения гистероскопии в кабинете врача для БЭ можно использовать слепые методы (уровень В).
1.6. Гистероскопические методы биопсии эндометрия
Панч биопсия была первым типом техники, который широко использовался для гистероскопической биопсии. Она использует ложковые щипцы и в течение нескольких лет считалась стандартным инструментом для биопсии. Согласно этой технике, губки биопсийных щипцов держат открытыми в тесном контакте с эндометрием, прежде чем закрыть их[26]. Гистероскоп оставляют в полости матки, а сомкнутые щипцы извлекают через рабочий канал. Однако, поскольку выдвижение губок по сравнению с другими биопсийными щипцами относительно ограничено (2,5 мм против 5 мм у щипцов типа “аллигатор”), полученный объем ткани иногда недостаточен для удовлетворительной гистологической диагностики [27,28].
Для увеличения количества изъятой ткани, достаточного для корректного гистологического исследования, в 2002 г. Bettocchi и соавт. предложили новую технику биопсии, которая получила название грасп биопсия (grasp biopsy). Они использовали зубчатые щипцы, известные как щипцы-алигаторы. Благодаря двойной длине мягких зубчатых поверхностей, пинцет-алигатор может захватывать больший объем ткани. Если коротко, то пинцет-алигатор размещается в тесном контакте с целевым участком, где необходимо взять образец эндометрия, с широко раскрытыми челюстями. Затем пинцет продвигают вперед, “углубляясь” вместе с тканью примерно на 0,5-1 см, стараясь избежать контакта с подстилающим миометрием, чтобы предотвратить стимуляцию нервных волокон миометрия и минимизировать боль. Затем челюсти смыкаются, захватывая участок ткани эндометрия, подлежащей удалению, которую впоследствии извлекают из полости матки вместе с гистероскопом[23,29].
У женщин в перименопаузе и постменопаузе с гипотрофическим или атрофическим эндометрием сложнее зажать соответствующее количество ткани. В этом случае особенно эффективным является проведение чип-биопсии – срезание “с” эндометрия биполярным электродом 5 Fr, введенным в рабочий канал гистероскопа. “Отсечение” эндометрия может сделать методику проще, чем другие, а также может быть полезной при взятии образцов поверхностной поверхности миометрия (то есть у женщин с подозрением на предраковую или злокачественную патологию эндометрия)[30], [31],[32].
Альтернативным подходом к получению эндометрия с гипотрофической или атрофической поверхности является техника пикап-биопсии. Она заключается в том, что ткань забирают кончиком гистероскопа как плугом или кончиком специальных механических инструментов, чтобы собрать больше материала для исследования. Недавно запатентованный инструмент для этой цели – биопсийные щипцы-змейки VITALE (Centrel Srl, Понте Сан Николо, Падуя, Италия). Он характеризуется плоским заостренным кончиком с зубчатыми краями, которые помогают выделить гипотрофический или атрофический эндометрий, подлежащий резекции, избегая в то же время потери фрагментов образца[33]. Еще одним важным аспектом, на который следует обратить внимание, является боль, возникающая во время гистероскопического взятия образцов эндометрия. Доказательства класса I свидетельствуют об усилении болевых ощущений при пункционной биопсии по сравнению с грасп и пикап техникой[31].
1.7. Рекомендуемые рекомендации по соответствующей технике гистероскопической биопсии
Панч биопсия позволяет собрать ограниченное количество эндометрия для исследования. (Уровень В).
Грасп биопсию следует считать наиболее приемлемой методикой для женщин репродуктивного возраста. (Уровень А).
Чип-биопсия эффективна для сбора большего количества эндометрия по сравнению с другими методами у женщин в перименопаузе и постменопаузе. (Уровень B).
У женщин в перименопаузе и постменопаузе техника пикап-биопсии является более эффективной для сбора ткани эндометрия по сравнению с пункционной биопсией (Уровень А).
1.8. Клинические сценарии
В общем, гистероскопия направлена на диагностику предраковых или раковых поражений, выявление и лечение доброкачественной эндокавитационной патологии, такой как лейомиомы или полипы эндометрия, ранее выявленные с помощью УЗИ, а также на оценку субклинических состояний, которые могут привести к бесплодию (например, синдром Ашермана или эндометрит)[34,35]. В настоящее время единственным абсолютным противопоказанием к гистероскопии является активная инфекция матки или органов малого таза. Кроме того, женщины с диагнозом первичное бесплодие, рецидивирующее невынашивание беременности или субфертильность имеют клинические показания для проведения оценки патологии эндометрия и морфологии матки[36]. С этой целью мы подклассифицировали клинические сценарии в соответствии с возрастом пациентки и симптоматикой. Для целей данного обзора бессимптомными считались женщины без АМК, независимо от их менопаузального статуса, и наоборот, симптоматическими – женщины с симптомами (как правило, АМК).
1.9. Бессимптомные женщины
1.9.1. Бессимптомные пациенты репродуктивного возраста
В этой группе пациенток недостаточное количество специальных популяционных исследований влияет на результаты наших рекомендаций. Одной из основных причин, требующих проведения БЭ у бессимптомных женщин, является бесплодие[37]. В частности, хронический эндометрит признан одним из маточных факторов, ухудшающих имплантацию эмбриона, и проведение иммуногистохимической (ИГХ) диагностики на образцах эндометрия является обязательным[38]. В связи с этим Zargar и соавт. провели перекрестное исследование с целью сравнения распространенности хронического эндометрита у пациенток с повторной неудачей имплантации (НИ) и повторной потерей беременности (ПВ) с помощью гистероскопии и иммуногистохимии. Результаты показали, что гистероскопический визуальный осмотр (поиск микрополипов или красных пятен) является надежным инструментом для диагностики хронического эндометрита у пациенток с RIF и RPL, однако его точность недостаточна для того, чтобы рассматривать его как альтернативу ИГХ[39]. Другие исследования подтвердили необходимость комбинированной диагностической гистероскопии и БЭ у женщин с жалобами на репродуктивные проблемы[40], [41],[42]. Особенно в ситуациях повторной неудачи ВРТ, существует значительная вероятность недиагностированной патологии матки во время регулярного УЗИ у бесплодных женщин. Более высокие показатели эффективной ВРТ и частоты наступления беременности наблюдаются при рутинном обследовании пациенток с помощью гистероскопии в кабинете врача и БЭ[43],[44], [ 45],[46],[47], [ 48],[49].
Перед началом АРТ гинеколог должен тщательно осмотреть полость матки и задокументировать (с помощью соответствующей биопсии или иссечения) любые патологические изменения эндометрия.
1.10 Рекомендуемые клинические рекомендации для бессимптомных пациенток репродуктивного возраста
У бессимптомных женщин в пременопаузе БЭ является полезным инструментом для диагностики хронического эндометрита (уровень А).
Гистероскопия с БЭ или без него является полезной для диагностики бесплодия (уровень А).
В случае неудачи ВРТ гистероскопическое БЭ имеет решающее значение для избежания ошибочных диагнозов и улучшения репродуктивных результатов (уровень В).
1.11 Бессимптомные пациентки в постменопаузе
Случайное обнаружение утолщенного эндометрия при УЗИ у бессимптомных женщин является распространенным клиническим сценарием[50], [51], [52],[53].
Некоторые эксперты выступают за принятие предельного значения толщины эндометрия 4,0 или 5,0 мм у пациенток с постменопаузальными кровотечениями (ПМК), чтобы рекомендовать дополнительное исследование эндометрия [50, [54], [55], [56], [ 57],[58]]. Риск РЭ составляет менее 1% при толщине эндометрия (Т) менее 4,0 мм[50,[54], [ 55],[56], [57],[58]]. У некоторых женщин предраковые или злокачественные состояния матки протекают бессимптомно[51]. Нет четкого консенсуса относительно того, когда следует проводить скрининг РЭ у бессимптомных женщин с утолщенным эндометрием, в отличие от рекомендаций по лечению ПМБ. Для повышения точности диагностики необходимо исследовать идеальное значение отсечения, которое оправдывает дальнейшее исследование эндометрия у бессимптомных женщин в постменопаузе[59], [60],[61].
1.12 Рекомендуемые клинические рекомендации для бессимптомных пациенток в постменопаузе
Нет четкого консенсуса относительно того, какое значение ЭТ следует использовать для рекомендации взятия образцов эндометрия у бессимптомных пациенток в постменопаузе (уровень B).
1.13. Симптоматические женщины
1.13.1. Симптоматические пациенты репродуктивного возраста
У женщин репродуктивного возраста крайне важно проводить БЭ у пациенток с АМК, страдающих ожирением, а также у тех, у кого эндометрий на УЗИ гетерогенный и/или гиперваскуляризированный, из-за повышенного риска малигнизации [62], [63], [ 64],[65]. У пациенток, не страдающих ожирением, несколько исследований предлагают проводить БЭ у пациенток с АМК и/или при наличии одного из следующих состояний: хроническая ановуляторная дисфункция, эстрогенная стимуляция без противодействия, пациентки, которые не отвечают на медикаментозное лечение, или пациентки с генетическим высоким риском рака эндометрия (например, синдром Линча, синдром Коудена)[37,64,[66],[67], [ 68], [69], [70], [71]]. Кроме того, неоплазию эндометрия следует заподозрить у пациенток в пременопаузе с ановуляторным синдромом и длительными периодами аменореи[72,73].
Аналогично, БЭ рекомендуется, если кровотечение частое (интервал между эпизодами кровотечения <21 дня), сильное или длительное (>8 дней). У пациенток с овуляторным синдромом это касается и межменструальных кровотечений [37].
1.13.2. Рекомендуемые рекомендации для симптоматических пациентов репродуктивного возраста
- Молодые женщины с повышенным риском развития злокачественных новообразований эндометрия и гетерогенностью эндометрия должны проходить БЭ (уровень А)
- Передраковые состояния или злокачественные новообразования должны быть исключены у женщин без ожирения с неподтвержденной гиперэстрогенией (уровень В)
- Гистероскопия с БЭ является полезной у женщин с обильными, длительными или межменструальными кровотечениями, даже у тех, кто не имеет сонографических признаков патологии (уровень В).
1.13.3. Симптоматические пациентки в перименопаузе
Несколько исследований показали, что гистероскопия с прицельной биопсией является более чувствительной, чем ЦК для диагностики патологии матки у пациенток с АМК[11,15,26,[74],[75], [76], [77]].
Nicholls-Dempsey и соавт. пересмотрели показания к БЭ в своем центре. Проанализировав 371 пациентку, они пришли к выводу, что у женщин в возрасте до 41 года в 23% биопсий не было показаний для проведения биопсии, что свидетельствует о значительном чрезмерном обследовании. Аналогично, значение БЭ у пациенток в возрасте от 41 до 45 лет с меноррагией и отсутствием дополнительных факторов риска следует дополнительно исследовать [78].
Учитывая возможность кровотечения, вызванного полипом, Ngo и соавт. провели ретроспективный анализ, оценивая различия в гистероскопических результатах между доброкачественными полипами эндометрия и РЭ. Исследование включало гистероскопические находки полипов эндометрия(n = 214) у 3066 женщин, которым проводили гистероскопию по поводу аномальных вагинальных кровотечений, поражений внутриматочной полости, заподозренных при УЗИ, рецидивирующих спонтанных абортов или с целью диагностики бесплодия. Клинические характеристики, такие как гиперваскуляризация поверхности, язвы, гистопатологические и гистероскопические данные оценивались ретроспективно. Анализ показал, что женщины с гистероскопически выявленными полипами эндометрия с гиперваскуляризацией, язвами и полипами с неровной поверхностью имели более высокую вероятность РЭ. В этой специфической популяции следует проводить прицельную биопсию полипов с этими специфическими характеристиками для исключения злокачественности [79].
По данным Clarke и др. [84 ] и De Franciscis и др. [85], офисная гистероскопия является точной для выявления гиперплазии и рака эндометрия. Однако, чтобы повысить точность диагностики, забор материала необходимо проводить на участках эндометрия, которые кажутся аномальными[80,81].
1.13.4. Рекомендуемые клинические рекомендации для пациенток с симптоматической пременопаузой
- БЭ имеет высокую чувствительность для выявления доброкачественных, предраковых и злокачественных внутриматочных патологий (уровень А).
- Гистероскопическая управляемая БЭ имеет более высокую точность, чем слепые методики у женщин с симптомами, независимо от их возраста (уровень А).
1.13.5. Симптоматические пациентки в постменопаузе
На эту популяцию приходится основное количество выполненных БЭ, что связано с самой высокой частотой РЭ и АГ/ЭИН. Bar-On и соавт. провели ретроспективное когортное исследование, включив в него всех женщин, которым была проведена амбулаторная гистероскопия по следующим показаниям: ПМК, подозрение на полип и/или повышение ЭТ. Гистологическую точность оценивали путем сравнения образцов, полученных при гистероскопии, с образцами, полученными при гистерэктомии, а визуальную точность оценивали путем сравнения визуальных результатов с результатами слепых биопсий. Подтверждено, что офисная гистероскопия является адекватным и надежным инструментом для оценки доброкачественной патологии в полости матки [82].
В нескольких исследованиях также сообщалось, что использование трансвагинального УЗИ в качестве скринингового инструмента для оценки женщин, принимавших тамоксифен в анамнезе, не показано для женщин с ПМБ из-за низкой диагностической точности [83], [84], [84], [85], [86]. Напротив, гистероскопия и БЭ являются наиболее надежным методом диагностики [30]. Недавнее исследование отметило отсутствие повышенного риска развития РЭ в этой группе пациенток по сравнению с женщинами, принимающими ингибиторы ароматазы или не получающими лечение [87]. Взвешенная чувствительность эндометриального образца для диагностики РЭ, АГ и патологии эндометрия составляла 90%, 82% и 39% соответственно, когда гистероскопия использовалась в качестве референтного метода. Специфичность составляла 98-100% для всех исследуемых диагнозов и референтного теста. Забор образцов эндометрия не удавался в 11% случаев, а неадекватные образцы были получены в 31% случаев. Передрак эндометрия был обнаружен у 7% женщин с неадекватными или неудачными образцами. Чувствительность биопсии эндометрия для выявления рака эндометрия, в частности АГ и патологии эндометрия, включая полипы эндометрия, ниже, чем считалось ранее, у женщин с ПМБ. После получения доброкачественного результата биопсии эндометрия показано дополнительное диагностическое обследование для выявления локализованной патологии [88]. По сравнению с оценкой рецидивирующих кровотечений, переменные риска РЭ, такие как возраст, могут дать значительную стратификацию риска [89].
1.13.6. Рекомендуемые клинические рекомендации для пациенток с симптоматической постменопаузой
У женщин в постменопаузе с любым типом АМК или РМЖ показана БЭ (уровень А).
Гистероскопическая управляемая БЭ должна быть первым выбором из-за самой высокой точности и экономической эффективности (уровень В).
1.13.7. Рекомендации для будущих исследований
Эти рекомендации были разработаны с целью предоставления краткого и обновленного справочника для практикующих врачей, которые сталкиваются с БЭ в соответствии с наиболее распространенными клиническими сценариями. Однако они не должны рассматриваться как строгие рекомендации и должны быть адаптированы к имеющимся возможностям в каждой конкретной ситуации.
АМК, ПМБ и другие внутриматочные состояния являются частыми гинекологическими жалобами, встречающимися в ежедневной клинической практике. Существуют некоторые области, которые нуждаются в дополнительных высококачественных данных для повышения точности их диагностики и лечения.
Мы предлагаем следующие соображения относительно будущих исследований:
- Провести рандомизированные исследования для оценки влияния наличия полипов эндометрия на рецептивность эндометрия у бесплодных женщин с бессимптомными полипами эндометрия.
- Сравнить различные механические гистероскопические инструменты для проведения БЭ (например, системы извлечения тканей, щипцы 5Fr)
- Провести обширные исследования по оценке границы отсечения ЭТ, чтобы рекомендовать дальнейшее обследование эндометрия у бессимптомных женщин в постменопаузе.
Ссылки на источники
[1]
Papakonstantinou, G. Adonakis
Management of pre-, peri-, and post-menopausal abnormal uterine bleeding: when to perform endometrial sampling?
Int J Gynaecol Obstet (2021)
Google Scholar
[2]
Giampaolino, L. Della Corte, C. Di Filippo, A. Mercorio, S.G. Vitale, G Bifulco
Office hysteroscopy in the management of women with postmenopausal bleeding
Climacteric, 23 (4) (2020), pp. 369-375
View at publisher
CrossRefView in ScopusGoogle Scholar
[3]
F.P. Dijkhuizen, B.W. Mol, H.A. Brolmann, A.P. Heintz
The accuracy of endometrial sampling in the diagnosis of patients with endometrial carcinoma and hyperplasia: a meta-analysis
Cancer, 89 (8) (2000), pp. 1765-1772
Google Scholar
[4]
M.C. Brouwers, K. Kerkvliet, K. Spithoff, A.N.S. Consortium
The AGREE Reporting Checklist: a tool to improve reporting of clinical practice guidelines
BMJ (Clin Res Ed), 352 (2016), p. i1152
View at publisher
CrossRefView in ScopusGoogle Scholar
[5]
Di Spiezio Sardo, S. Bettocchi, M. Spinelli, M. Guida, L. Nappi, S. Angioni, et al.
Review of new office-based hysteroscopic procedures 2003-2009
J Minim Invasive Gynecol, 17 (4) (2010), pp. 436-448
View PDFView articleView in ScopusGoogle Scholar
[6]
M.G. Munro, H.O. Critchley, M.S. Broder, I.S. Fraser, Disorders FWGoM
FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age
Int J Gynaecol Obstet, 113 (1) (2011), pp. 3-13
View PDFView articleCrossRefView in ScopusGoogle Scholar
[7]
S.G. Vitale, G. Riemma, L. Alonso Pacheco, J. Carugno, S. Haimovich, J. Tesarik, et al.
Hysteroscopic endometrial biopsy: from indications to instrumentation and techniques. A call to action
Minim Invasive Ther Allied Technol, 30 (5) (2021), pp. 251-262
View at publisher
CrossRefView in ScopusGoogle Scholar
[8]
Taraboanta, H. Britton, A. Plotkin, N. Azordegan, P.B. Clement, C.B. Gilks
Performance characteristics of endometrial sampling in diagnosis of endometrial carcinoma
Int. J. Gynecol. Pathol., 39 (1) (2020), pp. 19-25
View at publisher
CrossRefView in ScopusGoogle Scholar
[9]
For the Italian School of Minimally Invasive Gynecologica LSHG
Prevalence and predictors of atypical histology in endometrial polyps removed by hysteroscopy: a secondary analysis from the SICMIG hysteroscopy trial
Facts Views Vis. Obgyn., 11 (2) (2019), pp. 127-134
Google Scholar
[10]
Su, L. Huang, K.G. Huang, C.F. Yen, C.M. Han, C.L. Lee
Accuracy of hysteroscopic biopsy, compared to dilation and curettage, as a predictor of final pathology in patients with endometrial cancer
Taiwan J Obstet Gynecol, 54 (6) (2015), pp. 757-760
View PDFView articleView in ScopusGoogle Scholar
[11]
D.M. Larson, K.K. Johnson, S.K. Broste, B.R. Krawisz, J.J. Kresl
Comparison of D&C and office endometrial biopsy in predicting final histopathologic grade in endometrial cancer
Obstet Gynecol, 86 (1) (1995), pp. 38-42
View PDFView articleView in ScopusGoogle Scholar
[12]
Frumovitz, D.K. Singh, L. Meyer, D.H. Smith, I. Wertheim, E. Resnik, et al.
Predictors of final histology in patients with endometrial cancer
Gynecol Oncol, 95 (3) (2004), pp. 463-468
View PDFView articleView in ScopusGoogle Scholar
[13]
Piatek, D. Warzecha, F. Kisielewski, I. Szymusik, G. Panek, M. Wielgos
Pipelle biopsy and dilatation and curettage in clinical practice: are factors affecting their effectiveness the same?
J Obstet Gynaecol Res, 45 (3) (2019), pp. 645-651
View at publisher
CrossRefView in ScopusGoogle Scholar
[14]
G.M. Utida, J. Kulak Jr
Hysteroscopic and aspiration biopsies in the histologic evaluation of the endometrium, a comparative study
Medicine (Baltimore), 98 (40) (2019), p. e17183
View at publisher
CrossRefView in ScopusGoogle Scholar
[15]
F.D. Loffer
The time has come to quit relying on a blind endometrial biopsy or dilation and curettage to rule out malignant endometrial changes
J Minim Invasive Gynecol, 26 (7) (2019), pp. 1207-1208
View PDFView articleView in ScopusGoogle Scholar
[16]
Svirsky, N. Smorgick, U. Rozowski, R. Sagiv, M. Feingold, R. Halperin, et al.
Can we rely on blind endometrial biopsy for detection of focal intrauterine pathology?
Am J Obstet Gynecol, 199 (2) (2008)
115 e1-3
Google Scholar
[17]
L.E. Hann, C.M. Kim, M. Gonen, R. Barakat, P.H. Choi, A.M. Bach
Sonohysterography compared with endometrial biopsy for evaluation of the endometrium in tamoxifen-treated women
J Ultrasound Med, 22 (11) (2003), pp. 1173-1179
View at publisher
CrossRefView in ScopusGoogle Scholar
[18]
Van den Bosch, A. Vandendael, D. Van Schoubroeck, P.A. Wranz, C.J. Lombard
Combining vaginal ultrasonography and office endometrial sampling in the diagnosis of endometrial disease in postmenopausal women
Obstet Gynecol, 85 (3) (1995), pp. 349-352
View PDFView articleCrossRefView in ScopusGoogle Scholar
[19]
Reznak, M. Kudela
Comparison of ultrasound with hysteroscopic and histological findings for intrauterine assessment
Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 162 (3) (2018), pp. 239-242
View at publisher
CrossRefView in ScopusGoogle Scholar
[20]
H.Y. Cheng, B.L. Lin, J.Y. Tseng, K. Ueno, S. Nakada
Clinical application of Lin’s biopsy grasper for intrauterine targeted biopsy and polypectomy during office hysteroscopy
Taiwan J Obstet Gynecol, 57 (3) (2018), pp. 379-382
View PDFView articleView in ScopusGoogle Scholar
[21]
B.H. Bryant, E. Doughty, A.N. Kalof
Selective vs Complete Sampling in Hysterectomy Specimens Performed for Atypical Hyperplasia
Am J Clin Pathol, 152 (5) (2019), pp. 666-674
View at publisher
CrossRefView in ScopusGoogle Scholar
[22]
Agostini, L. Cravello, M.C. Rojat-Habib, J. Amabile-Boulat, V. Roger, F. Bretelle, et al.
[Evaluation of two methods for endometrial sampling during diagnostic hysteroscopy]
J Gynecol Obstet Biol Reprod (Paris), 28 (5) (1999), pp. 433-438
View in ScopusGoogle Scholar
[23]
Bettocchi, R. Di Venere, N. Pansini, M.V. Pansini, A. Pellegrino, S. Santamato, et al.
Endometrial biopsies using small-diameter hysteroscopes and 5F instruments: how can we obtain enough material for a correct histologic diagnosis?
J Am Assoc Gynecol Laparosc, 9 (3) (2002), pp. 290-292
View PDFView articleView in ScopusGoogle Scholar
[24]
G.S. Huang, J.S. Gebb, M.H. Einstein, S. Shahabi, A.P. Novetsky, G.L. Goldberg
Accuracy of preoperative endometrial sampling for the detection of high-grade endometrial tumors
Am J Obstet Gynecol, 196 (3) (2007)
243 e1-5
Google Scholar
[25]
Hirai, K. Sakamoto, H. Fujiwara, M. Kamata, T. Tamura, K. Yanoh, et al.
Liquid-based endometrial cytology using SurePath is not inferior to suction endometrial tissue biopsy for detecting endometrial malignancies: midterm report of a multicentre study advocated by Japan Association of Obstetricians and Gynecologists
Cytopathology, 30 (2) (2019), pp. 223-228
View at publisher
CrossRefView in ScopusGoogle Scholar
[26]
F.D. Loffer
Hysteroscopy with selective endometrial sampling compared with D&C for abnormal uterine bleeding: the value of a negative hysteroscopic view
Obstet Gynecol, 73 (1) (1989), pp. 16-20
View in ScopusGoogle Scholar
[27]
S.G. Vitale, A.S. Laganà, S. Caruso, S. Garzon, G.M. Vecchio, V.L. La Rosa, et al.
Comparison of three biopsy forceps for hysteroscopic endometrial biopsy in postmenopausal patients (HYGREB-1): a multicenter, single-blind randomized clinical trial
Int J Gynaecol Obstet, 155 (3) (2021), pp. 425-432
View at publisher
CrossRefView in ScopusGoogle Scholar
[28]
S.G. Vitale, S. Haimovich, G. Riemma, A. Ludwin, B. Zizolfi, M.C. De Angelis, et al.
Innovations in hysteroscopic surgery: expanding the meaning of “in-office”
Minim Invasive Ther Allied Technol, 30 (3) (2021), pp. 125-132
View at publisher
CrossRefView in ScopusGoogle Scholar
[29]
Ferrari, S. Forte, G. Arrigoni, L. Ardighieri, M.C. Coppola, F. Salinaro, et al.
Impact of endometrial sampling technique and biopsy volume on the diagnostic accuracy of endometrial cancer
Transl Cancer Res, 9 (12) (2020), pp. 7697-7705
View at publisher
CrossRefView in ScopusGoogle Scholar
[30]
Long
Endometrial Biopsy: indications and Technique
Prim Care, 48 (4) (2021), pp. 555-567
View PDFView articleView in ScopusGoogle Scholar
[31]
D.B. Nguyen, V.E.M. Gerber, M.W.H. Suen, T.E. Flaxman, S.S. Singh
Outpatient hysteroscopy is effective for uterine cavity evaluation following failed office-based endometrial biopsy
J Obstet Gynaecol Res (2022)
Google Scholar
[32]
Tumrongkunagon, W. Suknikhom
Histological sampling of endometrial tissue: comparison between the MedGyn(R) endosampler and formal fractional curettage in patients with abnormal uterine bleeding
Asian Pac J Cancer Prev, 20 (11) (2019), pp. 3527-3531
View at publisher
CrossRefView in ScopusGoogle Scholar
[33]
S.G. Vitale
The biopsy snake grasper Sec. VITALE: a new tool for office hysteroscopy
J Minim Invasive Gynecol, 27 (6) (2020), pp. 1414-1416
View PDFView articleView in ScopusGoogle Scholar
[34]
S.G. Vitale, J. Carugno, G. Riemma, P. Torok, S. Cianci, P. De Franciscis, et al.
Hysteroscopy for assessing fallopian tubal obstruction: a systematic review and diagnostic test accuracy meta-analysis
J Minim Invasive Gynecol, 28 (4) (2021), pp. 769-778
View PDFView articleView in ScopusGoogle Scholar
[35]
S.G. Vitale, G. Riemma, M. Ciebiera, S. Cianci
Hysteroscopic treatment of submucosal fibroids in perimenopausal women: when, why, and how?
Climacteric, 23 (4) (2020), pp. 355-359
View at publisher
CrossRefView in ScopusGoogle Scholar
[36]
Luerti, A. Vitagliano, A. Di Spiezio Sardo, S. Angioni, G. Garuti, C. De Angelis, et al.
Effectiveness of hysteroscopic techniques for endometrial polyp removal: the italian multicenter trial
J Minim Invasive Gynecol, 26 (6) (2019), pp. 1169-1176
View PDFView articleView in ScopusGoogle Scholar
[37]
A.K. Makled, M.M. Farghali, D.S. Shenouda
Role of hysteroscopy and endometrial biopsy in women with unexplained infertility
Arch Gynecol Obstet, 289 (1) (2014), pp. 187-192
View at publisher
CrossRefView in ScopusGoogle Scholar
[38]
Buzzaccarini, A. Vitagliano, A. Andrisani, C.M. Santarsiero, R. Cicinelli, C. Nardelli, et al.
Chronic endometritis and altered embryo implantation: a unified pathophysiological theory from a literature systematic review
J Assist Reprod Genet, 37 (12) (2020), pp. 2897-2911
View at publisher
CrossRefView in ScopusGoogle Scholar
[39]
Zargar, M. Ghafourian, R. Nikbakht, V. Mir Hosseini, P Moradi Choghakabodi
Evaluating chronic endometritis in women with recurrent implantation failure and recurrent pregnancy loss by hysteroscopy and immunohistochemistry
J Minim Invasive Gynecol, 27 (1) (2020), pp. 116-121
View PDFView articleView in ScopusGoogle Scholar
[40]
Di Spiezio Sardo, C. Di Carlo, S. Minozzi, M. Spinelli, V. Pistotti, C. Alviggi, et al.
Efficacy of hysteroscopy in improving reproductive outcomes of infertile couples: a systematic review and meta-analysis
Hum Reprod Update, 22 (4) (2016), pp. 479-496
View at publisher
CrossRefView in ScopusGoogle Scholar
[41]
Reyes-Munoz, S.G. Vitale, D. Alvarado-Rosales, E. Iyune-Cojab, A. Vitagliano, F.M. Lohmeyer, et al.
Mullerian anomalies prevalence diagnosed by hysteroscopy and laparoscopy in Mexican infertile women: results from a cohort study
Diagnostics (Basel), 9 (4) (2019)
Google Scholar
[42]
Vitagliano, A. Andrisani, C. Alviggi, S.G. Vitale, G. Valenti, F. Sapia, et al.
Endometrial scratching for infertile women undergoing a first embryo transfer: a systematic review and meta-analysis of published and unpublished data from randomized controlled trials
Fertil Steril, 111 (4) (2019)
734-46 e2
Google Scholar
[43]
G.B. La Sala, R. Montanari, L. Dessanti, C. Cigarini, F Sartori
The role of diagnostic hysteroscopy and endometrial biopsy in assisted reproductive technologies
Fertil Steril, 70 (2) (1998), pp. 378-380
View PDFView articleView in ScopusGoogle Scholar
[44]
R.C. Carlos, R.L. Bree, P.H. Abrahamse, A.M. Fendrick
Cost-effectiveness of saline-assisted hysterosonography and office hysteroscopy in the evaluation of postmenopausal bleeding: a decision analysis
Acad Radiol, 8 (9) (2001), pp. 835-844
View PDFView articleView in ScopusGoogle Scholar
[45]
A.C. de Sa Rosa e de Silva, J.C. Rosa e Silva, F.J. Candido dos Reis, A.A. Nogueira, R.A Ferriani
Routine office hysteroscopy in the investigation of infertile couples before assisted reproduction
J Reprod Med, 50 (7) (2005), pp. 501-506
Google Scholar
[46]
Gavino-Gavino, E. Guzman-Gonzalez, E. Reyes-Munoz, J. Villalpando-Bravo Jde, R.A. Jauregui-Melendez
[Impact of office hysteroscopy in patients with a history of two or more failed cycles of IVF-ET and pre-ICSI in assisted an reproduction center]
Ginecol Obstet Mex, 78 (1) (2010), pp. 9-14
View in ScopusGoogle Scholar
[47]
Gökçe, Y.E. Şükür, B. Özmen, M. Sönmezer, B. Berker, R. Aytaç, et al.
The association between operative hysteroscopy prior to assisted reproductive technology and cervical insufficiency in second trimester
Arch Gynecol Obstet (2020)
Google Scholar
[48]
M.S. Kamath, J. Bosteels, T.M. D’Hooghe, S. Seshadri, S. Weyers, B.W.J. Mol, et al.
Screening hysteroscopy in subfertile women and women undergoing assisted reproduction
Cochrane Database Syst Rev, 4 (2019), Article CD012856
View at publisher
View in ScopusGoogle Scholar
[49]
G.A. Rama Raju, G. Shashi Kumari, K.M. Krishna, G.J. Prakash, K Madan
Assessment of uterine cavity by hysteroscopy in assisted reproduction programme and its influence on pregnancy outcome
Arch Gynecol Obstet, 274 (3) (2006), pp. 160-164
View at publisher
CrossRefView in ScopusGoogle Scholar
[50]
L.R. Bartelink, A. Timmermans, H.A.M. Brölmann, B.W.J. Mol, F.P.H.L.J. Dijkhuizen
Thickened endometrium by ultrasound in an asymptomatic postmenopausal woman: no indication for endometrial diagnosis
Nederlands Tijdschrift Obstet Gynaecol, 118 (7) (2005), pp. 153-156
View in ScopusGoogle Scholar
[51]
Ghoubara, E. Emovon, S. Sundar, A. Ewies
Thickened endometrium in asymptomatic postmenopausal women–determining an optimum threshold for prediction of atypical hyperplasia and cancer
J Obstet Gynaecol (Lahore), 38 (8) (2018), pp. 1146-1149
View at publisher
CrossRefView in ScopusGoogle Scholar
[52]
Hefler, J. Lafleur, S. Kickmaier, H. Leipold, C. Siebenhofer, B. Tringler, et al.
Risk of endometrial cancer in asymptomatic postmenopausal patients with thickened endometrium: data from the FAME-Endo study: an observational register study
Arch. Gynecol. Obstet., 298 (4) (2018), pp. 813-820
View at publisher
CrossRefView in ScopusGoogle Scholar
[53]
Ozelci, B. Dilbaz, F. Akpinar, T. Kinay, E. Baser, O. Aldemir, et al.
The significance of sonographically thickened endometrium in asymptomatic postmenopausal women
Obstet Gynecol Sci, 62 (4) (2019), pp. 273-279
View at publisher
CrossRefView in ScopusGoogle Scholar
[54]
A.O. Famuyide, D.M. Breitkopf, M.R. Hopkins, S.K. Laughlin-Tommaso
Asymptomatic thickened endometrium in postmenopausal women: malignancy risk
J Minim Invasive Gynecol, 21 (5) (2014), pp. 782-786
View PDFView articleView in ScopusGoogle Scholar
[55]
Kurtay, B. Berker, C. Demirel
Transvaginal ultrasonographic assessment of the endometrium in asymptomatic, postmenopausal women using different HRT regimens containing tibolone or estrogen
J Reprod Med Obstet Gynecol, 49 (11) (2004), pp. 893-898
View in ScopusGoogle Scholar
[56]
Li, L. Li, A.S. Tagliafico
Risk of malignancies among asymptomatic postmenopausal women with thickened endometrium: a cohort study
Medicine (United States), 98 (6) (2019)
Google Scholar
[57]
Seckin, M.N. Cicek, A. Ugras Dikmen, E. Isci Bostanci, K.H Muftuoglu
Diagnostic accuracy of ultrasonography for diagnosing endometrial pathologies in postmenopausal women with bleeding or asymptomatic thickened endometrium
Hum Reprod, 30 (2015), p. i
454-i5
Google Scholar
[58]
Trojano, G.R. Damiani, V.C. Casavola, R. Loiacono, A. Malvasi, A. Pellegrino, et al.
The role of hysteroscopy in evaluating postmenopausal asymptomatic women with thickened endometrium
Gynecol Minim Invasive Ther, 7 (1) (2018), pp. 6-9
View in ScopusGoogle Scholar
[59]
R.M. Loiacono, G. Trojano, N. Del Gaudio, A. Kardhashi, M.A. Deliso, G. Falco, et al.
Hysteroscopy as a valid tool for endometrial pathology in patients with postmenopausal bleeding or asymptomatic patients with a thickened endometrium: hysteroscopic and histological results
Gynecol Obstet Invest, 79 (3) (2015), pp. 210-216
View at publisher
CrossRefView in ScopusGoogle Scholar
[60]
Marinella, B. Stefano, C. Annarosa, I. Antonio, D.F. Fabiana, C. Oronzo
Hysteroscopic findings in asymptomatic postmenopausal women with sonographically thickened endometrium: comparison with the histopathologic diagnosis after hysterectomy
Minim. Invasive. Gynecol, 21 (6) (2014), p. S62
View PDFView articleGoogle Scholar
[61]
R.L. McEwing, N.G. Anderson, J.B.A. Meates, R.B. Allen, G.T.M. Phillipson, J.E. Wells
Sonographic appearances of the endometrium after termination of pregnancy in asymptomatic versus symptomatic women
J Ultrasound Med, 28 (5) (2009), pp. 579-586
View at publisher
CrossRefView in ScopusGoogle Scholar
[62]
D.M. Lubian Lopez, F. Orihuela Lopez, L. Garcia-Berbel Molina, P. Boza Novo, E. Pozuelo Solis, D. Menor Almagro, et al.
Endometrial polyps in obese asymptomatic pre and postmenopausal patients with breast cancer: is screening necessary?
Gynecol Oncol, 133 (1) (2014), pp. 56-62
View PDFView articleView in ScopusGoogle Scholar
[63]
J.L. Alcázar, L. Bonilla, J. Marucco, A.I. Padilla, E. Chacón, N. Manzour, et al.
Risk of endometrial cancer and endometrial hyperplasia with atypia in asymptomatic postmenopausal women with endometrial thickness ≥11 mm: a systematic review and meta-analysis
J Clin Ultrasound, 46 (9) (2018), pp. 565-570
View at publisher
CrossRefView in ScopusGoogle Scholar
[64]
Dossus, N. Allen, R. Kaaks, K. Bakken, E. Lund, A. Tjonneland, et al.
Reproductive risk factors and endometrial cancer: the european prospective investigation into cancer and nutrition
Int J Cancer, 127 (2) (2010), pp. 442-451
View at publisher
CrossRefView in ScopusGoogle Scholar
[65]
H.P. Yang, L.S. Cook, E. Weiderpass, H.O. Adami, K.E. Anderson, H. Cai, et al.
Infertility and incident endometrial cancer risk: a pooled analysis from the epidemiology of endometrial cancer consortium (E2C2)
Br J Cancer, 112 (5) (2015), pp. 925-933
View at publisher
CrossRefView in ScopusGoogle Scholar
[66]
Ghaly, R. de Abreu Lourenco, J.A. Abbott
Audit of endometrial biopsy at outpatient hysteroscopy
Aust N Z J Obstet Gynaecol, 48 (2) (2008), pp. 202-206
View in ScopusGoogle Scholar
[67]
D.C. Hunter, N. McClure
Abnormal uterine bleeding: an evaluation endometrial biopsy, vaginal ultrasound and outpatient hysteroscopy
Ulster Med J, 70 (1) (2001), pp. 25-30
View in ScopusGoogle Scholar
[68]
Kremer, S. Duffy
A randomised controlled trial comparing transvaginal ultrasound, outpatient hysteroscopy and endometrial biopsy with inpatient hysteroscopy and curettage
Bjog, 107 (8) (2000), pp. 1058-1059
View in ScopusGoogle Scholar
[69]
Lecuru, M.A. Le Frere Belda, A.S. Bats, L. Tulpin, U. Metzger, S. Olschwang, et al.
Performance of office hysteroscopy and endometrial biopsy for detecting endometrial disease in women at risk of human non-polyposis colon cancer: a prospective study
Int J Gynecol Cancer, 18 (6) (2008), pp. 1326-1331
View at publisher
CrossRefView in ScopusGoogle Scholar
[70]
Mukhopadhayay, S.K. Bhattacharyya, R.P. Ganguly, K.K. Patra, N. Bhattacharya, S.C. Barman
Comparative evaluation of perimenopausal abnormal uterine bleeding by transvaginal sonography, hysteroscopy and endometrial biopsy
J Indian Med Assoc, 105 (11) (2007), p. 624
6, 8 passim
View in ScopusGoogle Scholar
[71]
Ueno, R.M. Salgado, R.B. Tomioka, J.A. Colucci, E. Schor, F.M. Carvalho
Clinical relevance of diagnostic hysteroscopy with concurrent endometrial biopsy in the accurate assessment of intrauterine alterations
Arch Gynecol Obstet, 292 (2) (2015), pp. 363-369
View at publisher
CrossRefView in ScopusGoogle Scholar
[72]
Al-Kubaisi SR
The Relationship between Hysteroscopy, Endometrial Biopsy and The Results of Transvaginal Sonography in Assessing Endometrial Polyps
Sultan Qaboos Univ Med J, 7 (1) (2007), pp. 51-54
Google Scholar
[73]
D.M. Breitkopf, M.R. Hopkins, S.K. Laughlin-Tommaso, D.J. Creedon, A.O. Famuyide
Direct aspiration endometrial biopsy via flexible hysteroscopy
J Minim Invasive Gynecol, 19 (4) (2012), pp. 490-493
View PDFView articleView in ScopusGoogle Scholar
[74]
Marty, J. Amouroux, S. Haouet, J. De Brux
The reliability of endometrial biopsy performed during hysteroscopy
Int J Gynaecol Obstet, 34 (2) (1991), pp. 151-155
View PDFView articleCrossRefView in ScopusGoogle Scholar
[75]
Svirsky, N. Smorgick, U. Rozowski, R. Sagiv, M. Feingold, R. Halperin, et al.
Can we rely on blind endometrial biopsy for detection of focal intrauterine pathology?
Am J Obstet Gynecol, 199 (2) (2008)
115.e1-3
Google Scholar
[76]
Garuti, S. Angioni, L. Mereu, S. Calzolari, L. Mannini, F. Scrimin, et al.
Hysteroscopic view with targeted biopsy in the assessment of endometrial carcinoma. What is the rate of underestimatated diagnosis? The results of a multicenter Italian trial
Gynecol Surg, 17 (1) (2020), p. 10
View at publisher
View in ScopusGoogle Scholar
[77]
Angioni, A. Loddo, F. Milano, B. Piras, L. Minerba, G.B. Melis
Detection of benign intracavitary lesions in postmenopausal women with abnormal uterine bleeding: a prospective comparative study on outpatient hysteroscopy and blind biopsy
J Minim Invasive Gynecol, 15 (1) (2008), pp. 87-91
View PDFView articleView in ScopusGoogle Scholar
[78]
Nicholls-Dempsey, C. Kamga-Ngande, S. Belisle, L. Lapensee, G. Roy, C. Tremblay, et al.
Endometrial biopsy in an outpatient gynaecological setting: overinvestigation
J Obstet Gynaecol Can, 40 (10) (2018), pp. 1309-1314
View PDFView articleView in ScopusGoogle Scholar
[79]
Y.G. Ngo, H.C. Fu, L.C. Chu, C.W. Tseng, C.Y. Chen, C.Y. Lee, et al.
Specific hysteroscopic findings can efficiently distinguish the differences between malignant and benign endometrial polyps
Taiwan J Obstet Gynecol, 59 (1) (2020), pp. 85-90
View PDFView articleView in ScopusGoogle Scholar
[80]
M.A. Clarke, B.J. Long, A. Del Mar Morillo, M. Arbyn, J.N. Bakkum-Gamez, N. Wentzensen
Association of Endometrial Cancer Risk With Postmenopausal Bleeding in Women: a Systematic Review and Meta-analysis
JAMA Intern Med, 178 (9) (2018), pp. 1210-1222
View at publisher
CrossRefGoogle Scholar
[81]
De Franciscis, G. Riemma, A. Schiattarella, L. Cobellis, M. Guadagno, S.G. Vitale, et al.
Concordance between the hysteroscopic diagnosis of endometrial hyperplasia and histopathological examination
Diagnostics (Basel), 9 (4) (2019)
Google Scholar
[82]
Bar-On, A. Ben-David, G. Rattan, D Grisaru
Is outpatient hysteroscopy accurate for the diagnosis of endometrial pathology among perimenopausal and postmenopausal women?
Menopause, 25 (2) (2018), pp. 160-164
View at publisher
CrossRefView in ScopusGoogle Scholar
[83]
Lee, H.S. Kim, J.W. Kim
Ndometrial surveillance in premenopausal breast cancer patients using tamoxifen
J Obstet Gynaecol Res, 43 (12) (2017), p. 1905
Google Scholar
[84]
Lhommé, P. Pautier, L. Zagamé, S. Taïeb, P. Descamps, S. Delaloge, et al.
Endometrial surveillance of women on tamoxifen
Gynecol. Obstet. Fertilite, 31 (7–8) (2003), pp. 647-656
View PDFView articleView in ScopusGoogle Scholar
[85]
H.P. Pokharel, P.K. Pokharel
Evaluation of endometrial changes by TVS and hysteroscopy in patients treated with tamoxifen for breast cancer
Int. J. Gynecological Cancer, 22 (2012), p. E921
Google Scholar
[86]
Suneetha, V. Suri, N. Aggarwal, A. Rajwanshi
Effect of tamoxifen on the endometrium of postmenopausal women with carcinoma of the breast
Bull Postgrad Instit Med Educ Res Chandigarh, 36 (2) (2002), pp. 54-58
View in ScopusGoogle Scholar
[87]
Chiofalo, I. Mazzon, Angelo Di, S. Antonio, D. Amadore, E. Vizza, A.S. Lagana, et al.
Hysteroscopic evaluation of endometrial changes in breast cancer women with or without hormone therapies: results from a large multicenter cohort study
J Minim Invasive Gynecol, 27 (4) (2020), pp. 832-839
View PDFView articleView in ScopusGoogle Scholar
[88]
van Hanegem, M.M. Prins, M.Y. Bongers, B.C. Opmeer, D.S. Sahota, B.W. Mol, et al.
The accuracy of endometrial sampling in women with postmenopausal bleeding: a systematic review and meta-analysis
Eur J Obstet Gynecol Reprod Biol, 197 (2016), pp. 147-155
View PDFView articleView in ScopusGoogle Scholar
[89]
M.A. Clarke, B.J. Long, M.E. Sherman, M.A. Lemens, K.C. Podratz, M.R. Hopkins, et al.
Risk assessment of endometrial cancer and endometrial intraepithelial neoplasia in women with abnormal bleeding and implications for clinical management algorithms
Am J Obstet Gynecol, 223 (4) (2020)