АВТОРИ: Tadashi Sekimotoa, Hitoshi Maruyamaa,а, Takayuki Kondo a, Taro Shimada a, Masanori Takahashi a, Osamu Yokosukaa, Masayuki Otsuka b, Masaru Miyazaki b, Yoshitaka Mine c
а – відділення медицини і клінічної онкології, медичний університет Чіба, Японія
б – відділення загальної хірургії, медичний університет Чіба, Японія
з – Toshiba Medical Systems Corporation, відділення ультразвукових систем, відділення розвитку ультразвукових систем, Японія
Ключові слова: цироз, печінка, ультразвук, тривимірна візуалізація, лапароскопія, 3Д, Fly Thru
РЕЗЮМЕ
Мета: вивчити потенційну ефективність 3D-реконструйованих сонограм для диференціальної діагностики печінки з циротичними змінами, шляхом візуалізації особливостей поверхні печінки.
Матеріали і методи: було проведено попереднє дослідження на фантомі з метою вивчення можливої роздільної здатності 3D-зображень, розпізнавання нерівностей поверхні, як різницю її висоти. У проспективному клінічному дослідженні 31 пацієнта з асцитом (21 з цирозом, 10 – без цирозу), були отримані дані про об’єми печінки шляхом трансабдомінального механічного сканування. Особливості поверхні печінки пацієнтів з цирозом і без цирозу порівнювалися 2 незалежними експертами. Також було вивчено внутрішньо- і міждослідницьке узгодження.
Результати: дослідження фантома показало, що показник в 0,4 мм був мінімальною різницею у висоті на 3D сонограмі. Зображення поверхні печінки було успішно отримано у 74% пацієнтів (23/31). Успіх залежав від кількості асцитичної рідини; візуалізація була 100% у пацієнтів з асцитом 10 мм або більше між печінкової поверхнею і передньою черевною стінкою. Зображення показали нерівномірність печінкової поверхні у всіх пацієнтів з цирозом. Зовнішній вигляд поверхні печінки був розцінений як дуже схожий у 3 пацієнтів, які мали як 3D-ультразвукове дослідження, так і резекцію печінки для трансплантації. Здатність розрізняти цироз печінки від печінки без цирозу був вдосконалений з використанням комбінації 2D- і 3D-візуалізації, в порівнянні з тільки одними 2D-зображеннями (чутливість – р = 0,02; точність – р = 0,02) або 3D-візуалізацією (чутливість – р = 0,03). Отримано відмінне внутрішньо- і міждослідницьке узгодження (к = 1,0).
Висновок: 3D сонографічна візуалізація печінкової поверхні показала високу надійність і відтворюваність, може використовуватися в якості методу віртуальної лапароскопії. Дана техніка має великий потенціал для поліпшення якості діагностики цирозу печінки.
Введення
Цироз печінки пов’язаний з широким спектром етіологічних чинників і є останньою стадією захворювання печінки. Це має серйозні наслідки для пацієнтів, так як призводить до гепатоцелюлярної карциноми, портальної гіпертензії та печінкової недостатності. З огляду на поступове прогресування захворювання печінки, починаючи з хронічного гепатиту, діагноз цирозу печінки повинен бути точно поставлений для того, щоб забезпечити належне лікування захворювання.
Біопсія печінки залишається золотим стандартом оцінки ступеня фіброзу печінки. Проте, виконання біопсії може бути проблематичним в таких випадках, так як вона є інвазивним методом, а це особливо небезпечно для пацієнтів з порушенням коагуляції через прогресуюче захворювання печінки. Крім того, методика схильна до можливої помилки вибірки через гетерогенно поширений фіброз печінки.
В останнє десятиліття, різні дослідники намагалися визначити стадію захворювання печінки з використанням неінвазивних маркерів, деякі з яких показали істотну кореляцію зі ступенем фіброзу печінки. Однак, морфологічні особливості печінки безпосередньо відображають стадію захворювання печінки, і, отже, лапароскопія є корисним інструментом для діагностики захворювань печінки. Пряма діагностична лапароскопія рідко виконується через її інвазивність. Проте, аналіз печінкової структури поверхні дає корисну інформацію для класифікації та характеристики захворювань печінки.
Ми припустили, що спроектоване зображення, створене з трансабдомінальних сонографічних об’ємних даних, отриманих за допомогою дослідження гіпоехогенної зони (асцит), дозволить візуалізувати поверхню печінкової структури. Метою даного дослідження було вивчити потенційну ефективність 3-мірних (3D) реконструйованих сонограм для відмінності між циротичною і нециротичною печінкою, на основі зовнішнього вигляду печінкової поверхні.
Методи
2.1. Пацієнти
Це проспективне дослідження було схвалено етичним комітетом лікарні університету Чіба та виконано в період з серпня 2011 року по квітень 2012 року. Пацієнти з асцитом були потенційними кандидатами для даного дослідження, оскільки наявність асциту може забезпечити віртуальну позначку для оцінки особливостей печінкової поверхні на сонограмі. Вони були відібрані з пацієнтів з асцитом, виявлених за допомогою ультразвукового дослідження (УЗД) під час планових оглядів у нашому відділенні. Пацієнти були виключені з дослідження, якщо вони: (I) мали вогнищеві ураження печінки на сонограмі, або (II) не могли затримувати дихання протягом декількох секунд.
2.2. Ультразвукова система
APLIO 500 Ультразвукова система (Toshiba, Токіо, Японія) була використана для роботи з зображеннями. Сканування в правому міжребер’ї було виконано для всіх пацієнтів для отримання зображень в положенні лежачи на спині. Спочатку вибиралася найкраща позиція для сканування за допомогою звичайного 2-мірного (2D) УЗД, а потім вимірювалася відстань між черевною стінкою і печінкової поверхнею, як показник кількості асцитичної рідини. Потім настройка змінювалася для 3D візуалізації (Fly Thru режим, Toshiba, Токіо, Японія). Ми використовували PVT675MV (6,0 МГц), спеціалізований датчик для 3D сканування, з механічною системою сканування автоматичної розгортки. Область інтересу була встановлена таким чином, щоб захопити поверхню печінки, а центр фокусу був встановлений на середній глибині між самим поверхневим і найглибшим рівнем поверхні. Об’ємні 3D зображення були отримані шляхом автоматичного сканування з максимальним кутом огляду 75◦. До отримання зображення, пацієнти були проінструктовані затримувати дихання протягом приблизно 4-6 секунд. Отримані об’ємні зображення були одразу ж збережені на жорсткий диск ультразвукової системи.
Оператор дослідження HM – гепатолог з більш, ніж 20-річним досвідом роботи в ультразвукової діагностики, і TS – гепатолог з більш, ніж 6-річним досвідом роботи в ультразвукової діагностики. Три комплекти 3D зображення були отримані для кожного пацієнта у кожного оператора.
2.3. Експеримент з фантомом і його оцінка
Даний експеримент був проведений з метою вивчення можливостей роздільної здатності реконструйованих 3D зображень в розпізнаванні відмінності висоти в кожному зображенні (рис. 1). Одна або кілька пластикових пластин (9 см2 площею, товщиною 0,2 мм) були розміщені на дні бака заповненого водою: 1 пластина – 0,2 мм висотою, 2 пластини – 0,4 мм висотою, 3 пластини – 0,6 мм висотою, 4 пластини – 0, 8 мм висотою, і 5 пластин – 1,0 мм висотою. Датчик був також поміщений в резервуар з водою для отримання 3D-зображення над пластиковими пластинами, з такими ж налаштуваннями апарату, які використовуються у пацієнтів. Відстань між датчиком і пластиною було 3 см. Три експерти оцінювали реконструйовані зображення, з метою визначення наявності відмінностей у висоті.
2.4. Об’єктивна оцінка характеристики печінкової поверхні
Для кожного пацієнта були обрані 2 репрезентативних зображення, які показували зовнішній вигляд поверхні печінки; 1 з 2D-зображень, а інше з 3D реконструйованих зображень. Відбір здійснюється оператором (HM) для сліпої оцінки даних печінкової поверхні. Два експерта (TS і OY) ставили діагноз цирозу/відсутність цирозу на підставі 2D або 3D сонограм.
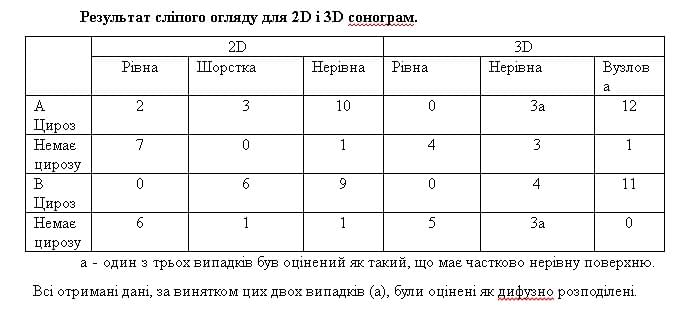
Результати оцінки поверхні печінки на 2D-зображеннях оцінювалися за трьома ознаками: рівна поверхня, шорстка поверхня або нерівна поверхня. Цироз діагностували при наявності нерівної поверхні, а відсутність цирозу на підставі рівної/шорсткої поверхні. У той же час, на 3D-зображення, були застосовані наступні дві категорії: (I) рівна поверхня, шорстка поверхня або вузлова картина при характеристиці поверхні, (II) частковий або дифузний розподіл ознак при характеристиці поверхні. Цироз діагностували при вузловій картині і дифузному розподілі, а відсутність цирозу при інших характеристиках. Потім оцінювали діагностичну ефективність 2D-, 3D- і поєднання 2D і 3D візуалізації.
Після цього були оцінені внутрішньо- і міждослідницькі узгодження з використанням 4 зображень: 1 пара зображень (група А), отримана тим же оператором і 1 пара зображень (група В), отримана іншими операторами. Відбір проводився HM для того, щоб забезпечити репрезентативними зображення з точки зору кута зору, яскравості і контрастності. Якщо було більше, ніж два зображення, які були адекватними для огляду, два з них вибиралися випадковим чином. Ці узгодження були оцінені двома рецензентами (TS і OY), які не мали інформації про пацієнта. Кожен з них вибирав пари зображень незалежно один від одного, з групи А для внутрішньодослідницького узгодження і з групи B для міждослідницького узгодження. Якщо пари зображень були відібрані правильно, то це оцінювалося як позитивне узгодження.
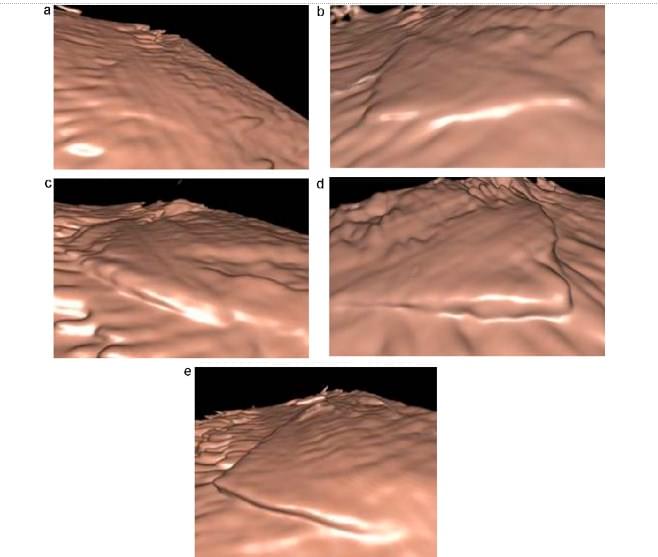
Рис. 1. Схема для експерименту на фантомі. Одна або кілька пластикових пластин (9 см2 площею, товщиною 0,2 мм) були розміщені на дні бака заповненого водою: 1 пластина – 0,2 мм висотою, 2 пластини – 0,4 мм висотою, 3 пластини – 0,6 мм висотою, 4 пластини – 0, 8 мм висотою, і 5 пластин – 1,0 мм висотою. Датчик був також поміщений в резервуар з водою для отримання 3D-зображення над пластиковими пластинами, з такими ж даним приладу, які використовуються у пацієнтів. Відстань між датчиком і пластиною була 3 см.
2.5. Статистичний аналіз
Всі дані представлені як середнє значення ± стандартне відхилення (SD) або у відсотках. Чутливість, специфічність і точність діагностики цирозу печінки були отримані за допомогою формул: істинно позитивний/(істинно позитивний + помилково негативний результат), істинний негативний/(помилково позитивний + істинно негативний) і (істинно позитивний + істинно негативний)/загальне число, відповідно. Внутрішньодослідницьке узгодження і міждослідницьке узгодження були оцінені шляхом розрахунку каппа значення. Ступені узгодження були визначені як <0,2 для поганого, 0,2-0,4 для помірного, 0,4-0,6 достатнього, 0,6-0,8 для хорошого і 0,8-1,0 для відмінного. Статистичну значимість визначали за допомогою тесту хі-квадрат з порогом р <0,05. Статистичний аналіз проводили з використанням програмного забезпечення SPSS (версія 13.0J, SPSS Inc., Чикаго, Іллінойс, США).
Результати
3.1. Експеримент з фантомом
Всі 3 експерта прийшли до висновку, що реконструйовані 3D сонограми поверхонь, отримані за допомогою Fly Thru, наочно відображали різницю в висоті на зображеннях при висоті 0.4мм (1 таблиця, рис. 2).
Таблиця 1
Рис. 2. Експеримент на фантомі для визначення потенційної роздільної здатності 3D-реконструйованих сонограм для розпізнавання різниці в висоті на зображенні з пластиковими пластинами. (А) Одна пластина для висоти 0.2мм. (В) 2 пластини для висоти 0.4мм. (С) 3 пластини для висоти 0.6мм. (D) 4 пластини для висоти 0.8мм. (Е) 5 пластин для висоти 1.0мм. Всі 3 рецензенти прийшли до висновку, що 3D-реконструйовані зображення поверхні, отримані за допомогою Fly Thru, наочно продемонстрували різницю в висоті на зображеннях з висотою 0.4мм.
3.2. Характеристики пацієнтів
У дослідження включено 31 пацієнт з асцитом, 21 пацієнт з цирозом (віковий діапазон – 41-81 років, середнє ± стандартне відхилення – 60 ± 11; 15 чоловіків і 6 жінок) і 10 пацієнтів без цирозу (віковий діапазон – 28- 81 рік, середнє ± стандартне відхилення – 65 ± 14; 9 чоловіків і 1 жінка). Цироз був діагностований як в результаті аналізу зображень, так і біохімічних результатів, у 17 пацієнтів з використанням зразків, отриманих за допомогою трансюгулярної голкової біопсії, або під час трансплантації – у 4 хворих. Етіологія цирозу була наступна: гепатит В – 3 випадках, вірус гепатиту С – у 14 випадках, зловживання алкоголем – в 2-х випадках і криптогенна – в 2-х випадках. Причини асциту у 10 пацієнтів без цирозу були: карциноматозний перитоніт в 3-х випадках, важка гіпоальбумінемія внаслідок хвороби Ворона Fukase – в 1 випадку, первинний біліарний цироз печінки (Шойер II за даними біопсії печінки) – в 1 випадку, ідіопатична тромбоцитопенічна пурпура – в 1, застійна печінка – в 1, неходжкінська лімфома – в 1 випадку та невідома патологія – в 2-х випадках. У цих 10 пацієнтів було виключено цироз на підставі як візуалізації, так і біохімічних досліджень. Всі суб’єкти в дослідженні мали трансудативний асцит, а відстань між черевною стінкою і печінковою поверхнею через асцит була 2-50 мм (21 ± 14), як було визначено по сонограмам, отриманим при скануванні в правому міжребер’ї.
3.3. Зображення поверхні печінки
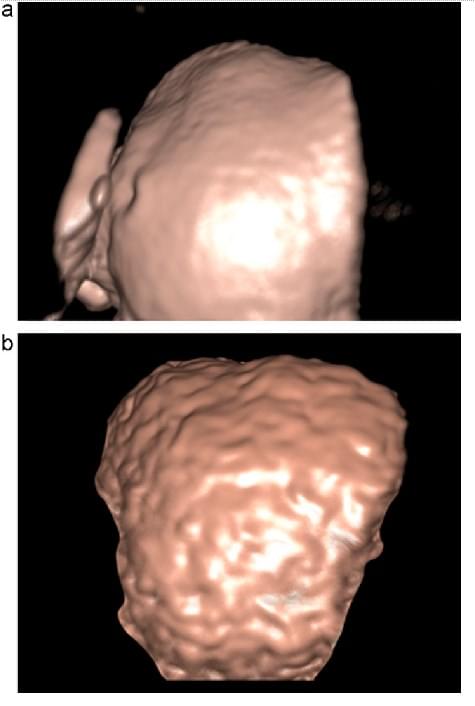
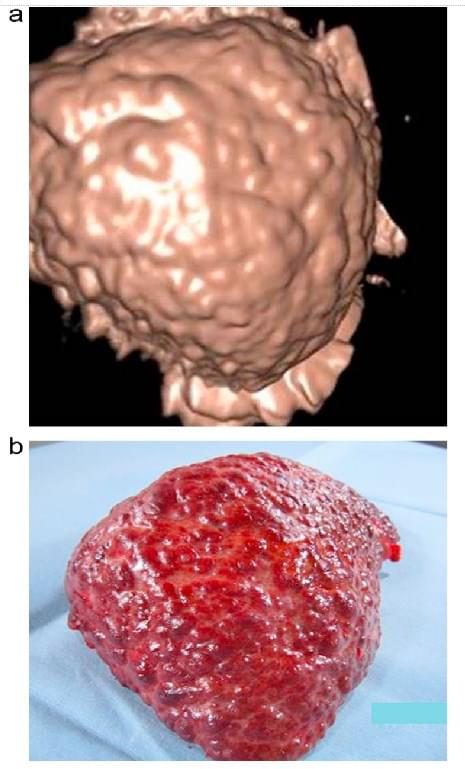
3D-реконструкція печінкової поверхні була успішно виконана у 74% пацієнтів (23/31); 71% (15/21) пацієнтів з цирозом і 80% (8/10) хворих без цирозу. Успіх залежав від кількості асцитичної рідини. 100% візуалізація була досягнута у пацієнтів з асцитом більше 10 мм між печінковою поверхнею і передньою черевною стінкою. Зображення печінки показали виразні порушення печінкової поверхні у всіх пацієнтів з цирозом (рис. 3). Зовнішній вигляд поверхні печінки був розцінений як дуже схожий у 3 пацієнтів, яким виконана 3D сонографія до трансплантації печінки, потім проведена резекція для трансплантації (рис. 4).
Рис. 3. Зображення поверхні печінки за 3D-реконструйованими об’ємними даними. (А) Печінка без цирозу. 68-річна жінка з карциноматозним перитонітом. Зображення показує гладку поверхню (В) циротичної печінки. 49-річна жінка з гепатитом С з виходом в цироз печінки. Зображення показало видиму нерівність поверхні печінки з вузлуватою картиною.
Рис. 4. Порівняння зовнішнього вигляду печінкової поверхні між 3D-зображенням (а) і резекованою печінкою (в). Два зображення показали досить схожу картину на поверхні печінки.
Діагностичні можливості між 2D, 3D і їх комбінація були зрівняні на підставі оцінки результатів (таблиця 2). Чутливість, специфічність і точність для диференціальної діагностики циротичної від нециротичної печінки, отримані двома рецензентами, були (А/В) 66,7/60%, 87,5/87,5%, і 73,9/70% для 2D-зображення, 80/73,3%, 87,5/100%, і 82,6/82,6% для 3D зображень, і 93,3/100%, 87,5/87,5%, і 91,3/95, 7% для комбінованих зображень відповідно (таблиця 3).
Таблиця 2
Таблиця 3
Можливості відрізняти циротичну та нециротичну печінку були значно вищі з використанням комбінації 2D- і 3D-візуалізації, ніж тільки за допомогою 2D-зображень у експерта В (р = Чутливість 0,02; р = точність 0,02), а також при використанні комбінації в порівнянні тільки з 3D-візуалізацією у експерта в (р = Чутливість 0,03). Внутрішньо-, міждослідницьке і міжекспертне узгодження було відмінним (к = 1,0).
Обговорення
Діагностування цирозу печінки залишається складним завданням для лікарів, незважаючи на появу різних неінвазивних маркерів. Наскільки нам відомо, це перше дослідження, яке повідомляє про успішну демонстрацію особливостей печінкових поверхонь за допомогою неінвазивного методу візуалізації. Обидві ознаки: нерівність печінкової поверхні і округлі краї чітко візуалізуються на 3D сонограмі, дана техніка має високу роздільну здатність, надійність і відтворюваність. Цей механізм візуалізації являє собою «віртуальну лапароскопію» для постановки точного діагнозу цирозу печінки.
“Fly Thru” є новою технологією, що стало можливим завдяки появі передових можливостей обробки зображень, на основі проективної візуалізації, яка генерується з сонографічних об’ємних даних. Методика була спочатку розроблена для ендолюмінальної 3D реконструкції, для візуалізації імітації внутрішньопросвітної картини шлунково-кишкового тракту або жовчних проток з ендоскопічно подібним ефектом. Однак в цьому дослідженні ми застосували цю техніку для оцінки печінкової поверхні. Першим кроком стало отримання об’ємних даних шляхом механічного автоматичного сканування при максимальному куті 75◦, який був досить широким для того, щоб охопити більшу частину правої частки. Використання 3D-даних, інтенсивність сигналів була інтегрована в межах прямої видимості на площину проекції з регулюванням коефіцієнта. Застосування певного порогового рівня забезпечує зображення поверхні мішені в точці спостереження. Фільмоподібна картина печінкової поверхні, яка нагадує політ над печінкою, була просто отримана за допомогою цієї простої процедури.
Об’єктивне судження екпертів показало, що наша методика може визначати різницю по висоті в 0,4 мм на зображеннях в експерименті на фантомі. Цей результат вказує на потенційно високу роздільну здатність зображень з 3D-реконструкцією. Крім того, в клінічних дослідженнях, ми показали, що додавання 3D-зображень може істотно поліпшити діагностичну спроможність діагностувати цироз печінки. На звичайних 2D-сонограмах зображення представляються як в розрізі, поверхнева структура печінки проявляється у вигляді лінійного зображення, а не площинної картини. 3D візуалізація може мати наочні переваги в порівнянні з 2D-зображеннями в отриманні зрозумілих для лікаря зображень.
Очевидно, що наявність асциту не завжди є симптомом цирозу, тому необхідне проведення диференціальної діагностики цирозу печінки від інших захворювань, а саме таких хвороб печінки як: нециротична портальна гіпертензія, ідіопатична портальна гіпертензія і вроджений фіброз печінки; не печінкових захворювань, таких як: серцева недостатність, ниркова недостатність і перитоніт. На цьому етапі оцінка зображень поверхні печінки залежить від кількості асцитичної рідини; мінімальна відстань – 10 мм від черевної стінки до печінки необхідно для успішної візуалізації печінкової поверхні. Технологічні удосконалення для підвищення ефективності дослідження у пацієнтів з меншою кількістю асциту, як очікується, допоможуть розширити застосування цього методу візуалізації.
Останнім часом використовуються кілька неінвазивних методів, в тому числі сироваткові маркери і методи візуалізації, для оцінки ступеня фіброзу печінки. Діагностична ефективність, показана під площею кривої робочої характеристики для цирозу печінки була 0,998 – для магнітно-резонансної еластографії, 0.9931 – для багаточастотної магнітно-резонансної еластографії, 0,94 – для вимірювання жорсткості печінки, 0820 – для APRI, 0,92 – для FibroTest, 0,91 – для FIB4, 0,89 – для Hepascore і 0,97 – для контрастної ультрасонографії. Незважаючи на поточну популярність цих маркерів, кожен з них може мати недоліки, наприклад: діагностичні можливості сироваткових маркерів розрізняються і їх дані не завжди є достатніми, контрастна ультрасонографія вимагає введення контрастного агента, транзиторна еластографія від FibroScan (Echosens, Париж, Франція) не підходить для пацієнтів з асцитом, а великогабаритне обладнання для магнітно-резонансної томографії обмежує його доступність. На відміну від цього, наша методика має ту перевагу, що вона є простою і легкою процедурою через свою візуальну природу, і, таким чином, має потенціал в майбутньому.
Існують деякі обмеження нашого дослідження. По-перше, візуальна картина може продемонструвати лише нерівності печінкової поверхні без надання даних про інтенсивність і, таким чином, не в змозі виявити вогнищеві ураження печінки. Додавання такої інформації може підвищити діагностичну ефективність методу. По-друге, вимірювання на 3D-зображеннях не доступні в поточній версії. Цей параметр вимагає поліпшення для того, щоб оцінювати печінкову поверхню кількісно і диференціювати ступінь фіброзу печінки.
На закінчення, ми показали можливість використання 3D-сонограм для візуалізації печінкових поверхневих структур з достатнім ступенем надійності і відтворюваності. Це доступний і неінвазивний метод візуалізації “Fly Thru”, який має високий візуальний потенціал, служить в якості методу віртуальної лапароскопії і може в значній мірі впливати на діагностику цирозу печінки.








14.10.2019
Юлія