АВТОРИ: Christoph F. Dietrich 1, 2, Jeffrey Bamber 3, Annalisa Berzigotti 4, Simona Bota 5, Vito Cantisani 6, Laurent Castera 7, David Cosgrove 8, Giovanna Ferraioli 9, Mireen Friedrich-Rust 10, Odd Helge Gilja 11, Ruediger Stephan Goertz 12, Thomas Karlas 13, Robert de Knegt 14, Victor de Ledinghen 15, Fabio Piscaglia 16, Bogdan Procopet 17, Adrian Saftoiu 18, Paul S. Sidhu 19, Ioan Sporea 20, Maja Thiele 21
1.Відділення внутрішньої медицини 2, госпіталь Caritas, Бад Мергентхайм, Німеччина
2.Китайсько-німецький науковий центр ультразвукового дослідження в медицині, Перша госпітальна філія університету Чженчжоу, Чженчжоу, Китай
3.Об’єднаний відділ фізики і Центр візуалізації раку CRUK, Інститут онкологічних досліджень і Королівський фонд Marsden NHS Foundation Trust, Лондон, Великобританія
4.Відділення гепатології, Університетська клініка вісцеральної хірургії та медицини, Бернський університет, Берн, Швейцарія
5.Кафедра гастроентерології, гепатології, нефрології та ендокринології, клініка Klagenfurt, Клагенфурт-на-Вертензеє, Австрія
6.Відділення радіологічних наук, поліклініка Umberto I, Університет Sapienza, Рим, Італія
7.Відділення гепатології, госпіталь Beaujon, університет Paris VII, Франція
8.Відділення візуалізуючої діагностики, Імператорський і Королівський коледжі, Лондон, Великобританія
9.Відділення інфекційних захворювань, університет Pavia, Павія, Італія
10.Відділення внутрішньої медицини 1, Університетський госпіталь J. W.Goethe, Франкфурт, Німеччина
11.Національний центр ультразвукових досліджень в гастроентерології, Університетський госпіталь Haukeland, кафедра клінічної медицини Університету Бергена, Норвегія
12.Відділення внутрішньої медицини 1 – Гастроентерологія, пульмонологія і ендокринологія, Університет ErlangenNürnberg, Ерланген, Німеччина
13.Відділення гастроентерології та ревматології, Університетський госпіталь Лейпцига, Лейпциг, Німеччина
14.Відділення гастроентерології та гепатології, університетського медичного центру Erasmus MC, Роттердам, Нідерланди
15.Центр неінвазивної діагностики фіброзу печінки, госпіталь HautLeveque, університетська лікарня Bordeaux, Пессак, Франція
16.Відділення внутрішньої медицина, відділення медичної та хірургічної науки, університетський госпіталь Bologna S. Orsola-Malpighi, Болонья, Італія
17.Відділення гастроентерології, 3-ї Клінічної лікарні Університету медицини і фармації “Iuliu Hatieganu” Регіональний інститут гастроентерології та гепатології ” O. Fodor” Клуж-Напока, Румунія
18.Дослідницький центр гастроентерології та гепатології Крайова, Університет медицини і фармації Крайова, Румунія
19.Королівський коледж Лондона, відділення радіології, лікарня King’s College, Лондон
20.Кафедра гастроентерології та гепатології, університет медицини і фармації ” Victor Babes” Тімішоара, Румунія
21.Кафедра гастроентерології та гепатології, університетський госпіталь Odense, Університет Південної Данії, Оденсе, Данія.
Ключові слова: посібник, печінка, фіброз, хронічні захворювання печінки, гепатит, хронічний вірусний гепатит, зсувнохвильова еластографія, компресійна еластографія, алкогольний гепатит, НАЖХП.
Резюме
Ми представляємо тут перше оновлення посібника EFSUMB (Європейська федерація товариств з ультразвуку в медицині та біології – European Federation of Societies for Ultrasound in Medicine and Biology) і рекомендації з клінічного застосування еластографії, орієнтовані на оцінку дифузних захворювань печінки. Перша частина (розширена версія) цього «Посібника і Рекомендацій» присвячена основним принципам еластографії і містить оновлену інформацію про те, як змінювалася технологія. Описуються практичні переваги та недоліки, пов’язані з кожним з методів, а також даються рекомендації щодо оптимізації техніки сканування, відображення зображення, інтерпретації зображень, представлення даних і деяких відомих артефактів зображення. Друга частина містить клінічну інформацію про практичне використання еластографічного обладнання та інтерпретації результатів оцінки дифузних захворювань печінки, а також аналізує основні результати, засновані на опублікованих дослідженнях, спираючись на дані метааналізів. Також обговорюється роль еластографії при різній етіології захворювання печінки і в декількох клінічних сценаріях. Всі рекомендації оцінюються з урахуванням їх доказової сили відповідно до рівнів доказовості Оксфордського центру доказової медицини. Цей оновлений документ покликаний служити довідковим матеріалом і практичним посібником для початківців і просунутих клінічних користувачів.
Основні принципи та технологія
Вступ
У цьому посібнику, термін еластограма відноситься до будь-якого зображення будь-якої еластичної властивості тканини. У цій статті також описуються невізуальні вимірювання таких характеристик в певних зонах. Вони називаються точковими еластографічними методами. З іншого боку, еластометрія – це вимірювання еластичних характеристик тканини, яке може бути отримано або за допомогою методів візуалізації, або без візуалізації.
Основні принципи еластографії не змінилися з того часу, коли вони були викладені в першій частині оригінальних посібників EFSUMB і рекомендацій WFUMB з цього питання [1, 2]. Таким чином, цей документ покликаний забезпечити оновленою інформацією про технологічні зміни з 2017 року в цій області, що швидко розвивається. Представлені достатньо короткі висновки, що дозволяють зрозуміти цей документ без посилання на більш ранні дані, хоча мета полягає не в тому, щоб детально відтворити матеріал документа 2013 року.
Основні принципи еластографії
Ми рекомендуємо розглядати еластографію, як тип віддаленої пальпації, яка дозволяє вимірювати і відображати біомеханічні властивості тканин організму. Ці властивості пов’язані з пружними силами в тканинах, які відновлюють їх форму чи об’єм після стискання і які протидіють зсувній деформації*. Це уявлення об’єднує різні типи еластографії і пояснює, чому вони всі відображають зображення контрастно, бо базуються на одній і тій же самій інформації, пов’язаній з модулем зсувної жорсткості, який описаний нижче. Це докладно пояснено в [1], поряд з різними типами зсувної деформації. Зсувна деформація створюється силою, яка додається або до точкової локалізації або широко, через поверхню тіла. Важливо відзначити, що перехідні зсувні деформації будуть поширюватися як поперечні хвилі, що обговорюється нижче.
Сила може бути прикладена шляхом натискання або вібрації на поверхню тіла, або за допомогою природного фізіологічного руху, або електроннокерованим ультразвуковим датчиком для створення сфокусованої акустичної радіаційної сили (acoustic radiation force –ARF) на контрольованій глибині. Акустична радіаційна сила пропорційна усередненій за часом інтенсивності I звукового проміню в місці поштовху і амплітудному коефіцієнту поглинання α в місці поштовху, зворотньо пропорційна швидкості звуку cι в місці поштовху, і збільшується з кожним відбиттям або розсіюванням звуку в зоні поштовху. При відсутності відбиття або розсіювання, величина радіаційної сили, що діє в кожній точці об’єму середовища, дорівнює F = 2αI/cι [3]. Усі ультразвукові промені генерують таку силу, але сила, інтегрована по тривалості діагностичного імпульсу (< 2 мкс), занадто невелика, щоб генерувати зміщення, що придатні для вимірювання. В променях, що призначені для створення акустичною радіаційноюї силою придатного для вимірювання зcуву, використовують навмисно довші імпульси (50-1000 мкс). Це створює зсуви тканини на мікронному рівні.
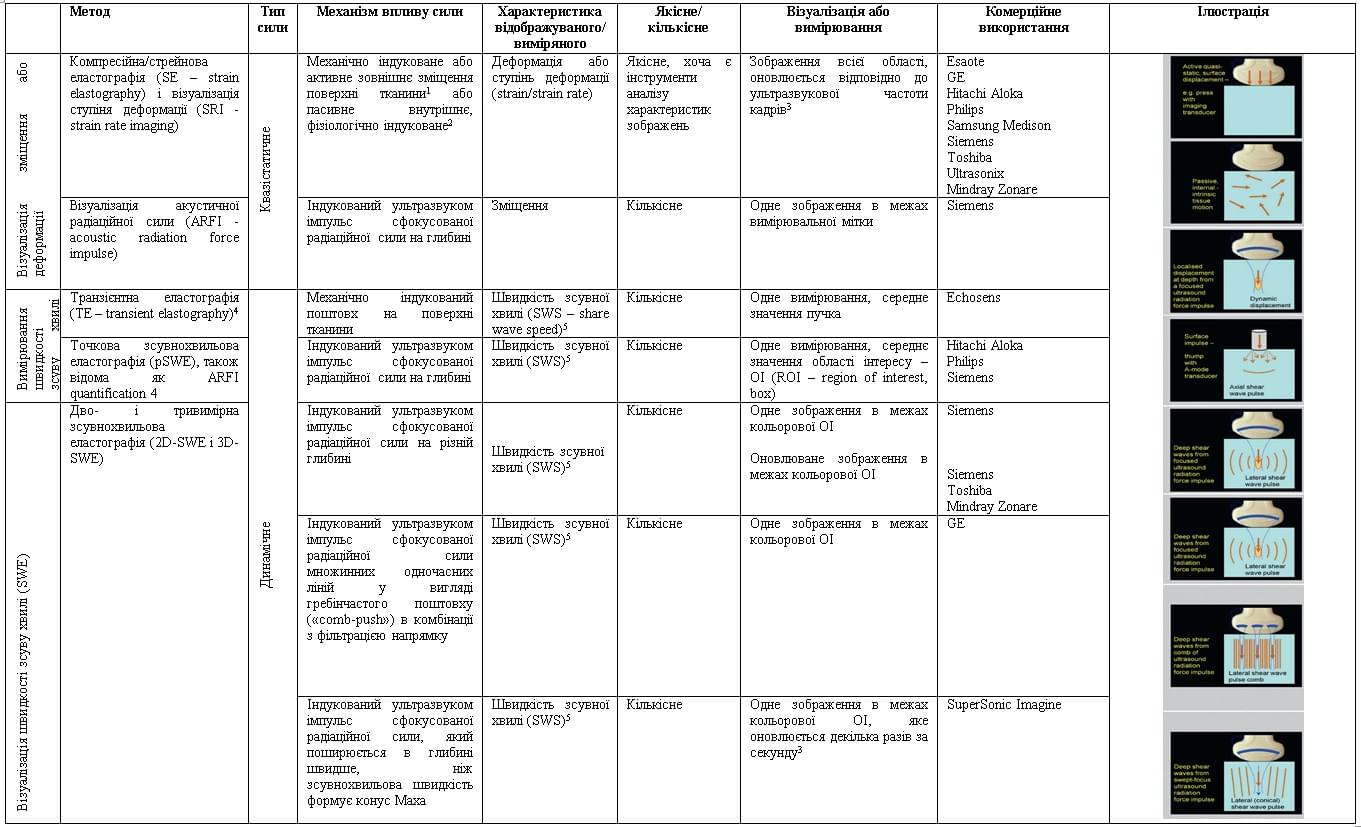
Всі доступні методи ультразвукової еластографії (рис.1) використовують ультразвук для вимірювання зсувних деформацій внутрішніх тканин, що виникають в результаті прикладеної сили. Важливим є тип сили (рис 1, стовпець 2). Якщо сила змінюється повільно відносно часу поширення зсуву до необхідної глибини, як це має місце при компресії датчиком або фізіологічному русі тканин, вона вважається квазістатичною. Важко отримати зображення, які відображали б кількісно властивість тканини з використанням квазістатичної прикладеної сили, хоча можлива кількісна оцінка відносно еталонної тканини або матеріалу фантому.
Рис.1. Типи еластографії, які описані в цій статті:
1 – пальпація на поверхні тіла.
2 – кардіоваскулярна або дихальна пульсація (фізіологічно індуковані зміщення тканин).
3 – терміну «реальний час/real time» ми уникаємо, щодо еластографії в реальному часі, так як еластографічні системи, які описуються в цій статті, не підходять ні для швидкого дослідження великих об’ємів, ні для швидкого огляду руху тканини на серії еластограм.
4 – Термін зсувнохвильова еластографія (SWE – share wave elastogrsphy) використовується згідно з даними літератури, і який відноситься до методів, які генерують зображення за допомогою імпульсу сфокусованої акустичної радіаційної сили. Це включає 3D-SWE і 2D -SWE. Точкова зсувнохвильова еластографія (pSWE) характеризується визначенням точкової середньої (без картинки) швидкості зсуву хвилі за рахунок променевого силового імпульсу. ТЕ – транзієнтна еластографія також вимірює швидкість зсувної хвилі (SWS – share wave speed), без формування зображення, і класифікується тут, як SWE.
5 – SWS може бути виражена у вигляді або зсувного модуля G або модуля Юнга E, виходячи з припущень, які пояснюються в даній статті.
Динамічні сили допускають абсолютну кількісну оцінку властивостей тканини. Вони включають в себе імпульси і безперервні вібрації, які можуть проводитися механічно на поверхні тіла або глибоко всередині тіла з використанням сили акустичного радіаційного тиску. На рис. 1 показано тільки імпульсні динамічні сили, тому що наявні комерційні ультразвукові системи з еластографією, як і раніше, не використовують безперервно вібраційну енергію, хоча є приклади цього в літературі, в опублікованих дослідженнях з ультразвукової еластографії [4-6]. Це відрізняється їх від магнітно-резонансної еластографії (МРЕ), де безперервна гармонійна вібрація, індукована на поверхні тіла, є найбільш поширеним методом [7-9].
Обробка сигналу всередині сканеру для всіх сучасних комерційних ультразвукових еластографічних методик починається з вимірювань зміщення тканин, як функції просторового розташування і часу, з використанням крос-кореляційного трекінгу, доплерівського або іншого способу обробки. Різні методи еластографії відрізняються один від одного тим, що вони роблять з цими даними вимірювань зсуву тканин для створення еластогрфічних зображень (власне еластографії) або вимірювання еластичності (еластометрії). Існують три варіанти відображення властивостей тканини (Рис.1, стовпець 4):
а) Відображення зсуву без подальшої обробки (Рис.1, рядок 2), як при формуванні зображення на основі сили акустичного радіаційного тиску (ARFI). Зсув тканини пов’язано з зсувною деформацією. Чим більше сила, тим більше зміщення, але більш жорсткі тканини зміщуються в меншій мірі, ніж м’які тканини. Жорсткість визначається як сила, прикладена до тканини, поділена на зміщення тканини, що виникає. Якщо передбачається, що сила (зазвичай не відома) однакова для всіх зон на зображенні, можна припустити, що зображення зсуву є зворотньою картою відносної жорсткості (вона є зворотньою, тому що чим жорсткіше тканина, тим менше зміщення). Зверніть увагу на те, що жорсткість визначається не тільки механічними властивостями тканини, але також і геометричними факторами, такими як площа поперечного перерізу зразка тканини, до якого застосовується сила. Хоча саме зміщення є кількісним, яскравість зображення зазвичай зподіляється за шкалою відносними категоріями між м’яким (яскравим) і твердим (темним).
в) Відображення деформації або ступіня деформації тканини (на рис. 1, рядок 1), яка розраховується по просторовому градієнту зсуву або швидкості, відповідно, як при стрейнновій/компресфйній еластографії (SE – strain elastography). Зсув зображень працює добре, коли чітко локалізовані сили застосовуються на глибині, як при візуалізації ARFI. Однак, коли сила прикладена до великої області поверхні тіла, напруження тканини забезпечує краще вимірювання деформації, тому що, на відміну від зсуву, воно не зменшується з глибиною. Модуль Юнга Е є істинною властивістю тканини, який вимірюється осьовим стисканням зразка тканини відносно його загальної площі поперечного перерізу уздовж його довжини. Він дорівнює прикладенному напруженню σ, поділеному на виміряну деформацію ε, так званий відомий закон Гука Е = σ/ε, де напруження є прикладеною силою на одиницю площі, а деформація – зміна довжини зразка, поділена на його вихідну довжину. Якщо передбачається, що напруження (зазвичай не відоме) однаково для всіх зображень, зображення деформації можна розглядати, як зворотню відносну карту модуля Юнга (воно є зворотнім, оскільки чим вище модуль Юнга, тим менше деформація). Хоча сама деформація є кількісним вимірюванням (одиниця в %), яскравість зображення зазвичай розподіляється за шкалою відносними категоріями між м’яким (яскравим) і твердим (темним).
с) Відображення швидкості зсувних хвиль (SWS – share wave speed) ( Рис.1, рядки 3-7), обчислюється з використанням даних зсуву в часі для вимірювання проміжку появи зсувної хвилі в різних зонах. Всі подібні методи згруповані під загальним терміном зсувнохвильової еластографії (ЗХЕГ, SWE – share wave elastography), і включають в себе: транзієнтну еластографію (TE – transient elastography), точкову зсувнохвильову еластографію (рSWE – point SWE ) і багатовимірну зсувнохвильову еластографію (2D-SWE і 3D-SWE).
Це можливо тільки тоді, коли сила прикладена динамічно. Зсувна деформація, що виникає локально і миттєво в тканині, поширюється як зсувна хвиля, до тих пір, поки не буде повністю ослаблена по ходу її переміщення, досягає віддаленого місця розташування за певний час, який визначається як швидкість зсувної хвилі – cs. Швидкість зсувної хвилі може відображатися в одиницях мс-1. В якості альтернативи, припускаючи, що вона не змінюється в залежності від величини або частоти прикладеної сили, або від положення і напрямку в тканині, cs може бути перетворена або в модуль Юнга Е, або в зсувний модуль G з використанням рівнянь Е = 3ρcs2 та G = E/3 (припускаючи, що тканина є нестисливою, де ρ – щільність тканини. Увага! Обидва модулі E і G виражаються в однакових одиницях кілопаскалях (кПа). Вибір того, чи відображати швидкість ЗХ в м/с або модуль в кПа, може залежати від бажання користувача, або такий вибір може бути недоступним (іноді визначається регулюючими органами для конкретного регіону, в якому сканер або вимірювальна система виготовлені або продані).
Пояснення: В літературі по MRЕ типово представлені дані про зсувний модуль G, тоді як в літературі з ультразвукової еластографії, найчастіше наводяться значення для модуля Юнга Е. Читачеві слід бути обережним при порівнянні даних по опублікованих статтях, так як обидві величини виражені в одних і тих же одиницях (кПа) і E = 3G. При публікації результатів досліджень важливо вказати, який модуль було виміряно при використанні одиниць кПа, уникаючи неспецифічних термінів, таких як жорсткість, і необхідно сказати, як він був розрахований.
Причини, за якими ультразвук може використовуватися для отримання еластограм.
Ультразвук – це поширення короткочасної деформації щільності. У м’яких тканинах він рухається зі швидкістю 1350-1600 мс-1, тоді як зсувна деформація йде значно повільніше, в діапазоні 1-10 мс-1 [10]. Ця різниця в швидкості означає, що ультразвук може використовуватися для вимірювання зсувів тканини в точних фазах зсувної деформації. Ультразвук має також відносно невелике загасання, що дозволяє проводити вимірювання зсувів з високою роздільною здатністю в кілька мікронів на глибині декількох сантиметрів. Крім того, спекл в ультразвукових зображеннях дозволяє вимірювати переміщення тканини, навіть коли немає чітко диференційованих тканинних структур для трекінгу.
Відмінності між еластограмами і ультразвуковими зображеннями.
Контрастність тканин у всіх видах еластограм потенційно дуже висока, так як вона пов’язана з різницею в зсувному модулі G, який змінюється більш ніж на п’ять порядків в усіх м’яких тканинах в порівнянні з об’ємним модулем K, який коливається приблизно на 12% (для В-режиму*). Ультразвук здатний поширюватися через рідину, а в тканинах молекулярна композиція в значній мірі визначає швидкість і абсорбцію ультразвуку, тоді як зсувна хвиля не поширюватиметься в нев’язкій чистій рідині і передається в основному через високорівневу структуру тканини. Хоча ультразвукове розсіювання відбувається на великомасштабному структурному рівні, воно також виникає на клітинному рівні і не вимагає, щоб структура була цілісною. З іншого боку, зсув не буде поширюватися через розриви нульового тертя в структурній матриці. Наприклад, розбавлена суспензія клітин у фізіологічному розчині буде розсіювати ультразвук, але не буде підтримувати зсувну деформацію або зсувну хвилю. Нарешті, що дуже важливо, на відміну від ситуації при поширенні і розсіянні ультразвуку, зсувний модуль більшості тканин збільшується зі зростанням судинного і інтерстиціального тиску. Ці особливості можуть зробити еластографію чутливою до наявності захворювання в ситуаціях, коли звичайне ультразвукове зображення не може його виявити.
Технологія ультразвукової еластографії
Типи еластографії, вище згадані, і комерційно доступні системи показані на рис. 1. Зверніть увагу, що вони можуть бути взаємодоповнюючими у багатьох відношеннях для загального клінічного застосування. Для застосувань в печінці, найбільш поширені методи, які показують швидкість зсувної хвилі (SWS), потім іде візуалізація зміщення (для вогнищевих уражень в печінці) і, нарешті, візуалізація деформації.
Компресійна еластографія (SE) і візуалізація ступіня деформації (SRI): квазістатична візуалізація деформації (Рис.1, рядок 1)
Компресійна еластографія, хоча і залишається найбільш широко застосовуваним методом еластографії в комерційних системах, вона є найменш використовуваним методом для досліджень печінки. Оскільки рух відбувається в результаті компресії ультразвуковим датчиком або фізіологічного руху, зображення осьового/аксіального зсуву між послідовно отриманими ехо-зображеннями ультразвуку розраховується з використанням або радіочастотного відстеження кореляції ехо-сигналів, або доплерівської обробки (при використанні доплерівської обробки цей метод часто називають зображенням швидкості деформації). Аксіально-градієнтна система вікна, що рухається, перетворює зображення осьового зсуву в зображення деформації. Мало що змінилося в доступних системах діагностики, артефактах, перевагах і недоліках візуалізації деформації, хоча тенденція полягає в підвищенні стійкості, використанні більшої кількості методів вибору якості кадру і пікселю, а також підвищенню чутливості, що дозволяє отримувати ефективну еластограму з невеликою, або взагалі відсутністю компресії оператором на деяких системах, покладаючись на мимовільні рухи рук оператора або фізіологічні рухи в тілі пацієнта. Рекомендації щодо напівкількісного аналізу зображень деформацій, наприклад, з використанням коефіцієнтів деформації і гістограм деформації, залишаються такими ж, як описано в [1].
Візуалізація за допомогою імпульсу акустичної радіаційної сили (ARFI): зображення зміщення тканини, індуковане радіаційною силою (Рис.1, рядок 2)
Осьовий зсув для локалізацій, розташованих нижче заданої лінії зображення поруч і навколо одного поштовхового фокуса, вимірюється шляхом порівняння місць розташування ехосигналу і/або спеклу тканини візуалізованих імпульсів, випромінюваних до і відразу (<1 мс) після поштовху. Зображення зміщення в невеликій області інтересу ( ОІ, region of interest – ROI) генерується шляхом повторення послідовності імпульсів «image-push-image» для послідовності A-ліній в ROI. ARFI залишається фірмовою технологією візуалізації Siemens Virtual Touch ™, яка описана в 2013 році, при цьому переваги, недоліки і різні графічні артефакти методу залишаються незмінними [1]. Методика не використовується для оцінки дифузних захворювань печінки (якісна ARFI*).
Зсувнохвильова еластографія (SWE); методи, які використовують швидкість зсувної хвилі.
Транзієнтна еластографія (ТЕ): зсувнохвильова еластометрія шляхом вимірювання швидкості зсувної хвилі, яка генерується за допомогою поверхневого імпульсу (Рис.1, рядок 3)
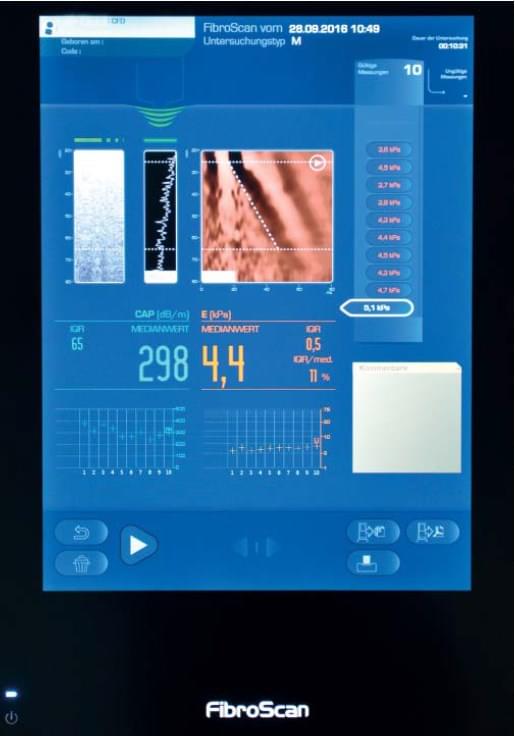
Незважаючи на назву, це не єдиний метод, який використовує транзієнтну (короткочасну) силу. Всі динамічні методи на Рис. 1 використовують аналогічний алгоритм. Ця техніка призначена тільки для вимірювання еластичності печінки, а також для використання особами, які не є фахівцями з діагностичної візуалізіції. Автоматичний рух поршня, який також є ультразвуковим датчиком у формі диска, генерує однотактний імпульс 50 Гц з контрольованою силою, що прикладена до поверхні тіла. Короткочасна (транзієнтна) зсувна деформація, створена таким чином, поширюється в глибину тканини. Практично постійна швидкість може бути визначена в печінці на протязі близько 4 см (до того, як вона перестає визначатися через згасання). Швидкість вимірюють по прямій лінії, автоматично встановленій в M-режимі зсуву, що показана праворуч на рис. 2, отриманому шляхом обробки ехо-сигналу ультразвукової радіочастоти в А-режимі в залежності від часу.
Рис. 2 Транзієнтна еластографія за допомогою Fibroscan ™. Приклад зображення, яке показує ехо M-сканування зліва на екрані, лінійну амплітуду ехо в A-режимі в середині і відображення зсуву в M-режимі праворуч після контрольованого вібраційного імпульсного поштовху на поверхні (повне пояснення див. в [1]).
Точкова зсувнохвильова еластографія (pSWE): зсувнохвильова еластометрія у визначеній точці шляхом вимірювання швидкості зсувної хвилі, що генерується за допомогою тиску акустичної радіаційної сили (Рис.1, рядок 4)
Коли ARFI застосовується в глибині всередині тканини, генерується зсувна хвиля. Середня швидкість поширення ЗХ (SWS) від фокусної точки, розташованої на одній бічній межі ROI до іншої протилежної бічної межі ROI, може бути виміряна шляхом визначення часу досягнення ЗХ цієї точки, що і відбувається при ARFI. Як і у випадку з TE, не створюються ніякі еластограми. Вимірюється тільки локальне середнє значення SWS. Однак ультразвукове дослідження в В-режимі* використовується для визначення місця розміщення ROI, і вимірювання може проводитися навіть тоді, коли необхідно проводити діагностику через асцит. Інші переваги і недоліки описані в [1]. Основне оновлення, з моменту виходу [1], полягає в тому, що, як зазначено на Рис. 1, тепер все більше виробників надають цей тип вимірювання, який був відомий як кількісне ARFI (quantification), що вперше було запроваджено Siemens. В даний час ця технологія також пропонується Esaote, GE, Hitachi, Philips і Samsung.
Якість вимірів SWS визначається алгоритмами оцінки SWS в системах pSWE і може попереджати користувача, якщо значення не є достовірним.
Багатовимірна зсувнохвильова еластографія (2D-SWE, 3D-SWE): кількісна SWE візуалізація (і еластометрія) шляхом вимірювання швидкості зсувної хвилі, що генерується за допомогою акустичної радіаційної сили (Рис.1, рядки 5-7)
Метод, описаний вище для pSWE, може бути розширений, з метою отримання кількісних зображень SWS у великому ROI. При цьому ARFI фокус (поштовх) поміщається по глибині в декількох послідовних зонах, і в кожній з них виявляється час появи зсувної хвилі в декількох латеральних зонах. Це створює фрагменти невеликих SWS-зображень, які можуть бути елементами «мозаїки», для створення великого ROI з 2D-SWE зображенням, яке кодується в кольорі або у відтінках сірого. При цьому картинка може накладатися з регульованою прозорістю на зображення в B-режимі або, опційно, зображення SWE і B-режим можуть відображатися окремо поруч, side-by-side. На додаток до візуального оцінювання таких еластограм на колірній шкалі (каліброваній в м/с або кПа), вони можуть бути кількісно проаналізовані з використанням вимірювальних контрольних об’ємів (КО). Ці КО можна розміщувати в досліджуваних зонах для отримання статистичних величин, таких як середнє, стандартне відхилення, мінімальне і максимальне значення SWS або модуля Юнга в кПа (хоча мінімум часто не є корисним, через відсутність даних про його значимість). Потрібен час для послідовних поштовхів і вимірювань в декількох місцях. Тому, в деяких системах, створюється статичне зображення SWE (приблизно через 700 мс на Siemens S3000 ™), яке може повторюватися після команди користувача, після необхідного часу для охолодження датчика. У SuperSonic Imagine Aixplorer ™ 2D-SWE-зображення «в режимі реального часу» (до декількох кадрів в секунду) створюються з використанням поєднання аксіально розташованих фокусів поштовхів. Це створює за глибиною лінію з фокусів поштовхів в ROI SWE зображення і зсувну хвилю, яка повинна затухати повільніше, ніж хвиля від одного складового фокуса поштовху. Ехо-зображення генеруються тисячами кадрів в секунду, використовуючи плоскі ультразвукові хвилі при генерації і високопаралельне формування променя на прийомі, що дозволяє виявляти час появи зсувних хвиль в численних зонах, без необхідності генерування багаторазових поштовхових імпульсів ARFI.
Основним оновленням в порівнянні з [1] є те, що інші виробники, включаючи Toshiba, GE, Philips і Mindray, тепер випустили продукти 2D-SWE, які в цілому аналогічні, але відрізняються по деталях методу і частоті дискретизації.
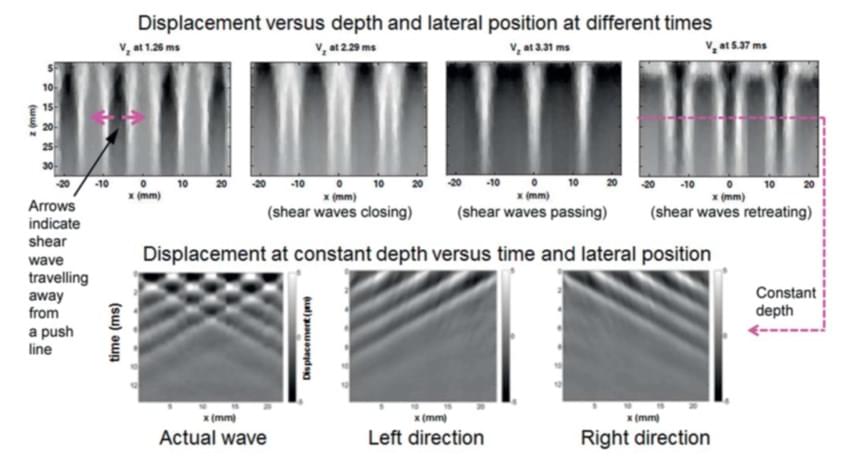
Toshiba, Philips і Mindray, схоже, впровадили традиційний поштовховий метод ARFI, подібний до Siemens. Mindray використовує високопаралельне формування променя і зоновану минаючу хвилю, для реєстрації переміщення зсувної хвилі зі швидкістю понад 1000 кадрів в секунду в областях шириною до 4 см. Philips також використовує високопаралельну обробку, що дозволяє вільно переміщатися 2D-SWE по областям до 5 см у висоту і на 7 см в ширину з використанням абдомінального конвексного датчика з частотою кадрів 0,4-1,6 Гц, в той час як основний B-режим працює з частотою 20 Гц для візуального наведення (ріс.3b). GE впровадила методику «comb push» гребінчастого поштовху [11], яка (як показано на рис. 4) генерує поштовхи уздовж ряду ліній ARFI одночасно. Як наслідок, зсувні хвилі поширюються, віддаляючись від різних поштовхових ліній, та проходять одна через одну. Щоб уникнути плутанини у визначенні часу появи зсувних хвиль, що поширюються в різних напрямках, система аналізує час появи на постійній глибині в залежності від положення в бічному напрямку і використовує фільтрацію Фур’є для поділу хвиль, що рухаються вліво, від тих, що рухаються вправо. Комбінація інтерполяції за часом з результатами трекінгу зміщення дозволяє отримати прийнятно великий коефіцієнт перетворення 2D-SWE, приблизно за 100 мс, з використанням звичайного (апаратного) формувача променю.
Зверніть увагу, що фільтрація напрямку також використовується іншими виробниками, так як вона має додаткову перевагу зменшення артефактів вимірювання SWS, які, наприклад, обумовлені відображеннями зсувної хвилі на межах зсувного імпедансу (де або змінюється щільність тканини, або швидкість зсувної хвилі).
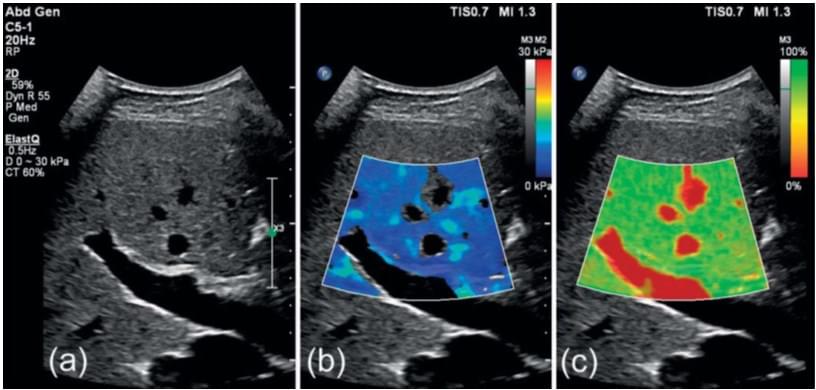
Рис. 3. Приклад 2D-SWE в печінці b, реалізований на Philips EPIQ™ , який може відображатися одночасно з зображенням в B-режимі a, та з картою достовірності c, як описано в тексті.
Рис. 4. Техніка «comb push» гребінчастого поштовху в GE LOGIQ E9™, яка включає в себе спрямовану фільтрацію зсувної хвилі для SWE з використанням звичайного (апаратного) формувача променю [12].
Також стала поширеною в останніх 2-SWE системах (наприклад, Toshiba, GE, Mindray) можливість вибору між безперервно обновлюваним зображенням (майже в режимі реального часу) і більш повільним зображенням, яке вважається, більш якісним одиночним кадром.
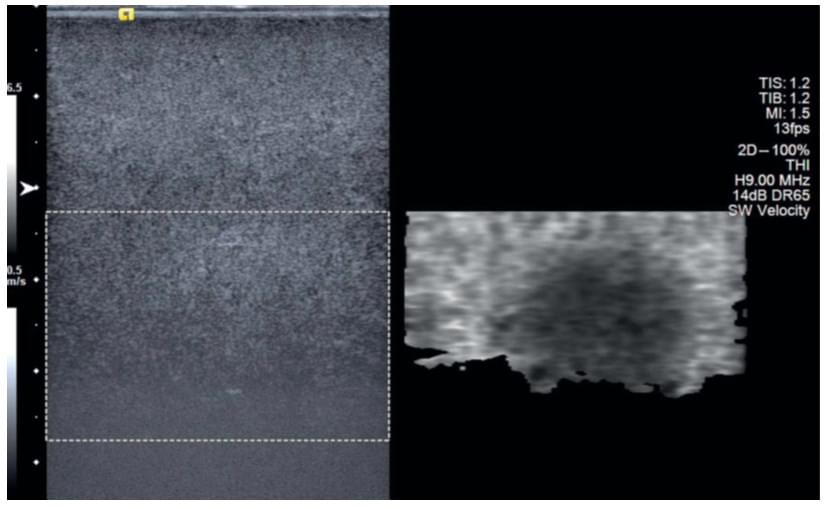
Всі 2D-SWE системи мають вбудовані індикатори якості оцінки швидкості зсувної хвилі і вживають відповідні дії для налаштування відображення, коли якість падає дуже низько, наприклад, при появі неправильного пікселю при накладенні 2D-SWE зображення, існує можливість переглянути зображення в B-режимі, або встановити цей піксель як чорний колір. Як правило, це відбувається в міру погіршення співвідношення сигнал/шум з глибиною, що обмежує можливість проникнення 2D-SWE, як в прикладі, показаному на рис. 5.
Рис.5. Приклад паралельного (side-by-side) відображення B-режиму (зліва) і SWE-зображення (праворуч) фантома, що містить сферичне включення, яке мало або зовсім не контрастує щодо фону, але є більш м’яким, ніж фон. Це говорить про те, що випадання пікселю при SWE при слабкому співвідношенні сигналу до шуму на великій глибині, знижує якість оцінки швидкості зсувної хвилі нижче допустимого, таким чином, обмежуючи глибину проникнення SWE.
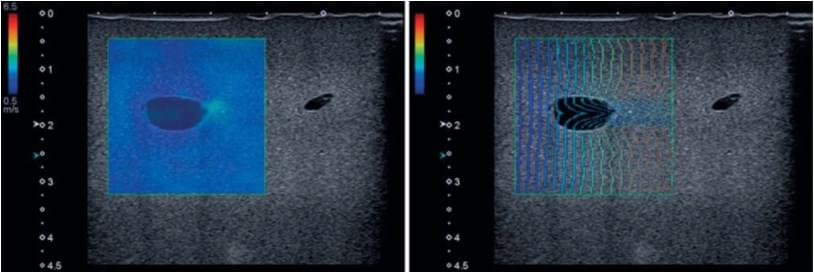
Додатковий підхід до оцінки якості представлено Toshiba, як показано на рис. 6 (праворуч), який опційно відображає на дисплеї зареєстрований час появи зсувної хвилі в стилі «хвильового фронту» – Propagation (розповсюдження).
Рис. 6. Ілюстрації колірного накладення SWE (зліва) і «хвильового фронту» Propagation, який відображає час появи зсувної хвилі (праворуч) на системі Toshiba Aplio 500 ™, що відображає артефакти. Використовувався фантом для підготовки до біопсії, що містить кістоподібні включення, які є ехонегативними, але твердими і злегка більш жорсткими, ніж фон.
Концепція Propagation полягає в тому, що, якщо послідовні лінії паралельні (навіть якщо вони хаотичні), якість прийнятна. Але не прийнятно, якщо вони не паралельні. На показаному зображенні можна бачити, що лінії часу появи хвилі все далі одна від одної, коли швидкість зсувних хвиль збільшується (див. зображення зліва). Здається, що зсувна хвиля поширюється зліва направо, стаючи неправильної за формою, коли вона з’являється праворуч від відносно жорсткого включення, де на еластограмі з’являється більш жорстка область на задньому плані. Але непаралельні лінії часу появи хвилі на зображенні праворуч показують, що це артефакт.
Philips надає додаткову опційну карту достовірності (Рис.3c), яка об’єднує кілька показників якості зображення, які можуть відображатися альтернативно з еластограмою, і яка допомагає оператору проводити вимірювання (в режимі онлайн або ретроспективно по збереженим зображенням) в зонах, де висока достовірність оцінки SWS.
Зазвичай можна встановити ROI з довжиною сторін в кілька сантиметрів, а глибина проникнення 2D-SWE зображення може бути як мінімум 8 см, в залежності від використовуваної системи і датчика. Розширення для отримання 3D кількісних SWE-зображень (3D-SWE) до теперішнього часу були обмежені використанням 3D датчиків, які складаються з механічно модифікованих матриць 1D датчиків. Така функція доступна в SuperSonic Imagine Aixplorer™, яка дозволяє скористатися перевагою 2D-SWE в реальному часі для отримання набору 3D-SWE зображень.
Більшість переваг, недоліків і артефактів для SWE візуалізації залишаються такими, як обговорювалося в [1]. Тиск датчика при контакті зі шкірою призводить до того, що поверхневі тканини стають жорсткішими через нелінійний характер напруження-деформації тканини, але отриманий артефакт швидкості з високою швидкістю зсувної хвилі зазвичай не є проблемою для візуалізації печінки, оскільки він виникає тільки поблизу її поверхні.
Слід зазначити, що відсутність ехо-сигналу на зображенні в B-режимі не завжди призводить до відсутності сигналу SWE, як це повинно відбуватися в кістозній структурі (наприклад, на рис. 6 зліва). Артефактний сигнал SWE може виникати в результаті взаємодії між відносно великою товщиною зрізу, типовою для більшості зображень SWE, і обмеженими вертикальними розмірами кістозної структури. Аналогічний вплив фону на кількісні значення швидкості зсувної хвилі можна очікувати для будь-яких невеликих структур, незалежно від того тверді вони або кістозні, жорсткі або м’які.
Глибина проникнення різних технологій.
У випадку, коли SE покладається на застосування квазистатичної деформації поверхні тіла, а не на внутрішній фізіологічний рух, обмежена площа датчика (поряд з іншими факторами) викликає швидке загасання деформації з глибиною дослідження. Це обмежує використання SE тільки в самих поверхневих областях печінки, хоча використання додаткового розширення контактної поверхні датчика може збільшити глибину, на якій можна ефективно оцінити інформацію про деформацію.
При динамічних деформаціях, які використовують методики SWE, як і для ультразвукових хвиль, затухання зсувних хвиль в тканини збільшується з частотою, за винятком того, що коефіцієнт загасання для зсувних хвиль приблизно в 1014 разів вище, ніж для ультразвуку з тією ж частотою [13]. В результаті, для створення зсувних хвиль для еластографії, повинні використовуватися дуже низькі частоти вібрації, що збуджує їх. Коли для створення зсувних хвиль використовуються механічні джерела на поверхні тіла (як при TE), потрібно проникнення зсувних хвиль на багато сантиметрів, що вимагає використання частот в десятки Гц. Коли сфокусований ARFI використовується для створення зсувних хвиль, цим хвилям немає необхідності досягати досліджуваної глибини, поширюючись від поверхні, тому можуть використовуватися більш високі частоти зсувних хвиль (сотні Гц). Тут глибина проникнення досягається пучком ультразвуку, який використовується для генерації зсувної хвилі. Незважаючи на те, що зсувна хвиля може переміщатися тільки на коротку відстань (через її більш високу частоту), іншу зсувну хвилю можна легко генерувати в новому положенні джерела, використовуючи інший промінь ARFI.
Хоча довжина хвилі приблизно в тисячу разів менше для зсувних хвиль, ніж для ультразвукових хвиль з тією ж частотою, той факт, що частоти для SWE настільки малі, означає, що довжина зсувних хвиль знаходиться в області декількох сантиметрів (довжина хвилі = швидкість, поділена на частоту). Тому такі джерела зсувної хвилі, як поверхневі демпфери або імпульси спрямованої акустичної радіаційної сили, як правило, менше довжини самої хвилі і створюють зсувні хвилі, що розходяться. Проте, описаний вище метод ультразвукового фокусування ARFI-фокуса швидший, ніж SWS, який використовувався для створення лінійного джерела в глибині тканини, і може бути використаний для створення джерела, яке, в якійсь мірі, є сфокусованим.
КПа або мс-1?
Як згадувалося в 1.2c), деякі системи SWE дозволяють вибирати шкалу зображення, при цьому вимірювання можуть бути представлені в одиницях мс-1 (м/сек) або кПа. Існує більш ніж одна причина, по якій краще представляти результати в одиницях мс-1, а не в кПа. По-перше, це одиниця швидкості зсуву хвилі cs, яка є величиною, виміряною при скануванні. Якщо користувач запитує результати в кПа (одиницях модуля пружності), система повинна перетворювати виміряні дані в модуль пружності, такий як модуль Юнга Е. Це перетворення зазвичай використовує дуже просте рівняння E = 3ρcs2. Як і в більшості простих рівнянь, зроблено багато припущень, але вони, як правило, недостовірні. У цьому випадку ці припущення включають наступне:
а) щільність тканини завжди становить 1000 кг/м3. Це може бути не завжди вірно, хоча помилка, обумовлена допущенням, може бути невеликою.
в) модуль пружності не змінюється з величиною прикладеної сили (тобто, величини поштовхового імпульсу, який генерує зсувну хвилю, або ж будь-яке попереднє напруження, таке як тиск датчиком або портальна гіпертензія, на які накладається поштовховий імпульс). Це еквівалентно припущенню, що еластична відповідь тканини має лінійну залежність. Загалом, це невірно, і очевидно, в майбутньому очікується, що величина нелінійності буде визнана важливою властивістю тканин.
с) модуль пружності не змінюється з частотою зсувної хвилі. Це еквівалентно припущенню, що тканина є ідеально еластичною, хоча фактично всі тканини є в’язкоеластичними, і це означає, що тканина стає більш жорсткою, ніж більше вона деформується, тобто чим вище частота.
d) модуль пружності не змінюється з напрямком, тобто тканина механічно є ізотропною, хоча майже всі тканини мають анізотропний характер по довжині.
е) не існує ніяких меж або структур тканин поблизу, які можуть привести до того, що хвиля буде переміщатися інакше, як інший тип хвилі (наприклад, хвилі Лемба або Релея) або розсіювати зсувні хвилі. Все це позбавляє спроможності передбачуваного зв’язку між швидкістю і модулем пружності.
Той факт, що ці припущення можуть бути невірними для багатьох тканин, робить модуль пружності непрямим виміром. Точне перетворення вимірюваної швидкості в модуль Юнга вимагає набагато складніших рівнянь і багатьох інших вимірювань і, як правило, неможливе. Швидкість зсувної хвилі є прямим вимірюванням, і, наприклад, США «U.S. Food and Drug Administration» до сих пір тільки затвердила системи для продажу, які використовують цифрові еластографічні дисплеї в одиницях SWS.
По-друге, значення модуля пружності тканини в літературі часто наводяться для G, модуля зсуву, а не для модуля Юнга. Зокрема, це характерно для літератури по МРЕ. Обидва модулі мають одиниці кПа, що може ввести в оману, вважаючи, що дані можуть бути об’єднані, тоді як чисельні значення для двох модулів різні. Перетворення з використанням співвідношення E = 3G можливо з припущенням, що тканина нестислива, але для застосування цього співвідношення автори повинні вказати, який модуль вимірюється.
Нам видається, що результати звітності на користь SWS (ms-1) вирішують ці проблеми. Однак це не звільняє вченого від необхідності надавати повну інформацію про всі вищезазначені експериментальні змінні (a-e), особливо про частоту зсувних хвиль, оскільки SWS буде змінюватися з кожною з них.
Нарешті, хоча і рекомендується використовувати SWS, а не модуль пружності, все ж існують свої складності. По-перше, це вимірювання в’язкопружності, які ймовірно, будуть проводитися на ультразвукових еластографічних системах. Це вже стосується МРЕ, де результати часто фігурують як комплексний модуль зсуву з реальними і уявними компонентами. Це означає, що ситуацію з ультразвуковою еластографією необхідно буде тримати в полі зору, хоча найкращим методом (а не майбутнім переключенням на непряме вимірювання, таке як комплексний зсувній модуль) може бути представлення прямих вимірювань, таких як SWS і коефіцієнт згасання зсувної хвилі, а також їх частотні залежності. Важливо розуміти, що через квадрат співвідношення між модулем і швидкістю, середні і стандартні відхилення, розраховані для даних, записані в мс-1 і потім перетворені в кПа, не будуть дорівнювати середнім і стандартним відхиленням, обчисленим після першого перетворення вихідних даних в кПа. Це справедливо для наборів даних пацієнтів, а також для середніх і стандартних відхилень, розрахованих для ROI для неоднорідних тканин. Враховувати цю проблему необхідно при спробі об’єднання даних.
Порівнянність даних між різними технологіями SWE
Як уже зазначалося, виміряні значення SWS будуть варіюватися в залежності від ряду системних факторів, зокрема частоти вібрації і ширини смуги зсувної хвилі. Крім того, похибка вимірювання може виникати через програмний метод, що використовується. Наприклад, для розрахунку часу і відносної швидкості зсувної хвилі. Таким чином, хоча завжди бажано передавати якомога більше експериментальних та системних змінних, в даний час поправки для ефектів цих змінних не можливі. Тому, якщо не буде проведено спеціальне дослідження для отримання експериментального фактора в певній тематичній популяції, з метою корекції діапазону даних для різного устаткування, не слід об’єднувати дані, які отримані з використанням більш однієї системи. Важливо відзначити, що пороги жорсткості для клінічного використання, відомі для конкретного обладнання, не повинні використовуватися для іншого обладнання. Якщо не доведено інше, ця рекомендація повинна застосовуватися не тільки до обладнання від різних виробників, але навіть до різного устаткування одного і того ж виробника або різноманітних параметрів для одного і того ж обладнання. Наприклад, повідомляється про залежності від глибини в вимірі SWS. Таким чином, стандартизація встановлення глибини повинна використовуватися при накопиченні даних всередині популяції.
Навчання фахівців
EFSUMB працює над підвищенням якості ультразвукової освіти і підтримує відмінні професійні стандарти в області навчання і практики еластографії [14]. Для забезпечення найменшої можливої внутрішньодослідницької варіабельності EFSUMB рекомендує, щоб ультразвукова еластографія виконувалася фахівцями, що пройшли кваліфікацію 1-го рівня. Однак також може бути можливим навчання спеціально підготовленого персоналу тільки для проведення еластографічних вимірювань [15]. З практики застосування TE [16, 17] відомо, що необхідний період навчання досить короткий, і це також спостерігалося і в дослідженнях з використанням ультразвукової еластографії [18, 19]. Проте, нам здається, що досвід в ультрасонографії печінки відіграє важливу роль в здатності виконувати вимірювання жорсткості, як мінімум за допомогою візуалізації зсувних хвиль, і призводить до більш надійних еластографічних вимірювань, особливо у пацієнтів з ожирінням [20].
Досвід фахівця істотно впливає на надійність вимірювання жорсткості печінки (LSM – liver stiffness measurement), що виконується за допомогою TE, при цьому фахівець з досвідом менше ніж 500 процедур, в 2,6 рази частіше представляє недостовірні результати [21, 22]. TE може бути легко опанована медсестрою або техніком, після приблизно 100 досліджень [16, 17]. 100 досліджень повинні вважатися мінімально необхідними для підготовки, а навчання, що включає більше 500 процедур, характеризує досвідченого фахівця ТЕ.
Не існує єдиної думки про те, що являє собою досвідчений фахівець для pSWE і 2D-SWE. Можливі визначення для 2D-SWE включають в себе виконання понад 300 ультразвукових сканувань черевної порожнини або більше 50 контрольованих досліджень 2D-SWE [20, 23].
Залишається головне питання: кому дозволено проводити дослідження і інтерпретувати дані еластографії? На сьогоднішній день в літературі недостатньо даних для достовірної відповіді на це питання. Проте, проведення TE може здійснюватися медсестрами або особами, що мають спеціальні повноваження. Навчання не клініцистів має ґрунтуватися на стандартах звітності. Інтерпретація повинна проводитися лікарем, який знає клінічний стан пацієнта. Ключовою проблемою є отримання достовірної компетентності та навчання, а також виконання еластографії відповідно до медико-правових норм відповідної країни. Наступні рекомендації відповідають рекомендаціям EASL.
Основні принципи і технологія еластографії були розроблені академічною дослідною спільнотою перед її комерційним запропонуванням, при цьому ця область продовжує інтенсивно вивчатися і розвиватися. EFSUMB рекомендує користувачам постійно оновлювати свої знання в цій галузі.
| РЕКОМЕНДАЦІЯ 1
Оператор повинен отримати відповідні знання та пройти навчання з ультразвукової еластографії (LoE 5, GoR C). Сильний консенсус (13/0/0, 100%) |
| РЕКОМЕНДАЦІЯ 2
Збір даних повинен проводити спеціалізований і спеціально навчений персонал. Для pSWE і 2D-SWE досвід в ультразвуковому дослідженні в B-режимі є обов’язковим (LoE 5, GoR C). Сильний консенсус (13/0/0, 100%) |
Зсувнохвильова еластографія (TE, pSWE і 2D-SWE), загальні технічні коментарі
Вступ
Печінка є важливим таргетним органом для використання еластографії; її жорсткість корелює зі ступенем фіброзу і опосередковано з портальною гіпертензією.
Процедура обстеження
Пацієнти повинні обстежуватися в положенні лежачи на спині з правою рукою в максимальному розгинанні. Датчик розташовується в правому міжреберному просторі для візуалізації правої частки печінки в A- або B-режимі. Слід уникати артефактів і великих судин в A-режимі (TE) або B- режимі (pSWE і 2D-SWE). Оптимальна якість вимірювань pSWE і 2D-SWE спостерігається при ROI, розміщеному як мінімум на 1 – 2 см, і максимум на 6 см нижче капсули печінки [24-27]. На думку авторів, фокус В-режима повинен бути відрегульований на рівні ROI.
Глибокий вдих впливає на вимірювання. Оптимальний стан затримки дихання – в нейтральному положенні. Детальна інформація про методи обстеження приведена в конкретних розділах. Вимірювання в лівій частці печінки значно вищі, і мають більшу варіабельність, ніж в правій частці [28, 29]. 2D-SWE LSM найкраще корелює зі стадією фіброзу печінки, коли вони отримані в верхніх відділах правої частки печінки [30]. Вимірювань LSM в лівій частці печінки слід уникати. Час, необхідний для вимірювання TE, pSWE і 2D-SWE, зазвичай < 5 хвилин [31].
| РЕКОМЕНДАЦІЯ 3
Вимірювання жорсткості печінки за допомогою SWE має виконуватися через правий міжреберний проміжок в положенні лежачи на спині, при цьому права рука розгинається під час затримки дихання, при цьому потрібно уникати глибокого вдиху при затримці дихання (LoE 2b, GoR B) [1, 32]. Сильний консенсус (18/0/0, 100%) |
| РЕКОМЕНДАЦІЯ 4
Вимірювання жорсткості печінки за допомогою SWE має виконуватися досвідченими фахівцями (LoE 2b, GoR B) [1, 32]. Сильний консенсус (18/0/0, 100%) |
| РЕКОМЕНДАЦІЯ 5
Вимірювання жорсткості печінки за допомогою pSWE і 2D-SWE має виконуватися як мінімум на 10 мм нижче капсули печінки (LoE 1b, GoR A) [24-27, 32-35]. Сильний консенсус (18/0/0, 100%) |
Голодування та фізичний спокій
Прийом їжі збільшує виміряні показники (незалежно від фіброзу) протягом 120-180 хвилин після їжі [36-38]. Більш того, вживання їжі значно збільшує медіанний міжквартільний інтервал (IQR) на 30 і 120 хвилинах, в порівнянні з вихідним IQR [39]. Це може привести до помилкової класифікації суб’єктів дослідження за рахунок переоцінки стадії фіброзу, що мало місце у пацієнтів, інфікованих вірусом гепатиту С (ВГС). Це може навіть призвести до перебільшення стадії, аж до прецирозу або цирозу, при цьому нормальні значення під час голодування були підтверджені біопсією печінки. Повідомляється, що вимірювання зменшується до істинних значень приблизно через 180 хвилин після їжі [36]. В ідеалі дослідження слід проводити після нічного голодування, при цьому утримуючись від їжі/напоїв (особливо від кофеїну) і від куріння. Крім того, оскільки фізичні вправи підвищують жорсткість печінки, пацієнти повинні обстежитися після, як мінімум, 10-20 хвилин відпочинку [40].
| РЕКОМЕНДАЦІЯ 6
Пацієнтам слід голодувати мінімум 2 години і відпочивати мінімум 10 хвилин перед вимірюванням жорсткості печінки за допомогою SWE (LoE 2b, GoR B) [1]. Консенсус більшості (13/2/3, 72%). |
Фактори, що впливають на жорсткість печінки незалежно від фіброзу печінки (спотворюючі чинники).
Жорсткість печінки не тільки відображає фіброз печінки, але може відображати багато інших фізіологічних або патологічних станів. Більшість цих змінних були описані в дослідженнях, присвячених ТЕ, але вони повинні бути однаковими і для інших методів SWE. Жорсткість печінки збільшується при запаленні печінки (часто, але не виключно, пропорційно підвищенню рівню трансаміназ) [41-44], обструктивному холестазі [45] і печінковій недостатності [46, 47]. Гострий токсичний гепатит (фенпрокумон-індукована печінкова недостатність) також збільшує вимірювання [48]. Для пацієнтів з хибно підвищеними даними LSM через алкогольний гепатит, жорсткість печінки знижується після 1-4 тижнів абстиненції [49-51]. Інші захворювання, які викликають підвищену жорсткість печінки, незалежно від фіброзу печінки, включають: амілоїдоз, лімфоми та екстрамедулярний гемопоез. В даний час невідомо, чи впливає печінковий стеатоз на жорсткість печінки [52, 53], чи ні [54, 55].
| РЕКОМЕНДАЦІЯ 7
Перед проведенням LSM за допомогою SWE слід виключити основні потенційні фактори ризику (запалення печінки, дані підвищення АСТ і/або АЛТ > в 5 разів вище нормальних меж, обструктивний холестаз, печінкову недостатність, гострий гепатит і інфільтративні захворювання печінки), для того, щоб уникнути переоцінки фіброзу печінки (LoE 2b, GoR B) і/або враховувати їх при інтерпретації результатів SWE (LoE 1b, GoR B) [41-46, 49-51, 56-59]. Широкий консенсус (15/0/1, 94%) |
Нормальні значення
TE вимірювання модуля Юнга у здорових людей варіюють між 4,4 і 5,5 кПа (95-й процентиль 6,7 кПа) [60-63]. LSM, як правило, вище у чоловіків, ніж у жінок [60, 61]. На показник може впливати стеатоз [60], але не впливає вік [62, 63]. Вимірювання pSWE з використанням Virtual Touch Quantification (VTQ®) в здорових групах варіюються від 1,01 до 1,59 м/с, але в більшості досліджень діапазон становить 1,07-1,16 м/с [28, 29, 33, 34, 64-67]. Вік не впливає помітно на SWS, оцінений за допомогою VTQ® [28, 29, 67]. Всі дослідження, за винятком одного [33], також не знайшли кореляції між показниками індексу маси тіла (ІМТ) і SWS. Глибина, яка визначається відстанню від капсули до шкіри, може впливати на значення SWS, оцінені за допомогою VTQ® [28]. У здорових дітей середнє значення SWS, отримане в правій частці печінки, в одному дослідженні становило 1,07 ± 0,10 м/с [68] і 1,12 м/с (діапазон від 0,73 до 1,45 м/с ) в іншому [69]. Що стосується впливу віку, є суперечливі результати, оскільки одне дослідження повідомляє про статистично значущу різницю значень SWS, отриману у дітей < 6 років, у порівнянні з даними, отриманими у дітей більш старшого віку, в той час як інше дослідження не виявило відмінностей [68 , 69]. Глибина вимірювань SWS до 5 см під шкірою не впливала на точність [68, 69].
Значення, отримані за допомогою кількісної точкової еластографії (ElastPQ®) у здорових людей, можна порівняти з результатами, отриманими за допомогою VTQ® [70-72], хоча на відміну від результатів VTQ®, вимірювання з використанням ElastPQ® були на 8% вище у здорових чоловіків, ніж у здорових жінок [72].
Вимірювання модуля Юнга 2D-SWE з використанням Supersonic Imaging (SSI) у здорових осіб охоплюють діапазон 4,5-5,5 кПа (95-й процентіль 6,2 кПа) [73, 74]. У здорових чоловіків можуть бути вищі LSM, ніж у здорових жінок, в той час як ІМТ і вік, мабуть, не впливають на LSM у пацієнтів без захворювання печінки [74].
Для всього обладнання, показники SWE в межах норми, у суб’єктів без інших клінічних або лабораторних ознак захворювання печінки, можуть виключити значний фіброз печінки з високим ступенем достовірності.
Нещодавно була узагальнена сучасна література [75].
| РЕКОМЕНДАЦІЯ 8
SWE в межах нормального діапазону може виключати значний фіброз печінки, якщо він узгоджується з клінічним і лабораторним фоном (LoE 2A, GoR B) [60, 61]. Широкий консенсус (17/0/1, 94%) |
Транзієнтна еластографія (TE)
Техніка
При транзієнтній еластографії використовується зображення зміщення x в М-режим і A-режимі, що створюється системою. Оператор знаходить ділянку печінки товщиною, щонайменше, 6 см і без великих судинних структур. Натиснувши кнопку початку дослідження, машина відображає медіану виміряного модуля Юнга в кПа, IQR (різниця між 75-м і 25-м процентілями), IQR/медіану (IQR/M), значення поточного вимірювання і, тільки в старій версії системи, показник успіху (співвідношення між достовірними і загальною кількістю спроб). Система відображає результат тільки в тому випадку, якщо спроба є достовірною, так як програмне забезпечення автоматично відхиляє спробу без правильної форми вібрації або правильним подальшим поширенням вібрації [1, 32, 76].
Нова версія системи пропонує використовувати М або XL-датчик у дорослих суб’єктів, на підставі розрахунків відстані від шкіри до капсули печінки. Для дітей, а також дорослих з окружністю грудної клітини ≤ 75 см рекомендується S-датчик, S1 для окружності грудної клітини <45 см, або S2 для 45-75 см [77].
Як вимірювати?
Відповідно до рекомендацій виробника, дані надійні, коли отримано 10 достовірних результатів і IQR ≤ 30% від медіани (IQR/M ≤ 30%). Більшість досліджень використовували ці критерії надійності, а також показник успіху ≥ 60%. Зіставлені площі під кривою робочої характеристики приймача (AUROC – аrea under the receiver operator characteristics curves) для прогнозування цирозу між медіанними значеннями 3 перших, 5 перших і 10 перших успішних спроб TE [78]. Про значні втрати достовірності не повідомлялося, якщо було отримано тільки 5 достовірних спроб. Ймовірно, IQR/M є ключовим фактором невідповідності між ТЕ і стадією гістологічного фіброзу [79, 80]. У недавньому великому популяційному дослідженні були запропоновані нові критерії надійності, засновані на IQR/M і медіанних даних LSM [81]. Згідно з цим дослідженням, результати ТЕ повинні класифікуватися як «дуже надійні», якщо IQR/M ≤ 10%, незалежно від LSM; «надійні», якщо 10% <IQR/M ≤ 30% або IQR/M> 30% з модулем Юнга <7,1 кПа і «недостатньо надійними», якщо IQR/M> 30% з модулем Юнга ≥ 7,1 кПа. Однак ці критерії не були підтверджені. Належна ТЕ оцінка може бути досягнута у більш ніж 90% дорослих, коли обидва датчика M і XL використовуються по мірі необхідності [82 – 85]. Так як М датчик вимірює відстань між 25 мм і 65 мм від датчика, для підвищення достовірності пацієнтів з відстанню від шкіри до капсули печінки (SCD – skin-to-liver capsule distance) більше 25 мм слід оцінювати за допомогою XL датчика. На практиці <8% пацієнтів з ІМТ<30 кг/м2 мають SCD>25 мм. Частота, коли зустрічається SCD> 25 мм збільшується до 50% для пацієнтів з ІМТ 35-40 кг/м2 [86].
Хоча проблема надмірної ваги пацієнтів не повністю вирішена за допомогою датчика XL [85, 87], ефективність використання TE збільшується, коли доступні обидва M і XL датчики [82 – 85, 88 – 91]. Діагностична точність датчика XL схожа на точність вимірювання для М датчика, але значення модуля Юнга нижче, ніж отримані з допомогою датчика М, в середньому на 1,5 кПа (діапазон 0,8-2,3 кПа) [82 – 85, 92]. Більш низькі значення, отримані за допомогою XL датчика, можуть бути пояснені тим фактом, що перевірка XL-датчика у пацієнтів з надмірною масою тіла проводилася в порівнянні з М датчиком. У цих пацієнтів існує висока ймовірність SCD> 25 мм, і вимірювання, отримані з датчиком M, ймовірно, будуть більш субкапсулярними і, отже, більш високими [93].
| РЕКОМЕНДАЦІЯ 9
Повинні бути отримані 10 вимірювань. IQR/M ≤ 30% 10 вимірювань є найважливішим критерієм надійності (LoE 1b, GoR A) [79, 80]. Сильний консенсус (17/0/0, 100%). |
| РЕКОМЕНДАЦІЯ 10
Значення, отримані за допомогою XL датчика, зазвичай нижчі, ніж для М датчика. Таким чином, не може бути дана однозначна рекомендація по використанню порогових значень (LoE 2B, GoR B) [82 – 85, 87]. Широкий консенсус (13/1/3, 77%) |
Відтворюваність
Відзначено відмінне внутрішньо- і міждослідницьке узгодження, з озвученими внутрішньокласовими коефіцієнтами кореляції (ВКК) вище 0,90 [94 – 96]. Узгодження погіршується у пацієнтів з надмірною вагою або на ранніх стадіях фіброзу [94, 95]. Незважаючи на те, що LSM, мабуть, можливо відтворити в різних зонах дослідження, найкращим місцем дослідження є медіанна пахвова лінія в першому міжреберному проміжку під верхнім краєм перкуторної печінкової тупості, пацієнт знаходиться при цьому в положення лежачи на спині [95].
Точкова зсувнохвильова еластографія (pSWE)
Досвід застосування точкової зсувнохвильової еластографії (pSWE) в основному був отриманий з продуктом VTQ®, оскільки це був перший доступний метод, за яким послідували ElastPQ®, а останнім часом – методи pSWE багатьох компаній.
Техніка (як вимірювати?)
Оператор може вибрати глибину, на якій оцінюється жорсткість печінки, шляхом розміщення вимірювальної мітки (розмір залежить від виробника) в правій частці (сегмент V, VIII або VII) через міжреберний проміжок, з розташуванням датчика під кутом 90 ° по відношенню до капсули печінки, в зоні, вільній від великих судин. Опубліковані дослідження [97 – 99] показують, що надійні вимірювання можуть бути отримані у > 90-95% пацієнтів. У дослідженні pSWE з використанням VTQ® для вимірювання SWS [24], найкраща кореляція з гістологічним фіброзом спостерігалася для вимірювань, виконаних на 1-2 см і 2-3 см від капсули печінки (0,675 і 0,714 відповідно), але до 15% випадків, вимірювання не могли бути отримані при виконанні на глибині 2-3 см від капсули печінки.
| РЕКОМЕНДАЦІЯ 11
Достовірне зображення печінки в B-режимі є необхідною умовою для вимірювань pSWE і 2D-SWE (LoE 5, GoR D). Сильний консенсус (18/0/0, 100%) |
Скільки вимірювань?
Більшість досліджень виконують 10 достовірних вимірювань за допомогою pSWE і розраховують середнє з цих величин. У кількох дослідженнях використовувалося тільки 5 [99, 100] або 6 [101] достовірних вимірювань. В іншому дослідженні [102] розраховано середнє і стандартне відхилення (SD) 10 достовірних вимірювань. Високий рівень SD корелює з помилковою класифікацією фіброзу. Крім того, більш високі стадії фіброзу були пов’язані з більш високим SD, що побічно вказує на те, що у пацієнтів з підозрою на фіброз має бути проведено більше вимірювань.
| РЕКОМЕНДАЦІЯ 12
Для еластографії печінки слід використовувати значення, щонайменше, 10 вимірювань для pSWE (LoE 2b, GoR B) [102] Сильний консенсус (18/0/0, 100%) |
Відтворюваність
pSWE володіє чудовою внутрішньо- і міждослідницькою відтворюваністю для проведення еластографії печінки як у здорових осіб, так і у пацієнтів з хронічним захворюванням печінки [66, 70, 72, 103 – 105].
Здорові суб’єкти
У дослідженні з вимірювання SWS, була оцінена відтворюваність VTQ® у 50 здорових добровольців. Був знайдений дуже хороший ВКК (0,86) [66]. Вік, стать і ІМТ не впливали на відтворюваність цього методу. Аналогічні результати (ВКК = 0,87) були отримані [103] у 20 здорових осіб. У когорті з 69 здорових суб’єктів, ElastPQ® показав дуже хорошу внутрішньо- (ВКК = 0,96) і міждослідницьку (ВКК = 0,93) відтворюваність [70].
Пацієнти
Відтворюваність SWS при VTQ®, була оцінена у 61 пацієнта з хронічними захворюваннями печінки [104]. Були застосовані наступні граничні значення для стадій фіброзу печінки з використанням SWS: F≥2 – 1,37 м/с; F≥3 – 1,45 м/с і F4 – 1,75 м/с. Було 87% узгодження між повторними вимірюваннями для різних стадій фіброзу. Для диференціації між пацієнтами зі значним фіброзом (F≥2 Metavir) і з фіброзом стадії F <2, внутрішньодослідницьке узгодження було 90%. В іншому дослідженні [19] відмінне узгодження (ВКК = 0,84) спостерігалося в когорті з 50 пацієнтів з різної етіології хронічного захворювання печінки. Інші автори [101] оцінили кореляцію значень SWS, отриманих за допомогою VTQ® 2-ма фахівцями у 41 пацієнта з хронічними захворюваннями печінки. Була отримана хороша кореляція між фахівцями (коефіцієнт кореляції Спірмена r = 0,874, p <0,0001) з аналогічними результатами [99, 100, 105]. Відтворюваність VTQ® для значень SWS і факторів, що впливають, оцінювалася у 33 і 58 пацієнтів відповідно. Загальне внутрішньодослідницьке узгодження було краще, ніж міждослідницьке узгодження: ВКК 0,90 проти ВКК 0,81. Як для внутрішньо-, так і для міждослідницької відтворюваності, ВКК були нижче у жінок і чоловіків (0,88 проти 0,91 і 0,67 проти 0,86 відповідно), у пацієнтів з високим ІМТ (25 кг/м2), проти ІМТ <25 кг/м² (0,88 проти 0,91 і 0,79 проти 0,82, відповідно), у пацієнтів з асцитом порівняно з відсутністю асциту (0,80 проти 0,93 і 0,78 проти 0,84 , відповідно) і у пацієнтів без цирозу і з цирозом (0,77 проти 0,82 і 0,70 проти 0,83 відповідно) [106]. Міждослідницька відтворюваність методу ElastPQ® була оцінена у 291 послідовного пацієнта з хронічним гепатитом B (ХГВ), які зазнали часткової гепатектомії або біопсії печінки внаслідок гепатоцелюлярної карциноми (ГЦК). Досягнуто дуже хорошої відтворюваності цієї методики (ВКК = 0,798) з аналогічним висновком, зробленим в подальшому дослідженні [70].
Критерії якості
Коли метод VTQ® був вперше впроваджений, не було ніяких рекомендацій щодо використання критеріїв якості вимірювань. В одному з досліджень [107] оцінювалися фактори, які впливали на кореляцію SWS, що оцінюється VTQ®, з гістологічним фіброзом в когорті з 106 пацієнтів з хронічним гепатитом С (ХГС). При однофакторному і багатофакторному аналізі, IQR/M ≥ 30% асоціювався з невідповідністю, щонайменше, двох стадій фіброзу між SWS і гістологічним фіброзом. Важливість IQR, як критерію якості, була продемонстрована в іншому дослідженні [108]. Ще в одному дослідженні оцінювалася важливість стандартного відхилення (SD), як критерію якості [102]. В даному дослідженні були прийняті 10 правильних вимірювань SWS, і було розраховано середнє значення. Автори отримали наступну точність для прогнозування наявності F≥2, F≥3 і F = 4 у всіх когортах пацієнтів: 80,7%, 86,2% і 88,7%, відповідно. Після виключення пацієнтів з SD> 30%, достовірність VTQ® для прогнозування тих же стадій фіброзу печінки значно зросла до 86,1%, 91,2% і 91,5%, відповідно. При використанні ElastPQ®, недавнє дослідження показало, що IQR/M ≤ 30% є найбільш важливим критерієм якості, тоді як кількість вимірювань, мабуть, не впливає на продуктивність, за умови, що їх буде, щонайменше, п’ять [109 ]. Таким чином, узгодження з критеріями якості, може підвищити діагностичну точність pSWE [102, 107]. Параметри якості були описані і для інших виробників [110].
2D-SWE
Майже всі дослідження 2D-SWE для печінкової патології проводилися з використанням SSI, тому що інші компанії тільки недавно представили свої 2D-SWE продукти. Тому це опис обмежений системою SSI, але принципи можуть бути застосовані до інших систем 2D-SWE.
Процедура
Отримання еластограми
2D-SWE оцінка повинна проводитися в добре візуалізованій області правої частки печінки, вільної від великих судин, печінкової капсули, зв’язок і жовчного міхура [30]. Оскільки рух сильно впливає на результати, пацієнтові пропонується затримати дихання.
При 2D-SWE в безперервному режимі (не з однократним випромінюванням імпульсу), вимірювання SWE триває протягом 4-5 секунд (може бути і більше для інших систем сканування) до тих пір, поки буде отримано стабільне зображення SWE. Оператор повинен прагнути до однорідного кольорового заповнення SWE ROI. При SSI, масштаб еластограми може бути змінений. Зазвичай достатній масштаб модуля Юнга до 30 кПа, але й більш високий масштаб, до 150 кПа, може прийматися індивідуально. Оператор «заморожує» зображення (і, якщо потрібно, зберігає кліп для подальшої пост-обробки), діагностична мітка (Q Box, для SSI) поміщається на найбільш однорідну стабільну еластограму на кілька секунд для вимірювання модуля Юнга (SWS, якщо сканер налаштований на цей режим). Досвід, як показує практика, грає роль в проведенні надійного вимірювання, особливо у пацієнтів з ожирінням [20]. Однак єдине розуміння того, що являє собою досвідчений оператор 2D-SWE, відсутнє. Мінімальною вимогою може бути досвід, як мінімум, 300 ультразвукових досліджень черевної порожнини [20]. 2D-SWE вимірювання жорсткості печінки повинно проводитися досвідченими операторами після досягнення стабільної однорідної еластограми [20, 23].
Як вимірювати?
Розмір і форма діагностичної мітки (Q-Box).
Для вимірювань 2D-SWE діагностичний контрольний об’єм (КО) повинен бути налаштований як мінімум на 10 мм, переважно на 15 мм або більше. Зазвичай вибирають круглу форму [57, 58]. ROI слід розміщувати над ізоехогенною ділянкою паренхіми печінки, на основі зображення у відтінках сірого (без судин, без вузликів і без інших структур), переважно по середній лінії еластограми (уникаючи позиціонування Q-Box по краях еластограми), при цьому необхідно уникати SWS артефактів (реверберація, зони з шумом від затінення ребер).
Достовірні і недостовірні вимірювання
Відсутня чіткі дані про об’єктивні критерії якості. Деякі автори вважають, що мінімальне значення модуля Юнга ≤ 0,2 кПа в КО для аналізу ефективно для ідентифікації помилкових вимірювань, про що свідчить відсутність узгодження при ТЕ [111], в той час як інші використовують мінімальний модуль Юнга <1 кПа. Крім того, серед достовірних вимірювань, IQR/M ≤ 30% рекомендується іншими дослідженнями, що імітують критерії надійності TE. Останній критерій, однак, не підтверджується доказами. Для 2D-SWE з Logiq E9 (GE), виробник рекомендує використовувати значення IQR/M нижче 30% в якості критерію якості.
Тимчасова стабільність еластограми протягом трьох секунд або більше під час затримки дихання, в поєднанні з розміщенням діагностичної мітки в однорідній області з повним заповненням, сприяє високій точності, стійкості і невисокій дисперсії вимірювань при дослідженні за допомогою SSI [112 – 114]. Нова версія програмного забезпечення системи Aixplorer® також показує індекс стабільності (ІС), і, відповідно до виробника, надійні дані LSM повинні виключати вимірювання з ІС < 90%.
Aplio 500 (Toshiba) забезпечує відображення зсувних хвиль, що переміщаються всередині діагностичної мітки, що дозволяє обрати області для аналізу, які не схильні до впливу артефактів. Для 2D-SWE з системою Philips, карта достовірності дозволяє оператору виконувати вимірювання в областях, де є високе відношення сигналу до шуму при SWS оцінці.
Дані, що відносяться до найкращих надійних критеріїв оцінки якості – обмежені. Отже, рекомендації з проведення досліджень, які пропонуються виробником, сформульовані без оптимальної доказової бази [56, 112 – 114].
Скільки вимірювань?
В опублікованих дослідженнях використовуються від 3 до 15 вимірювань, але дані деяких досліджень говорять про достатню кількість з 3-х вимірювань, для отримання достовірних узгоджених результатів для оцінки фіброзу печінки і портальної гіпертензії, і для оптимальної кореляції з TE [27, 58, 59, 114 – 116 ]. Деякі дослідження представляють дані у вигляді медіани, деякі у вигляді середньої величини наявних вимірювань. Переконливих доказів на користь переваги середнього значення в порівнянні з медіанною величиною при SSI немає. Однак, так як медіана і IQR стійкі до неефективного розподілу даних, їм мається надаватися перевага для проведення звітності.
| РЕКОМЕНДАЦІЯ 13
Для 2D-SWE має бути отримано мінімум три вимірювання; кінцевий результат повинен бути виражений у вигляді медіани разом з міжквартильним діапазоном (LoE 2b, GoR B) [27, 117]. Сильний консенсус (18/0/0, 100%) |
Відтворюваність
Відтворюваність у здорових суб’єктів
У трьох дослідженнях внутрішньодослідницька відтворюваність SSI, протягом одного і того ж сеансу, була відмінною (ВКК варіювалася від 0,92 до 0,95) [23, 73, 118]. Міждослідницьке узгодження в різні дні залежало від досвіду оператора і варіювалося від 0,63 до 0,84 [23, 118].
Відтворюваність у пацієнтів
Внутрішньодослідницька відтворюваність 2D-SWE для оцінки жорсткості печінки у пацієнтів з фіброзом печінки була відмінною, в опублікованих дослідженнях ВКК від 0,90 до 0,95 [56, 57, 117]. Внутрішньосуб’єктна відтворюваність (яка оцінювалася в строках від 2 днів до 4 тижнів) перебувала в діапазоні від 0,83 до 0,90 [31]. Міждослідницька відтворюваність в той же день коливалася від 0.83 [31] до 0.94 [112]. Внутрішньо-і міждослідницька варіабельність при використанні VTQ® може бути гірше, ніж при pSWE [31].
Обмеження
Помилки
Помилки – найчастіше визначаються як «неможливість отримати достовірний сигнал у всіх спробах» – зустрічаються в 10% випадків, згідно з опублікованими серіями. Типовими причинами помилок є: глибина нижче 4-5 см [26], погане ультразвукове вікно, реверберація, пульсуючий рух, неадекватна затримка дихання, велика кількість асциту [117], товщина стінки міжреберних проміжків ≥ 25 мм [119], ІМТ ≥ 30 кг/м2, гістологічний стеатоз і окружність талії ≥ 102 см [57, 59].
Ненадійні вимірювання
Ненадійні вимірювання визначаються в різних дослідженнях довільно, і їх порівняння обмежено. Опубліковані предиктори недостовірних результатів при SSI схожі на предиктори для TE і pSWE [56, 117]. В одному дослідженні нижчі значення стандартного відхилення (SD) і більший розмір діагностичного КО незалежно корелювали з правильною класифікацією тяжкого фіброзу і цирозу [114].
Основними факторами, що обмежують можливість використання 2D-SWE, є ожиріння, погане акустичне вікно, наявність артефактів і нездатність пацієнтів затримувати дихання [26, 56, 57, 59, 117].
Компресійна еластографія (SE): квазістатична візуалізація деформації
Техніка
Необхідно краще ультразвукове зображення в B-режимі, оскільки компресійна еластографія в реальному часі (SE) залежить від якості зображень в B-режимі. Техніка може бути поліпшена таким чином [32]:
▪ візуалізують праву частку печінки через міжреберний простір, в положенні пацієнта на спині з піднятою правою рукою, з метою розширення міжреберного простору;
▪ злегка помістіть датчик на шкіру, не переміщаючи його, оскільки внутрішнього, переважно серцевого, руху достатньо для зміщення тканини. Однак, іноді оператор повинен викликати повторювані зміни тиску за допомогою датчика для створення необхідного натягу, необхідного для вимірювання деформації;
▪ виберіть необхідну область інтереса (ОІ), в якій зображення в B-режимі вільні від анатомічних структур і артефактів;
▪ отримуйте зображення, яке відображає осьовий, а не бічний або вертикальний рух, для цього направляйте датчик до серця.
Попросіть пацієнта короткочасно затримати подих, щоб переконатися, що зображення SE відображаються послідовно [120].
Розташування та розмір діагностичної області інтересу
Подібно pSWE і 2D-SWE, діагностична ОІ повинна бути поміщена, як мінімум, на 1 см нижче капсули печінки [120, 121]. Вимірювання не повинні проводитися дуже глибоко в паренхімі, так як акустичні тіні, артефакти реверберації і недостатня проникаюча здатність, будуть давати неадекватно високі значення. Деякі дослідники включають навколишні тканини, такі як підшкірний і м’язовий шари [122, 123]. Проте, розміщення OI цілком всередині печінки є ключем до генерування однорідних зображень для розрахунку індексу фіброзу печінки (ІФП) [124]. Великих судин слід уникати з використанням OI 2,5×2,5 см [120, 125]. Усунення артефактів вимагає уваги до техніки. Контроль розміщення датчика між ребрами призводить до оптимального розташування. Якщо дослідження утруднено, спробуйте інший міжреберний проміжок, можливо, більш м’який і з більш тонким підшкірним шаром. Інші підшкірні структури, такі як ребра і легені, не повинні включатися в зображення. Для аналізу слід вибрати кадри з компресією, що генерується в напрямку глибини без артефактів. Хороші зображення можуть бути отримані в кінці діастоли з електрокардіографічним стробіюванням або при найбільшій низхідній хвилі контрольної кривої компресії/декомпресії*.
Методи оцінки
Досвід оператора впливає на результат візуальної оцінки. Щоб подолати це обмеження, були розроблені різні кількісні і напівкількісні методи для більш об’єктивної оцінки деформації тканин. У науково-дослідній літературі було показано, що індекси «розпізнавання зразків зображення», отримані шляхом аналізу зображень в сірій шкалі, гістограм і бінаризації SE зображень, корелюють з фіброзом печінки. Зображення деформації перетворюється в числові значення, наприклад, з використанням колірних градацій, при цьому синій колір дорівнює 0, а червоний – 255. Деякі автори повідомляють, що середні значення деформації зворотньо корелюють з жорсткістю печінки і фіброзом у пацієнтів з ХГС. З іншого боку, стандартне відхилення значень деформації, відсоток площі низької деформації і її складність, мали позитивну кореляцію з жорсткістю печінки і фіброзом [126].
Бальна оцінка
Були запропоновані різні бали для напівкількісної інтерпретації SE: німецька бальна шкала еластичності [121], японська бальна шкала еластичності [126] і ІФП [127]. ІФП (алгоритм, заснований на дев’яти функціях, оцінених безпосередньо програмним забезпеченням) є єдиним, який рекомендований виробником [32]. Однак доказова база недостатня, щоб рекомендувати його клінічне застосування, принаймні, у європейських пацієнтів [121, 125].
Відтворюваність (опублікована література)
Міждослідницька постійність між чотирма окремими ділянками в печінці з використанням напівкількісного методу була майже ідеальною (ICC 0,97) [128]. З іншого боку, внутрішньодослідницька варіабельність і внутрішньодослідницьке узгодження SE для оцінки фіброзу печінки зазнали критики в декількох дослідженнях [121, 125]. Однак оновлені дані відсутні.
| РЕКОМЕНДАЦІЯ 14
Методи об’єктивної оцінки фіброзу печінки методом деформації розробляються, але в даний час не можуть бути рекомендовані в клінічній практиці (LoE 5, GoR D). (Консенсус 18/0/0, 100%). |
ПОРІВНЯННЯ РЕЗУЛЬТАТІВ МІЖ СИСТЕМАМИ
Вступ
Для неінвазивної оцінки фіброзу печінки доступні різні ультразвукові технології SWS, а отримані вимірювання можуть злегка відрізнятися в різних системах від різних виробників. Навіть системи, які використовують один і той же метод, але розроблені різними виробниками, можуть давати різні значення через різні і запатентовані методи вимірювання SWS. Крім того, одиниці виміру можуть становити метри в секунду, якщо швидкість зсувної хвилі виражається в м/с або кПа, якщо для обчислення використовується модуль Юнга або зсувний модуль. Існує і інша потенційна різниця: передбачається, що SWS не залежить від частоти зсувної хвилі, що є неправильно, оскільки більш високі частоти генерують зсувні хвилі, які розповсюджуються швидше. «Помилка дисперсії» призводить до того, що результати різних досліджень не піддаються порівнянню.
Дослідження на фантомах
The Ultrasound Shear Wave Speed technical committee of the Radiological Society of North America, Quantitative Imaging Biomarker Alliance (QIBA, Технічний комітет з швидкості ультразвукової зсувної хвилі радіологічного товариства Північної Америки, Альянс біомаркерів кількісної візуалізації) дали кількісну оцінку відмінностей між комерційно доступними системами. Було проведено міжлабораторне дослідження, що порівнює швидкості зсувних хвиль, отриманих чотирма різними машинами (Fibroscan, Philips iU22, ACUSON S2000 і Aixplorer) [129]. У роботі з еластичними фантомами показана статистично значуща різниця в оцінках SWS серед систем і глибиною виміру в фантомі, тоді як статистично значущих відмінностей серед операторів, які використовують однакові або еквівалентні системи в тих же умовах, не виявлено [129]. Аналогічні результати були отримані з використанням фантомів з в’язкопружними властивостями, аналогічними тим, які спостерігаються в нормальній і фіброзній печінці [130]. Вимірювання проводились на декількох фокусних глибинах (3,0, 4,5 і 7,0 см). Найглибша фокусна глибина (7,0 см) давала найбільшу міжсистемну варіабельність для кожного фантома (до 17,7%), що оцінювалося по міжквартильному діапазону. Міжсистемна варіабельність була послідовною у всіх фантомах і не була пов’язана з жорсткістю.
Джерела варіабельності
В опублікованих дослідженнях детально описані кілька джерел варіабельності, включаючи технічні і залежні від пацієнта фактори, які можуть вплинути на можливість порівняння між системами.
Технічні фактори
Глибина вимірювань
Як показали дослідження на фантомах [129], вплив глибини на оцінку пружних властивостей є значущим. Крім того, з конвексними датчиками, використовуваними при візуалізації печінки, кут впливає на показники, причому найкращі результати досягаються, коли OI знаходиться під прямим кутом. При використанні VTQ®, було показано, що результати з найменшою варіабельністю отримані на глибині 4-5 см з конвексним датчиком (1-4 МГц, середній поштовховий імпульс: 2,67 МГц) і на глибині 2 – 3 см з лінійним датчиком (4 -9 МГц, середній поштовховий імпульс: 4 МГц) [131]. Акустичний поштовховий імпульс поступово послаблюється у міру проходження тканини. Ослаблення вище в більш жорсткій тканині печінки. Таким чином, вимірювання у пацієнтів з цирозом більш варіабельні [25].
Частота датчика
У проспективному дослідженні 89 пацієнтів з ХГС, pSWE (на основі VTQ®) була виконана з використанням обох доступних датчиків (4C1 і 9L4) [132]. Лінійний датчик давав більш високі значення (1,91 ± 0,87 м/с, проти 1,70 ± 0,67 м/с). Однак результати корелювали один з одним (r = 0,70). Використовуючи той же метод на фантомі і в серії з восьми добровольців, було виявлено, що конвексний датчик показував значення, які були значно вище, ніж отримані з лінійним датчиком [131].
Положення датчика
Найвище внутрішньо- і міждослідницьке узгодження було отримано для вимірювань, проведених через міжреберний проміжок, а не підреберним доступом [72, 103, 133].
Досвід оператора
Методи, які використовують pSWE, показали відмінне міждослідницьке узгодження, з показниками в межах від 0,80 до 0,97 для вимірювань, виконаних з використанням міжреберних підходів і незалежно від досвіду оператора, що передбачає, що фахівцеві потрібні тільки короткий період навчання для виконання надійних LSM [66, 70, 103, 106]. При використанні 2D-SWE (SSI), експерт-оператор мав більш високу відтворюваність вимірювань з плином часу, ніж початківець-оператор [23]. Передбачається, що, щонайменше, 50 контрольованих 2D-SWE вимірювань повинні виконуватися початківцем-оператором для отримання постійних і достовірних вимірювань.
Було також продемонстровано, що новачок зміг досягти достовірних результатів з TE після однієї сесії навчання. Проте, рівень успішних вимірювань поступово зростав з досвідом оператора [16]. Також повідомляється, що досвід роботи оператора покращує можливість використання і підвищує діагностичну точність ТЕ [92]. Echosens, виробник пристрою FibroScan, рекомендує, щоб TE виконувався досвідченим оператором (> 100 обстежень).
Недавнє дослідження показало, що при використанні біопсії печінки, як еталонного стандарту, точність ElastPQ® відповідала ТЕ, після того, як оператор провів не менше 130 досліджень [134].
Устаткування
Запатентовані еластографічні технології зазвичай дають різні показники SWS в межах однієї і тієї ж печінки. Це призводить до необхідності визначення порогових значень для стадій фіброзу для кожної конкретної моделі обладнання.
Пацієнт-залежні фактори
Найважливішими факторами варіабельності різних еластографічних методів, що залежать від пацієнта, є: положення (положення лежачи на спині використовується в більшості опублікованих досліджень), фаза дихання (глибокий вдих впливає на оцінку; затримка вдиху на кілька секунд під час спокійного дихання призводить до кращих результатів) [ 25, 29, 135], стан без голодування [36-38], стадія фіброзу (передбачається, що більш низькі стадії фіброзу печінки [94, 136, 137], або наявність стеатозу [52], знижують відтворюваність ТЕ).
Патологічне ожиріння обмежує застосування методів еластографії (TE XL-датчик, pSWE) і знижує точність вимірювання [138]. Теоретична можливість того, що значення будуть різні, а не ідентичні в різних частинах печінки, навіть в одній і тій же зоні, також може внести свій вклад в варіабельність між різними типами обладнання, про яке повідомляється в багатьох дослідженнях. На жаль, в більшості досліджень немає вказівки на те, чи використовувався той же міжреберний проміжок і та ж зона на печінці для попереднього і остаточного дослідження.
Клінічні дослідження
Точність діагностики
AUROC ElastPQ® і VTQ® для прогнозування наявності фіброзу печінки були подібними (0,85 і 0,82, p = 0,48) [71]. Інші автори порівнювали 2D-SWE (SSI), VTQ® і TE у 349 послідовних пацієнтів з хронічними захворюваннями печінки [57]. Вони виявили, що 2D-SWE, TE і VTQ® значно корелювали з показником гістологічного фіброзу (r = 0,79, r = 0,70, r = 0,64 відповідно, все p <0,00001). AUROC 2D-SWE, TE і VTQ® склали 0,89, 0,86 і 0,84, відповідно, для діагностики легкого фіброзу; 0,88, 0,84 і 0,81, відповідно, для діагностики значного фіброзу; 0,93, 0,87 і 0,89, відповідно, для діагностики тяжкого фіброзу; 0,93, 0,90 і 0,90, відповідно, для діагностики цирозу. 2D-SWE має більш високу точність, ніж TE для діагностики тяжкого фіброзу (≥F3) (p = 0,0016) і більш високу точність, ніж VTQ® для діагностики значного фіброзу (≥F2) (p = 0,0003). Для діагностики легкого фіброзу і цирозу не було виявлено достовірних відмінностей. Аналогічне порівняння було проведено у пацієнтів з НАЖХП [57]: 2D-SWE методика мала більш високу точність, ніж VTQ® для діагностики значного фіброзу (≥F2) (р = 0,004).
У дослідженні 132 пацієнтів з хронічним захворюванням печінки порівнювали 2D-SWE, pSWE (VTQ®) і TE. Референтними методами були біопсія печінки для оцінки фіброзу печінки (n = 101) та магнітно-резонансна томографія/комп’ютерна томографія для діагностики цирозу печінки (n = 31). Між трьома методами еластографії для діагностики значного і прогресуючого фіброзу, а також цирозу печінки в когортах «згідно з протоколом» і «з метою постановки діагнозу» не було виявлено суттєвої різниці в діагностичній точності [57].
У кількох дослідженнях були зіставлені результати, отримані за допомогою методик SWE (pSWE, 2D-SWE), засновані у B-режимі, з результатами ТЕ. Було встановлено, що точність цих методів аналогічна точності TE [59, 139, 140]. Деякі порівняльні дослідження показують схожу точність для різних еластографічних систем. Потрібні великі проспективні дослідження, щоб визначити, чи є відмінності в точності між різними системами оцінки жорсткості печінки.
| РЕКОМЕНДАЦІЯ 15
Результати з найменшою варіабельністю при порівнянні різних систем pSWE або 2D-SWE були отримані на глибині 4-5 см від датчика (з конвексними датчиками) (LoE 4, GoR C) [131]. Відповідно, ця зона рекомендується, якщо це технічно прийнятно. Широкий консенсус (17/0/1, 94%) |